一文读懂丨免疫相关肿瘤反应评估标准
导读
随着肿瘤精准治疗日益受重视,越来越多的靶向药物,包括血管生成抑制剂,免疫调节剂,信号转导抑制剂,DNA损伤调节剂,激素制剂等被应用于临床实践。免疫治疗制剂是一种独特的新型治疗制剂,免疫治疗患者的影像学表现可能与传统细胞毒性治疗不同。免疫治疗的患者可能会表现出延迟反应,肿瘤萎缩,大小稳定,然后短暂肿瘤增大,或稳定,应答后首发新病灶。这些较新型治疗反应模式使得传统标准,如WHO和RECIST在检测肿瘤负荷变化方面并不是很理想。因此,许多试验正在验证较新型影像学反应标准,如实体瘤免疫相关疗效评价标准(irRECIST)和免疫相关反应标准(irRC),以有效监测患者的免疫治疗疗效。
过去的三十年中,诊断性影像学反应评估已经发生了很大的变化。WHO标准引入了基于肿瘤径线乘积(SPD,即:肿瘤最大长径乘以与之垂直的最长径)评估肿瘤负荷以及通过治疗过程中从基线开始的变化来决定治疗效果的概念。
然而,WHO标准却为常规应用带来了挑战,如评估肿瘤负荷时缺乏有关需测病灶的最小尺寸以及总病灶数量的定义。
为克服这些局限性,美国癌症研究所,欧洲癌症研究与治疗组织(EORTC)和WHO于2000年提出了实体瘤疗效评价标准(RECIST)。
RECIST弥补了WHO标准的缺陷,并制定了肿瘤反应评估具体指南,同时也简化了肿瘤测量。
基于约6500名患者的数据库统计学分析(包括新病灶,淋巴结,骨病变和囊性及坏死病变的更新评估),2009年制定了修订版RECIST,即RECIST 1.1。这些标准将治疗成功定义为肿瘤负荷减轻,且无任何新病灶,治疗失败定义为早期肿瘤生长和新病灶出现。
然而,尽管RECIST在评估各种实体瘤反应反面取得了巨大成功,它的主要缺点在于其主要用于评估细胞毒性治疗后肿瘤缩小疗效的评估,而对于测量除萎缩外的抗肿瘤活性并非最佳标准。
此外,监测肿瘤负荷变化的一维方法未考虑诸如肿瘤增强等其他参数,这样就需要不断修订RECIST。
较新型治疗--肿瘤免疫治疗
近年来,随着靶向治疗制剂越来越多地应用于肿瘤治疗,肿瘤药物研发发生了范式转变。靶向治疗包括许多类药物,如血管生成抑制剂,免疫调节剂,信号转导抑制剂,DNA损伤调节剂以及激素药物。
许多靶向治疗通过增强抗肿瘤免疫反应,诱导细胞抑制效应,并且不似常规化疗制剂样杀伤细胞。免疫调节剂或免疫检查点抑制剂通过抑制免疫系统中的调节步骤起作用,从而促进T细胞增殖和活化,以诱导肿瘤浸润和消退。
随着美国国立卫生研究院ClinicalTrials.gov注册表上列出的几种药物以及近1,500项肿瘤免疫治疗试验的获批,肿瘤免疫治疗领域迅速扩大。目前,三种主要药物,即CTLA-4抗体(Ipilimumab,Tremelimumab),PD-1抗体和PD-1/PD-L2抗体(Nivolumab,Pembrolizumab,Atezolizumab)正处于研究中,并且已经获美国FDA批准。
CTLA-4在T细胞表面完全表达,其主要通过抵消T细胞共刺激受体CD28的活性来调节T细胞早期活化的幅度。CD28和CTLA-4共享相同的配体:CD80和CD86。T细胞表面上的CTLA-4表达不仅积极地向T细胞分配抑制信号,还通过与CD28竞争,与CD80和CD86结合,以减少T细胞活化。
PD-1是一种跨膜抑制蛋白,表达于T细胞,B细胞和NK细胞。与CTLA-4相反,炎症反应时,PD-1限制自身免疫和外周免疫组织中的T细胞活化。PD-1抑制剂增强了组织和肿瘤微环境中的效应T细胞活性。
由于既往试验证明,免疫检查点抑制剂具有协同作用,因此多项临床试验正在研究免疫调节剂组合方案。晚期黑色素瘤随机对照试验表明,单用ipilimumab或将ipilimumab作为辅剂治疗高危黑色素瘤时,总生存改善。
另外,Wolchok及其同事发现,同时使用nivolumab和ipilimumab治疗晚期黑色素瘤患者后,大量患者具有可行的安全性和临床活性。免疫治疗制剂也可用于其他恶性肿瘤的治疗,如NSCLC。
免疫相关标准
新兴靶向免疫治疗的应用导致出现了新的治疗反应模式,传统反应评估标准,如RECIST可能不足以监测这些治疗的反应。RECIST依赖于细胞毒性治疗后肿瘤缩小,从而评估反应,而免疫治疗制剂成功治疗反应的表现具有多样性。
相较于细胞毒性治疗,免疫治疗反应相关肿瘤负荷主要差异之一为适宜反应滞后时间较长,将持久稳定疾病(SD)视为抗肿瘤活性的代表。免疫治疗相关的另一个非常规反应是初始治疗阶段,预先存在的病灶扩大以及新病灶发展,按照传统标准,该疾病将分类为进行性疾病(PD)。
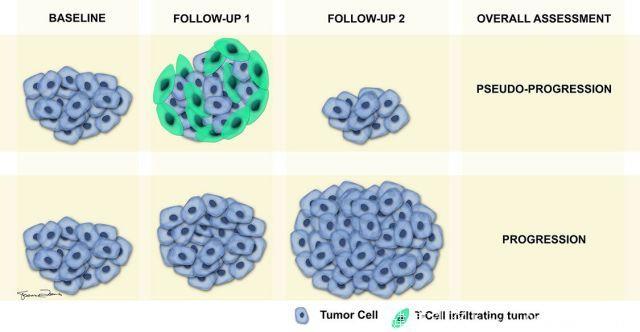
然而,免疫治疗制剂治疗的患者中,初始扩大以及新病灶发展后随访可见治疗反应(稳定或肿瘤负荷改善)。
免疫治疗初始阶段,肿瘤负荷增大或新病灶发展的原因可能是短暂爆发,并且在组织学基础上解释为肿瘤生长直至出现足够免疫反应或瞬时免疫细胞浸润。新病灶出现归因于T细胞浸润入肿瘤沉积物中。这类反应不应归类于进展,而是假性进展。假性进展患者通常无症状,而真进展患者会表现出临床恶化症状。4-6周短期随访通常可证实真性与假性进展。

为解释这些免疫治疗制剂的差异,肿瘤学家,免疫治疗专家和监管专家组成了多学科小组,讨论并制定了“免疫相关反应标准(irRC)”。
免疫相关标准与传统标准之间的主要区别性特征是:
a)由于免疫治疗反应可能延迟,因此应进行连续两次(时间间隔至少4周)进行疾病进展或肿瘤治疗反应的影像学评估;
b)新病灶出现并不一定表示免疫治疗患者进展。为评估肿瘤负荷深层次变化,应至少在4周后进行随访影像学检查以评估新病灶;
c)符合肿瘤大小标准的新病灶被评估为“新的可测量病灶”并纳入“总肿瘤负荷”。免疫反应标准类似于确定基线时总肿瘤负荷的传统标准,包括筛选可测量(靶标/指标)或不可测量(非靶标/非指标)病灶。

最新irRC和irRECIST研究和验证
自创始至今,免疫相关反应标准已经用于多项临床试验,然而,仍需要有力的证据证实其优于传统标准的优势。自初次引入后,免疫标准经过多次修订(irRC, irRECIST, iRECIST),但基本概念并没有大的改变。
irRC概念已被纳入美国FDA和欧洲药品管理局(EMA)的监管指导文件,其应用范围扩展到黑色素瘤以外的几种癌症,包括肺癌,肾癌和淋巴瘤。这些标准是药物研发早期阶段的主要支柱,但尚未被施用于监管机构(例如FDA)进行上市批准所必需的III期试验。
一项多中心II期试验研究了预先治疗的晚期黑色素瘤患者应用ipilimumab单药治疗的安全性和疗效,主要终点为最佳总反应率,相对于WHO标准(27%),irRC标准下的疾病控制率为35%。
一项纳入pembrolizumab治疗的ipilimumab难治性和ipilimumab初治黑素瘤患者的随机试验中,相较于RECIST 1.1,应用irRC出现更高的24周无进展生存期(PFS)。Hodi等人完成的KEYNOTE-001Ib期研究纳入了655名患者,327名进行了≥28周成像随访,其中7%的患者出现非典型反应。根据生存分析,修改后的标准可能防止治疗过早停止,因为传统RECIST可能低估了约15%的患者pembrolizumab获益。
免疫反应标准具有潜在的优势,然而在实践中,RECIST是一种高度验证和可重复的工具,大多数试验仍运用RECIST 1.1评估治疗反应。研究人员需要更灵活地运用他们的判断力,通过修订RECIST标准,超越传统“进展”的定义继续进行治疗。
RECIST确定疾病进展的患者中,4-6周重复扫描前临床稳定的患者继续治疗。重复扫描证实进展的患者终止治疗。某些免疫治疗试验中,尽管重复影像学检查证实进展,但只要获得临床意义的获益,研究人员和医学监测人员就可以继续进行治疗。
免疫相关不良事件
免疫系统增强以对抗癌症时,也可能发生预期之外的自发免疫并发症。临床出现症状和无症状患者均可见免疫相关不良事件的影像学表现。
这些不良事件包括结肠炎(弥漫性结肠炎和伴有憩室病的节段性结肠炎),内分泌异常,如垂体炎和甲状腺疾病,肝炎,胰腺炎,肺炎,皮炎和肉瘤样反应等。
不良事件可发生于治疗的任何阶段。以下时间段内,不良事件中位发病通常随之而来:因器官系统受“3周时皮肤相关事件,3-9时肝炎,8周时胃肠表现以及7-20周时内分泌失调”影响而异。几乎所有免疫相关不良事件均可通过停止免疫治疗,并施用类固醇治疗。
功能性标准
监测新疗法反应的新兴领域包括功能成像领域,如灌注成像(CT/MR/US),18氟-氟代脱氧葡萄糖PET成像和扩散加权成像(DWI)。
目前尚无公认的用于免疫肿瘤药物治疗患者的功能性反应标准。结合PET功能性信息和CT解剖学信息的PET-CT成像可用于分期和治疗后随访多种恶性肿瘤,如黑色素瘤和肺癌。
免疫-PET研究探究了非FDG放射性示踪剂的可能性--使用可以评估CTLA-4,PD-1,PDL1细胞表达状态的标记单克隆抗体。这些非侵入性免疫诊断方法可以提供免疫肿瘤药物病理生理学新见解,但仍需进一步研究。
放射组学是一个新兴领域,涉及不同的预测建模技术和特征筛选,目前正在研究放射组学以确定预后分析的最佳配置。放射组学模型在预测各种癌症(包括早期和晚期肺癌和头颈癌患者)生存期和其它临床结局中发挥互补作用。
总结
免疫治疗制剂是当前正在测试和批准用于治疗各种恶性肿瘤(包括实体瘤,淋巴瘤和白血病)的抗癌药物新模型。它们的治疗反应模式和治疗相关并发症不同于传统化疗方案。
尽管接受免疫治疗的患者应用了标准化的反应评估标准,但是仍需要了解免疫治疗患者的治疗反应差异并应用最新免疫相关反应标准。
同样,认识并及早诊断免疫相关不良事件对于成功治疗并发症至关重要,适宜情况下,患者可继续参与试验,从而持续获得生存获益。
文章编译自:Bhanusupriya Somarouthu, MD,Susanna I Lee, MD, PhD,Trinity Urban,MA,Gordon J Harris,PhD,Cheryl A Sadow,MD, Avinash Kambadakone-Ramesh,MD, FRCR. Immune-related Tumor Response Assessment Criteria: A Comprehensive Review.British Institute of Radiology 2018.
盘点丨尿路上皮癌和肾癌免疫治疗生物标志物