被忽视的自身免疫疾病!
银屑病
慢性斑块型银屑病(寻常型银屑病)是银屑病最常见的一种形式,常见于全身任何部位的红斑斑块。症状包括瘙痒、出血和疼痛;此外,这种疾病还可能影响仪容并产生心理压力。皮肤病变的特征是角化不全和角质形成细胞的棘细胞层增厚(银屑病样增生),多形核白细胞和淋巴细胞浸润真皮(CD8+)和表皮(CD4+)。银屑病性关节炎(PsA)和克罗恩病(CD)在银屑病患者中常同时存在,用于测量疾病活动性的最广泛使用的工具是银屑病面积和严重程度指数(PASI),它将严重程度和受影响面积的评估合并为一个从0(无疾病)到72(最大程度)的分数。
银屑病的病理生理学是非常复杂的,在某种程度上取决于宿主的遗传基因。链球菌感染和银屑病之间有很强的联系,HLA-C:06是一个特征明确的遗传危险因素,它可能导致自身反应性CD8+T细胞,因为它倾向于呈现与表皮角蛋白具有广泛序列同源性的链球菌蛋白片段。其它的基因位点,包括IL-23和NF-κB信号系统的组成部分,占到遗传因素的约28%。
多种T细胞靶向治疗的临床疗效支持了T细胞的致病作用,即abatacept、alefacept和efalizumab。此外,FDA批准TNF-α抑制剂用于治疗银屑病。Th17细胞的发现以及随后发现产生IL-17的CD4+、CD8+、ILC和γδT细胞在银屑病皮损中显著存在,最近人们将研究热点集中在IL-23/17轴。
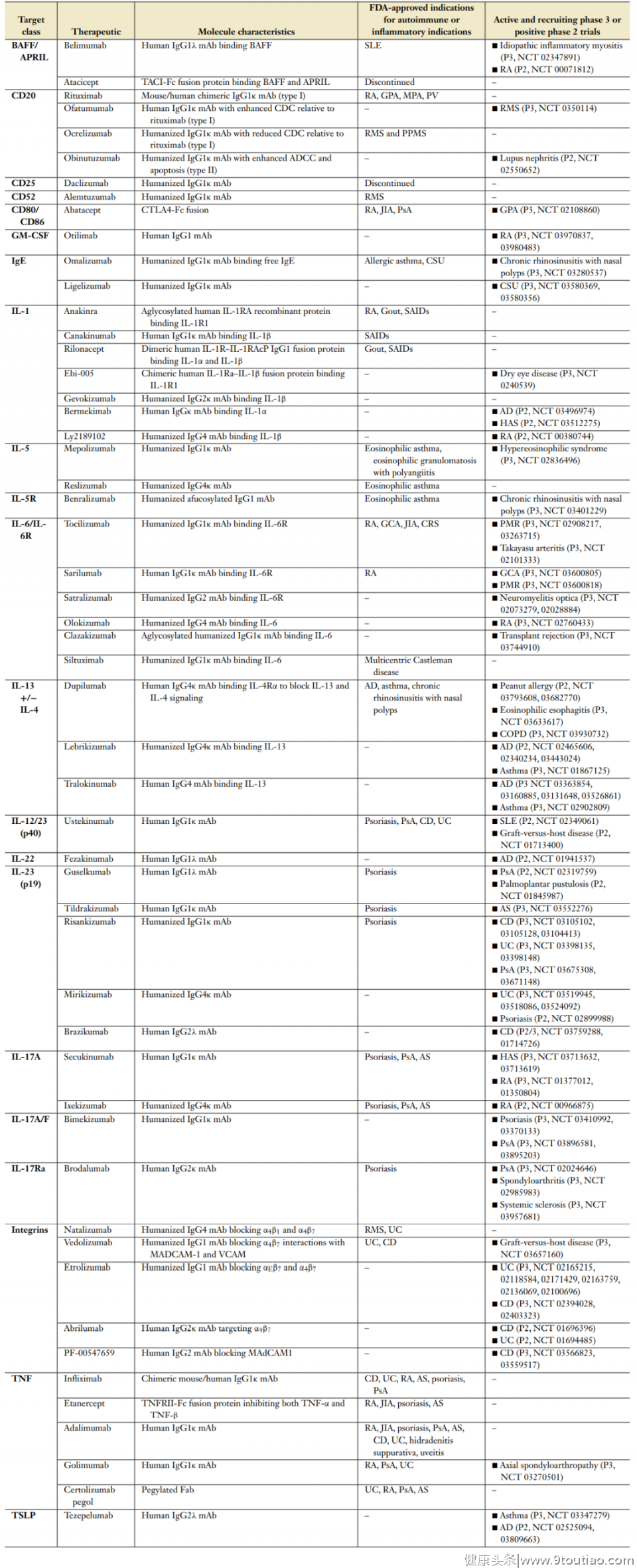
在使用抗IL-12/23药物的两项关键临床试验中,ustekinumab在治疗12周后的PASI75得分占比为66.4–75.7%。通过头对头试验进行的直接比较显示,ustekinumab优于TNF拮抗剂依那西普(56.8% 达到PASI 75)。同样,briakinumab的疗效和优越性也优于依那西普。虽然在IL-12途径中有遗传缺陷的儿童会经历分枝杆菌感染,但在对5884名接受ustekinumab治疗的患者进行的综合分析中,没有观察到重大感染。由于briakinumab已退出临床研究,对其安全性知之甚少。此外,用risankizumab、guselkumab和tildrakizumab阻断IL-23对银屑病患者的TNF抑制也有临床益处和优势。
IL-23下游的主要效应细胞因子包括IL-17、IL-22和GM-CSF。银屑病患者血清IL-17和IL-22水平均升高,依那西普治疗可降低这两种细胞因子。然而,只有IL-17水平与PASI评分相关。Namilumab是一种GM-CSF抗体,对银屑病没有临床疗效。两种IL-17A选择性抗体,secukinumab和ixekizumab,与抗IL-23单抗的疗效相似,优于ustekinumab和依那西普。Brodalumab和bimekizumab分别靶向IL-17RA和IL-17A/F,也证明了其临床疗效。
最近,guselkumab与secukinumab的头对头研究表明,IL-17的抑制可能不如IL-23的阻断有效。迄今为止,IL-17阻断剂在银屑病中显示出良好的安全性,尽管观察到念珠菌感染的频率有小幅增加(1.7–4.0%)。
炎症性肠病
克罗恩病和溃疡性结肠炎 (UC )是IBD的两种主要形式。这种疾病是由于遗传易感宿主对肠道微生物的炎症反应失调引起的,这些宿主的粘膜屏障功能、自噬途径和Th17生物学功能受损。这两种疾病在解剖位置、组织学、危险因素和合并症方面有所不同。到目前为止,FDA批准的有效疗法包括TNF-α拮抗剂、vedolizumab和natalizumab以及JAK抑制剂tofacitinib被批准用于UC。
Ustekinumab被FDA批准用于治疗CD和UC。IL-23靶向药物brazikumab和risankizumab的疗效也已在2期临床试验中报道。尽管IL-12/23和IL-17靶向单抗在银屑病中表现出一致的疗效,但在CD中却表现不一。secukinumab和brodalumab均未在CD中提供益处。Brodalumab甚至导致CD恶化,secukinumab也表现出类似的趋势,尽管这项研究没有发现统计学上显著的恶化。缺乏疗效或CD恶化可能是由于IL-17在维持肠上皮紧密连接中的稳态作用。虽然IL-17靶向治疗不会引起银屑病或脊柱关节病患者的IBD,但在使用不同IL-17阻断剂的多个非IBD试验中观察到少量新发的IBD病例。
多发性硬化症
多发性硬化症(MS)是一种慢性自身免疫性疾病,由免疫细胞浸润穿过受损的血脑屏障引起,促进中枢神经系统炎症、胶质增生、轴突脱髓鞘和少突神经细胞丢失。大约85%的患者有复发性多发性硬化症(RMS),随着时间的推移身体和认知功能都会丧失。其余15%的患者患有原发性进行性多发性硬化症(PPMS),神经功能持续恶化。临床症状由炎症和神经退行性变过程的解剖位置决定。炎性病变包括适应性和固有免疫细胞,包括中枢神经系统驻留的小胶质细胞。
MS中免疫的重要性是由HLA-DRB1位点和其他免疫相关基因位点(如IL-2和CD25)的强烈遗传关联支持的。RMS的治疗主要集中在免疫调节上,与MHC II类分子与疾病风险相关的遗传学研究一致,T细胞靶向疗法已显示出临床益处。类似地,ocrelizumab的益处可能是由于B细胞作为APCs的贡献,提供共刺激信号和分泌促炎细胞因子。
迄今为止测试的所有免疫调节疗法均未能为PPMS提供临床益处,但ocrelizumab除外。PPMS中的神经退行性变成分似乎比免疫成分更占优势,因为接受ocrelizumab治疗的患者虽然残疾减少,但仍出现显著恶化。未来的药物发现集中在神经元再生、再髓鞘化和增强调节性免疫细胞上可能会带来额外的临床益处。
另外两个观点来自于不同免疫调节疗法的成功和失败。
IL-12/23和IL-17靶向治疗之间的不一致。虽然IL-23是Th17细胞发育所必需的,但抗IL-12/23和抗IL-17a治疗的疗效并不一致。在RMS的2期试验中,secukinumab减少了钆(Gd)增强MRI脑损伤的数量。相比之下,ustekinumab对Gd增强病变没有改善。使用实验性自身免疫性脑炎(EAE)作为MS模型的临床前研究表明,IL-23对于疾病的发生很重要,但一旦启动,IL-23对于EAE的效应疾病阶段是不必要的。B细胞调节。尽管抗CD20单抗治疗对RMS有效,但atacicept(TACI-Fc)阻断BAFF和APRIL的治疗增加了临床复发率。atacicept观察到的有害影响可能是由于BAFF/APRIL在维持免疫抑制的产生IL-10的B细胞中的作用。2型免疫性疾病
2型免疫进化为去除宿主细胞外寄生虫,并由基于Th2细胞的细胞因子(IL-4、IL-5、IL-9和IL-13)调控。过去十年的研究表明,2型细胞因子,特别是IL-5和IL-13,也由第2组ILC(ILC2s)、肥大细胞、嗜碱性粒细胞、嗜酸性粒细胞、CD8+T细胞和自然杀伤T细胞产生。这些细胞因子促进嗜酸性粒细胞分化和存活(IL-5);嗜酸性粒细胞组织归巢(IL-13);B细胞类转换为IgE产生(IL-4和IL-13);杯状细胞分化和粘液产生(IL-13);平滑肌增生和收缩(IL-13);肥大细胞分化、活化(IL-9)和脱颗粒(通过IgE抗原复合物交联FcεRI)。
哮喘
哮喘是一种常见的呼吸系统疾病,其特点是可逆性、发作性气道阻塞和高反应性。症状包括呼气喘息、咳嗽、夜间醒来和运动能力下降。在一些哮喘患者中,可能出现以症状恶化和肺功能急剧下降为特征的急性发作。哮喘通常发生在儿童时期,特别是两年前经历下呼吸道病毒感染的特应性疾病儿童。然而,它也可能在以后的生活中发展,往往没有过敏性炎症的证据。诱因包括室内和室外空气过敏原、香烟烟雾、臭氧等污染物以及病毒、细菌和真菌等传染源。
在大多数病人中,用短效或长效β肾上腺素能激动剂(SABA或LABA)缓解喘息和气道阻塞症状,并用吸入性皮质类固醇(ICS)和/或口服白三烯受体拮抗剂作为适当的乳酸抗炎策略来防止症状的发作性恶化,可充分控制哮喘。高达10%的患者尽管接受了大剂量的LABA/ICS治疗,但哮喘控制不佳,需要频繁的全身皮质类固醇,症状负担重,病情频繁恶化。严重哮喘患者的这一亚群代表了大量未满足的医疗需求,并且已经成为针对炎症介质的新生物疗法的焦点。
IgE靶向治疗
Omalizumab与血清IgE的Fc区结合,并将自由循环IgE降低95%。由于IgE在嗜碱性粒细胞和肥大细胞上占据FcεRI是维持其质膜表达所必需的,因此在omalizumab治疗后,表面FcεRI表达减少了∼90%。在一项针对轻度过敏性哮喘受试者的支气管过敏原激发研究中,omalizumab降低了早期和晚期过敏原反应。
在关键的临床试验中,接受omalizumab治疗的患者比接受安慰剂治疗的患者哮喘恶化明显减少,但omalizumab治疗并不能预防所有的哮喘恶化。在儿童哮喘患者中,omalizumab在预防季节性急性发作率方面最为有效,与安慰剂相比,在春季和秋季观察到的降低幅度最大。2型生物标志物(包括血嗜酸性粒细胞、FeNO或血清骨膜素)水平升高的患者在缓解病情方面最有益处。此外,omalizumab在包括肺功能和症状在内的其他结果指标上也提供了适度的益处。
当B细胞在分化为分泌IgE的浆细胞之前表达跨膜IgE时,quilizumab,一种针对跨膜IgE的独特表位的无糖基化抗体(增强FcγR介导的耗竭)被测试以确定是否可以耗竭IgE转换的B细胞前体,从而可以消除这种抗体过敏性B细胞。
在支气管变应原激发研究中,quilizumab治疗减弱了早期和晚期变应原反应以及新合成的变应原特异性IgE的诱导,但在中重度哮喘患者的大型研究中,quilizumab治疗并不能防止病情恶化。在此项研究中,quilizumab在9个月的时间内仅将血清IgE水平降低了约25%,这表明产生IgE的浆细胞的半衰期明显更长,很可能在数年的时间尺度上。
IL-5靶向治疗
三种针对IL-5的单克隆抗体疗法已被批准用于治疗哮喘:mepolizumab和reslizumab抑制IL-5与其受体的结合,而benralizumab,一种针对IL-5Rα的无糖基化抗体,额外消耗IL-5Rα表达细胞,包括嗜酸性粒细胞和嗜碱性粒细胞。
在有气道、血液和痰嗜酸性粒细胞增多和频繁加重病史的严重哮喘患者中使用mepolizumab的研究表明,IL-5抑制可导致循环嗜酸性粒细胞、哮喘加重和口服类固醇的大量减少。然而,在肺功能和慢性症状负担方面只有轻微的改善。此外,抗IL-5治疗对循环IgE水平或FeNO的影响很小,reslizumab和benralizumab的研究随后证明了类似的结果。这些研究揭示了IL-5在驱动嗜酸性粒细胞炎症中的中心作用,并进一步揭示了嗜酸性粒细胞气道炎症在导致2型高哮喘患者的某些(但不是所有)哮喘恶化中的作用。
作为一个有趣的小插曲,一项对轻度过敏性哮喘患者使用mepolizumab的早期研究未能证明对早期或晚期过敏原反应有任何影响,表明嗜酸性粒细胞不是过敏原反应的重要组成部分。因此,抗IL-5治疗在关键结果试验中降低自发性恶化率的益处,使人质疑支气管变应原挑战性研究设计在更真实的环境中的可转换性,并建议临床终点必须与干预所针对的疾病生物学相匹配。
IL-13/IL-4靶向治疗
一些针对IL-4/13通路的抗体,包括lebrikizumab、tralokinumab和dupilumab已经通过关键性临床试验并取得进展。单独以IL-4为靶点的药物(pascolizumab,altrakincept)未能显示出益处,表明IL-13是哮喘中两种药物的关键效应细胞因子。
Lebrikizumab在一项小型支气管过敏原激发研究中证明对轻度2型-高度哮喘患者有益,减少了晚期过敏原反应,但没有减少早期过敏原反应。这一结果暗示IL-13参与了继发于IgE过敏原复合物介导的肥大细胞脱颗粒的炎症细胞的募集。因此,抗IL-13与抗IL-5不同,后者对支气管过敏原反应无影响,而抗IgE可阻止早期和晚期反应。
尽管dupilumab、lebrikizumab和tralokinumab在2期试验中均显示出疗效,但dupilumab在关键的一项3期试验中表现更为优越。在重复的3期试验中,尽管lebrikizumab和tralokinumab都实现了适度的恶化率降低,并且lebrikizumab显著改善了肺功能,但两种药物均未达到其预先指定的恶化率降低的主要终点。相比之下,dupilumab在2型高哮喘患者中取得了显著的肺功能改善和恶化减轻。与IgE和IL-5靶向治疗一致,lebrikizumab研究的事后分析表明,它可以预防2型高风险患者的季节性加重率峰值。
IL-13靶向治疗的不同临床结果说明了解释临床试验结果的困难,有几种可能的解释来解释不一致的试验结果:
目标选择:Dupilumab抑制IL-4和IL-13信号传导,尽管选择性靶向IL-4没有明显的治疗益处,但IL-13被中和后IL-4变得重要的可能性仍然存在。FeNO、IgE和血嗜酸性粒细胞的药效学生物标志物效应主要反映IL-13生物学特性,因此在不同药物之间是一致的。没有对IL-4选择性生物标志物的评估或明确证据。
分子特性:虽然可能存在细微的分子差异,但Dupilumab仍然占据着受体。相比之下,IL-13靶向抗体可能更依赖于亲和力和中和所有微环境中配体的能力以及相对于其受体的空间配置。
研究患者群体:由于lebrikizumab试验不需要近期恶化作为入选标准,安慰剂组恶化率较低(每年少于一名患者)。安慰剂组中超过60%的患者没有恶化,这使得他们在主要结果测量方面缺乏信息。与此相反,Dupilumab研究需要上一年的恶化史,这导致试验中更高的恶化率,从而有更大的窗口来证明统计学上的显著降低。
生物标志物:关键的lebrikizumab研究预先指定了血清骨膜素和血嗜酸性粒细胞的复合物,将70%的患者分类为生物标记物阳性;其中一项重复研究符合该亚群的主要结果测量,具有统计学意义,而另一项没有。dupilumab研究将生物标志物分组作为次要结果指标,并显示主要在血液中嗜酸性粒细胞数>300/mm3的患者(约占45%的患者)中获益。因此,使用更严格的2型生物标志物可以为2型细胞因子的抑制剂带来更好的疗效。
总体而言,IgE、IL-5和IL-4/13的抑制剂对哮喘患者具有显著的作用,大约一半的严重哮喘恶化可以预防。然而,没有一种有效的2型细胞因子靶向治疗可以完全预防哮喘加重或消除日常症状,特别是在2型低哮喘患者。
哮喘中不依赖2型免疫的其它途径
虽然针对2型哮喘患者的生物治疗取得了巨大的成功,但尚未批准任何针对2型低哮喘患者亚组的治疗,人们逐渐将目光放在不依赖2型细胞因子的其它通路上。
靶向TSLP的单克隆抗体,目前正在第3阶段试验中进行研究。在一项2b期研究中,它降低了2型-低哮喘和2型高哮喘患者的加重率,其肺功能优势主要在2型高哮喘患者。此外,靶向TNF-α和IL-17的抑制剂的临床试验未能在哮喘患者中产生积极的结果,尽管这些研究没有根据这些途径的活性证据使用生物标记来选择患者,因此有可能错过了一小部分的可能益处。
哮喘以外的2型免疫疾病
哮喘中存在的疾病机制也在其他适应症中发挥着积极作用,因此,这些生物治疗方法为其他适应症提供了新的见解和治疗选择:
特应性皮炎(AD)是一种慢性炎症性皮肤病,其特征是上皮屏障功能紊乱、湿疹性病变和高水平的IL-13、IgE和嗜酸性细胞浸润。瘙痒划伤循环会加剧皮肤瘙痒,在这个周期中细菌性皮肤菌群被引入真皮,从而促进进一步的炎症。Dupilumab是第一个批准有效治疗AD的生物疗法,Lebrikizumab和tralokinumab也显示出治疗AD的活性。
慢性自发性荨麻疹(CSU)是一种皮肤病,其产生抗FcεRIα和IgE等自身抗体,肥大细胞脱颗粒频繁而引起麻疹。Omalizumab是第一个在CSU中使用抗组胺药物治疗症状外显示显著益处的治疗方法,表明IgE-FcεRI相互作用在CSU发病机制中的重要作用。
罕见的嗜酸性粒细胞病包括嗜酸性粒细胞增多综合征(HES),一种系统性疾病,其特征是循环嗜酸性粒细胞和组织浸润,包括皮肤、胃肠道和肺部,并伴有活化的嗜酸性粒细胞;嗜酸性肉芽肿伴多发性炎(EGPA,也称为Churg-Strauss综合征),一种自身免疫性疾病,伴有嗜酸性粒细胞介导的血管炎。Mepolizumab和其他IL-5抑制剂在HES中已证明有效,大多数患者减少嗜酸性粒细胞浸润和症状的一半以上;Mepolizumab已被批准用于EGPA患者的治疗。
慢性阻塞性肺疾病(COPD)的一部分患者存在2型特征和嗜酸性粒细胞水平升高,这是吸烟人群常见的气道疾病。但IL-5和IL-13靶向治疗均未证明在COPD中具有显著的疗效,即使在嗜酸性粒细胞升高的亚群中。这些阴性结果很可能反映出2型细胞因子对COPD发病机制的贡献相对不足。
类风湿性关节炎
类风湿性关节炎(RA)是一种主要影响关节的慢性自身免疫性炎症疾病,但也可能有全身性关节外表现。临床诊断标准包括受影响关节数、症状持续时间、类风湿因子(RF)或抗瓜氨酸肽抗体的存在以及急性期反应物、CRP或红细胞沉降率异常的证据。临床试验中治疗药物效益的标准衡量方法是使用美国风湿学会(ACR)标准、对生理状况的综合评估、急性期反应物的测量以及患者和医生评估。ACR20、50和70分别表示20%、50%和70%的改善。
目前,已有针对5个生物靶标的治疗方法获得FDA批准,用于治疗RA患者的不同亚群。但没有一类治疗方法能使安慰剂校正ACR50评分提高超过33%,这支持RA代表了一种异质性的临床综合征,存在多种免疫机制,而不同的免疫机制导致了一种常见的临床表现。
关于这一假说,1984年首次描述了三种滑膜病理类型:(a)大量的淋巴浸润与生发中心(GCs),(b)大量的淋巴浸润而无GCs,以及(c)纤维母细胞/滑膜增生,淋巴样细胞较少。最近,借助分子技术和免疫组化,根据组织学和基因特征,定义了三种滑膜病理类型:淋巴髓样、弥漫性髓样和pauci免疫。三种滑膜病理类型均见于疾病早期(平均持续时间不到6个月)和晚期(平均持续时间超过3年)。淋巴髓样病变类型的组织学定义是T细胞、B细胞、浆细胞和髓样细胞的存在,伴高淋巴基因表达。
在淋巴髓样病变类型中,GC样结构最常见。这些患者对tocilizumab或B细胞耗竭的反应更为明显。弥漫性髓样病变类型在组织学和分子特征上以髓系为主。这些患者对TNF-α靶向药物有优先反应。pauci免疫病理类型以成纤维细胞和罕见免疫细胞为特征。这种病理类型表现为较低的急性期反应物和血清学特征,并且倾向于侵犯较大的关节(例如膝盖),但仍有明显疾病活动的证据。这些病理类型强调RA患者的异质性,需要进一步确定各种滑膜病理类型的最佳治疗方法,以改善患者的反应。
参考文献:1.30 Years of Biotherapeutics Development-What Have We Learned? Annu Rev Immunol. 2020 Apr 26;38:249-287本文转载自其他网站,不代表健康界观点和立场。如有内容和图片的著作权异议,请及时联系我们(邮箱:[email protected])