继齐鲁、信达、三金后,华海贝伐珠单抗类似物获临床试验批件
今日(9月6日),华海药业发布通告称,其子公司上海华奥泰华药业股份有限公司,获得重组人源化抗血管内皮生长因子(VEGF)单克隆抗体注射液的临床试验批件。

据了解,重组人源化抗血管内皮生长因子(VEGF)单克隆抗体注射液是从美国Oncobiologics公司引进的贝伐珠单抗生物类似药产品,可以选择性地与人血管内皮生长因子(VEGF)结合并阻断其生物活性,该药物主要用于治疗转移性结直肠癌和晚期、转移性或复发性非小细胞肺癌。
贝伐珠单抗注射液由罗氏公司生产,是世界上首个抗肿瘤血管生成的药物。2010年,贝伐珠单抗注射液在中国上市,目前全球已有120多个国家和地区上市该药。据罗氏官网数据显示,2017年,贝伐珠单抗注射液全球销售额为67.3亿CHF(瑞士法郎),相当于474.34亿元人民币,在全球药品销售额排行榜位居第7位。
巨大的市场吸引了众多公司研发贝伐珠单抗生物类似药,2017年已有MVASI(AmgenInc.)获FDA批准在美国上市,于2018年再次在欧盟地区上市。而在中国,亦有多家药企竞相提交贝伐珠单抗生物类似药研发及上市申请。
据健识君整理发现,自2016年以来,江苏奥赛康、三生国健药业、上海复旦张江生物、齐鲁制药、信达生物、桂林三金等多家企业,已提交贝伐珠单抗的新药2类临床试验申请,并被CDE受理。
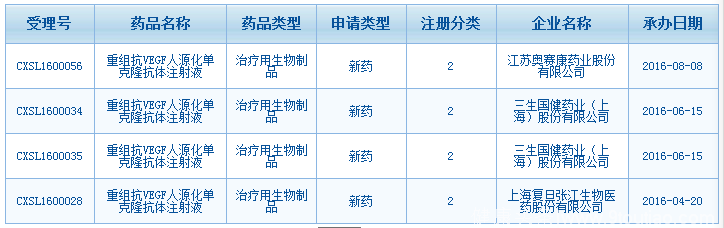

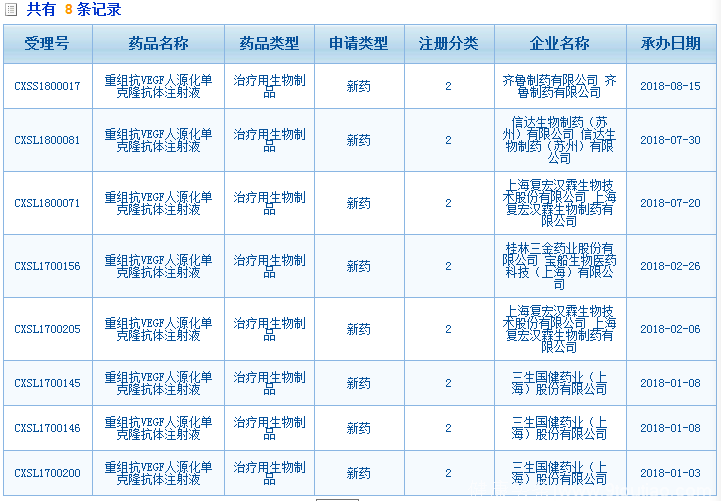
贝伐珠单抗生物类似药市场前景巨大,华海药业在齐鲁制药、信达生物、桂林三金等多家企业早先试水的情况下,想要想抢占市场先机,势必需要下足功夫。
华海药业主要从事多剂型制剂、生物药、创新药、特色原料药的研发、生产和销售。2018上半年,华海药业营业收入约25.39亿元,同比增长8.01%;净利润约2.29亿元,同比减少22.37%。华海药业近期因国外缬沙坦片杂质事件,正面临产品退货问题。在药物一致性评价方面,华海药业8种药物均通过审核,不知其研发、上市贝伐珠单抗生物类似药,能否得到该公司强有力的药研设备、技术支撑赶超其他企业。