专家视角 | 陈丽昆教授:双免疫、双获益:PD-1抑制剂与CTLA-4抑制剂的一线联姻
导读
免疫检查点治疗从2011年ipilimumab(CTLA-4抑制剂)获得批准用于恶性黑色素瘤,到2014年nivolumab以及pembrolizumab为代表的针对PD-1/PD-L1的抑制剂再次获得批准用于恶性黑色素瘤,进一步研究了免疫检查点治疗的疗效,同时也宣布了肿瘤的治疗进入免疫治疗的时代。由于免疫检查点治疗单药对一般人群的有效率仅20%,提示在疗效改善方面还有大量的工作要做。

随着双免疫阻断模式于2011年及2017年被FDA批准分别用于恶性黑色素瘤以及肾细胞癌,这也预示着双免疫阻断已经成为临床上改善免疫检查点治疗疗效的重要模式。
双免疫阻断模式的机制主要是在抗肿瘤免疫循环中PD-1/PD-L1、CTLA-4参与调节的第3、7步即启动、激活T细胞和杀灭肿瘤细胞(图1)。
在免疫调节的活化阶段,CTLA-4单抗可以阻断T细胞抑制信号,调节T细胞活化程度,促进T细胞进一步增殖,此环节主要发生于淋巴结,作用于免疫效应的早期。
PD-1抑制剂可阻断PD-1在T细胞与抗原递呈细胞相互作用阶段的抑制信号传导,促进活化T细胞的增殖。
在效应阶段,PD-1抑制剂也可阻断PD-1与肿瘤细胞PD-L1/PD-L2的结合,恢复细胞毒性T淋巴细胞(CTL)对肿瘤细胞的杀伤功能。由于CTLA-4与PD-L1分别作用于免疫调节的活化及效应阶段(图2),所以从在这两个步骤的关键点同时进行阻断,有可能带来意想不到的效果。
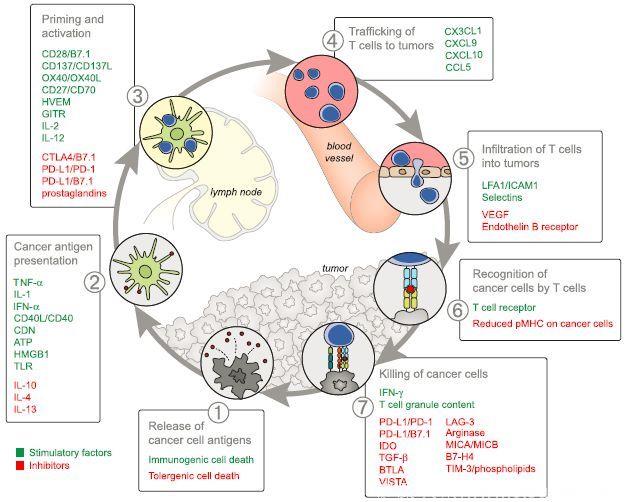
图1 肿瘤免疫循环
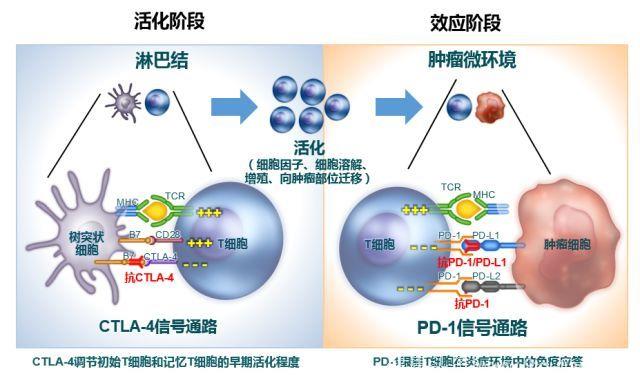
图2 CTLA-4抑制剂和PD-1/PD-L1抑制剂作用机制
继MYSTIC研究Durvalumab+Tremelimumab 在一线NSCLC中PFS获益阴性结论后,AACR会议上首次报道的双免疫联合CheckMate 227研究结果进一步表明,双免疫阻断能够使高TMB的NSCLC患者明显获益,PFS阳性获益。
CheckMate 227纳入既往未接受治疗的无驱动基因如EGFR,ALK等的晚期或者非小细胞肺癌患者,研究包含两个部分,其中Part 1 又由1a 和1b两部分组成。
根据PD-L1表达水平,患者随机进入两个亚组(part 1a 和 1b分别为PD-L1>1% 或 <1%)。在part 1中,在用PD-L1表达水平(part 1a)和不论PD-L1表达状态下(汇总part 1a和1b)高TMB(≥10 mut/Mb)患者,采用两个共同主要研究终点(OS与PFS)评估Nivolumab+Ipilimumab对比化疗是否改善疗效(图3)。Part 2 正在进行,用以评估全部人群中Nivolumab联合化疗对比化疗的疗效。
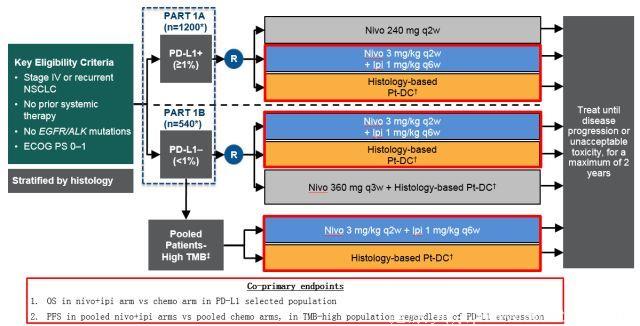
图3 CheckMate 227研究设计
CheckMate 227研究是第一个IO+IO双免疫疗法在NSCLC获得阳性结果的III期临床研究。目前报道的主要阳性结果数据为:高TMB患者的1年PFS率是化疗的3倍以上(图4,42.6% vs 13.2%);客观缓解率是化疗的近2倍(图5,45.3% vs 26.9%);免疫联合治疗组治疗响应的患者中,68%在1年时仍持续缓解(图6),缓解程度深且持久(图7);OS呈现获益趋势。免疫联合治疗组安全性较高(图8,3-4级治疗相关不良反应的发生率分别为31.2% vs 36.1%),双免疫阻断给药模式为:Nivolumab剂量3mg/kg Q2W , Ipilimumab剂量1mg/kg Q6W,该模式基于双免疫阻断在晚期非小细胞肺癌的I期临床研究(CheckMate-012)产生。
在CheckMate-012研究中,双免疫联合给药模式分两种:Nivolumab剂量3mg/kg Q2W 联合Ipilimumab 剂量1mg/kg Q6W或Ipilimumab 剂量1mg/kg Q12W。在具体毒副反应的比较上,Ipilimumab每12w给药同每6w给药相比,其3-4级治疗相关不良反应的发生率分别为37%与33%,肺炎的发生率分别为5%与3%,两组之间疗效并未见明显差异。在本研究中,Nivolumab联合Ipilimumab的3-4级治疗相关不良反应发生率为31.2%,主要是消化道反应,皮疹,腹泻等,大多可控,其中治疗相关肺炎发生率为4%。
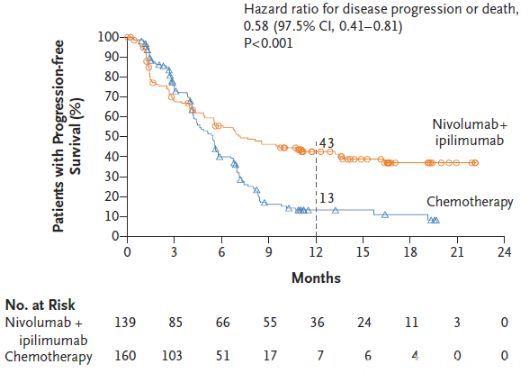
图4 高TMB患者的1年PFS率
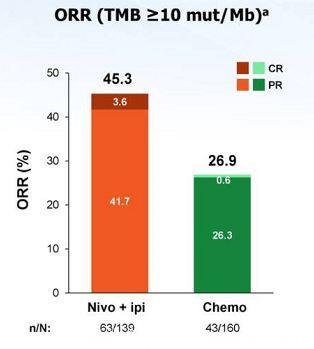
图5 高TMB患者ORR
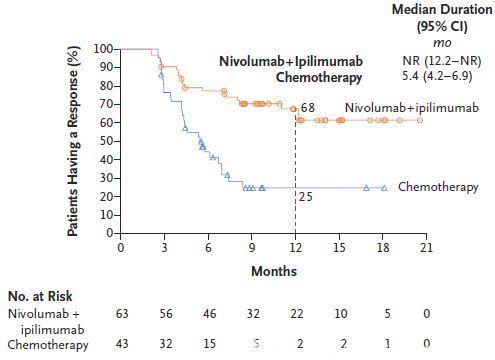
图6 高TMB患者的持续缓解时间
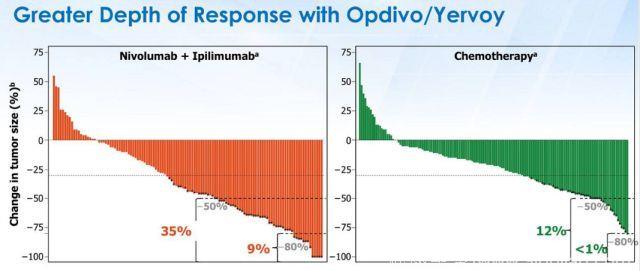
图7 nivolumab+ipilimumab缓解程度深且持久
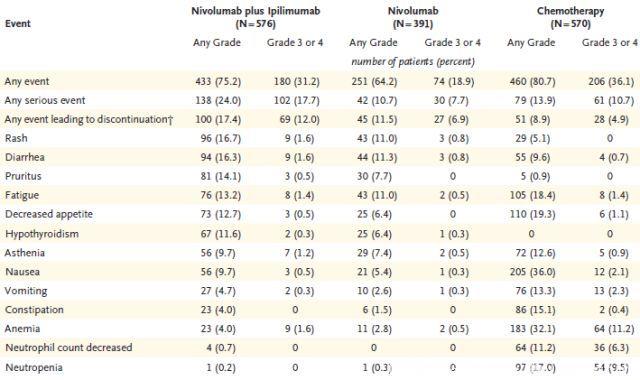
图8 各组不良反应发生率
本研究还发现,PD-L1的表达水平与TMB的状态无关。高TMB的患者,接受双免疫治疗的PFS、ORR以及DOR等研究指标均能显著改善。同时也为 TMB的检测作为独立指标预测双免疫阻断模式疗效提供了一定的依据。且TMB的检测还可以提供基因突变靶向用药的提示,使得免疫治疗逐渐向精准医疗迈进,为未来双免疫阻断作为晚期非小细胞肺癌的一线治疗提供了依据,预示着双免疫阻断模式有望在晚期肺癌的一线治疗中成为现实。由于双免疫阻断不涉及到化疗,未来晚期肺癌的治疗,尤其是无驱动基因突变的患者,双免疫治疗将是重要的选择。
目前双免疫阻断已经分别在恶性黑色素瘤与肾细胞癌中获得批准,在结直肠癌(CheckMate 142),软组织肉瘤(Alliance A091401)小细胞肺癌(CheckMate 032)等瘤种中的研究结果已经发表,目前在Clinictrials.gov注册的已经或者正在进行中的临床试验有:评估nivolumab单药治疗比较nivolumab联合ipilimumab对可切除的以及潜在可切除的肝细胞癌的疗效研究(NCT03222076),Durvalumab单用或者联合tremelimumab用于难治性精原细胞瘤的研究(NCT03081923),Durvalumab单用或者联合tremelimumab用于子宫内膜癌的研究(NCT03015129)等多项研究(表1),所有这些都显示出双免疫阻断在未来肿瘤治疗中的巨大潜力。
表1 Clinicaltrials.gov注册的或已进行的临床试验(双免疫联合)

由于免疫检查点抑制剂单药疗效有限,且缺乏可靠的预测疗效的标记物,所以不管是寻找有效的模式来进一步提升免疫检查点治疗的疗效,或者是筛查可靠的预测疗效的标记物都将是免疫检查点治疗在当前的首要任务。
除了客观的疗效以外,双免疫阻断在当前也存在一些问题。在标记物筛查方面,虽然PD-L1与TMB与免疫检查点治疗的疗效的关联被广泛报道,但是关于其检测方式,阈值,判读标准等问题目前国内外尚缺乏共识。
另外,在看到双免疫联合取得优势疗效的同时,我们同时也需关注这种联合模式的相关不良反应,在既往的研究中剂量高的亚组往往发生不良反应的比例较高。如何在疗效和安全性上达到平衡,还需在联合药物选择及剂量上继续探索。
最后,由于双免疫阻断从本质上是双药联合,所以双药联合的一些常见问题,比如用药顺序、用药时间等也是双免疫阻断需要解决的问题。
尽管存在诸多的问题,但是凭借着免疫检查点治疗自身持久的疗效以及双免疫模式在毒副反应可控的前提下所带来的显著改善,双免疫阻断除了目前已经获得批准用于恶性黑色素瘤以及肾细胞癌外,在未来有望拿下更多的适应症。
而在纵向层面,除了当前的双免疫阻断主要针对晚期肿瘤以外,在未来双免疫模式也有望用于恶性肿瘤的术后辅助治疗,双免疫阻断模式的应用范围将会进一步扩大。
与此同时,随着双免疫阻断模式的进一步优化以及免疫检查点抑制剂疗效标记物的明确,在减少毒副反应的同时,其疗效也将得到进一步提升,使更多的癌症患者可以从双免疫阻断治疗模式中获益。
参考文献:
1. D'Angelo SP, Larkin J, Sosman JA, et al. Efficacy and Safety of Nivolumab Alone or in Combination With Ipilimumab in Patients With Mucosal Melanoma: A Pooled Analysis. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 2017; 35(2): 226-35.
2. D'Angelo SP, Mahoney MR, Van Tine BA, et al. Nivolumab with or without ipilimumab treatment for metastatic sarcoma (Alliance A091401): two open-label, non-comparative, randomised, phase 2 trials. The Lancet Oncology 2018; 19(3): 416-26.
3. Hodi FS, Chesney J, Pavlick AC, et al. Combined nivolumab and ipilimumab versus ipilimumab alone in patients with advanced melanoma: 2-year overall survival outcomes in a multicentre, randomised, controlled, phase 2 trial. The Lancet Oncology 2016; 17(11): 1558-68.
4. Langer CJ, Gadgeel SM, Borghaei H, et al. Carboplatin and pemetrexed with or without pembrolizumab for advanced, non-squamous non-small-cell lung cancer: a randomised, phase 2 cohort of the open-label KEYNOTE-021 study. The Lancet Oncology 2016; 17(11): 1497-508.
5. Motzer RJ, Tannir NM, McDermott DF, et al. Nivolumab plus Ipilimumab versus Sunitinib in Advanced Renal-Cell Carcinoma. The New England journal of medicine 2018.
6. Overman MJ, Lonardi S, Wong KYM, et al. Durable Clinical Benefit With Nivolumab Plus Ipilimumab in DNA Mismatch Repair-Deficient/Microsatellite Instability-High Metastatic Colorectal Cancer. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 2018; 36(8): 773-9.
7. Hellmann MD, Ciuleanu TE, Pluzanski A, et al. Nivolumab plus Ipilimumab in Lung Cancer with a High Tumor Mutational Burden. The New England journal of medicine 2018.
8. Hellmann MD, Rizvi NA, Goldman JW, et al. Nivolumab plus ipilimumab as first-line treatment for advanced non-small-cell lung cancer (CheckMate 012): results of an open-label, phase 1, multicohort study. The Lancet Oncology 2017; 18(1): 31-41.
1. 2018 ASCO | 发布会推荐:曲妥珠单抗使用时间减半不影响生存
2. 10个要点读懂2018 CHEST肺癌筛查指南
3. 塞翁失马焉知非福 | TKI治疗出现甲减的患者总体生存率更高