【综述】儿童急性坏死性脑病的流行病学特点及预后研究进展
引用本文
作者单位:
单位:国家儿童医学中心首都医科大学附属北京儿童医院重症医学科 首都医科大学附属北京儿童医院北京市儿科研究所感染与病毒研究室中国医学科学院儿童危重感染诊治创新单元国家呼吸系统疾病临床医学研究中心儿科重大疾病研究教育部重点实验室儿童呼吸道感染性疾病研究北京重点实验室
通信作者:钱素云
Email:[email protected]
摘要
急性坏死性脑病(ANE)是一种全球分布的罕见并且独特的急性脑病。通常以病毒感染相关的高热症状起病,随后迅速恶化,出现抽搐、意识障碍,甚至昏迷。ANE的神经放射学特征是累及双侧丘脑等部位的多灶性、对称性脑部病变。目前尚无针对ANE的特异性治疗方法,预后较差,大多伴随着不同程度的神经系统后遗症,甚至死亡。本文总结了儿童中这种罕见但致命疾病的流行病学特点、诊断和预后的研究进展。
儿童急性坏死性脑病(acute necrotizing encephalopathy,ANE)常年可见,冬季高发,经常发生在病毒感染后,尤其以流感病毒感染最为多见。临床以发热后迅速出现抽搐、意识障碍为主要表现,可并发休克、多脏器功能障碍(multiple organ disorder syndrome,MODS)、弥散性血管内凝血(diffuse intravascular coagulation,DIC)等,具有起病急、进展快、病死率高的特点,近年已经成为儿童重症流行性感冒的主要死亡原因之一。
1流行病学特点
ANE最早于1995年由Mizuguchi等 [ 1] 提出,最初在日本和中国等东亚地区的儿童中发现 [ 2] ,随后西方国家也有报道,成人病例也有发生 [ 3] 。ANE全年均可发病,多见于冬季,发病高峰年龄为6~18个月婴幼儿,男女发病率无显著差异,亦无明显种族差异 [ 4-5] 。本病多继发于病毒感染,包括甲型/乙型流感病毒 [ 6] 、新型甲型流感病毒(H1N1) [ 7] 、副流感病毒、水痘-带状疱疹病毒 [ 8] 、人类疱疹病毒-6(HHV-6) [ 9] 、风疹病毒、麻疹病毒、博卡病毒 [ 10] 、肠道病毒、轮状病毒、登革热病毒 [ 11] 、柯萨奇病毒 [ 1] 和人细小病毒B19 [ 12] 等,其中最常见的是流感病毒和HHV-6。除上述病毒外,ANE还可能继发于肺炎支原体 [ 13] 感染以及白喉、破伤风类毒素和全细胞百日咳疫苗接种等 [ 14] 。前驱病毒感染在ANE的起病过程中起着重要作用,但多数学者认为ANE并不是病毒直接感染导致 [ 15] 。虽然有个别报道ANE患者脑脊液中检出某种病毒抗原,但通过尸体病理检查并没有发现颅内感染的线索,仅表现为脑实质炎性改变 [ 16] 。
2004年Togashi等 [ 17] 回顾性分析了1994至2002年期间诊断为流感相关性急性脑病的89名日本儿童,其中74.1%患儿头颅CT显示异常,典型改变为丘脑、脑桥和脑干的对称性密度减低,病死率37.1%。2012年Hoshino等 [ 8] 对日本国内急性脑病的流行病学进行了一次全国性调查,回顾了从2007至2010年报道的共983例急性脑病,其中ANE的发病率排第3位,病死率28.2%,41%的ANE继发于流感病毒感染。2019年李旭芳等 [ 18] 回顾性分析了广州市妇女儿童医疗中心7例甲型H1N1流行性感冒相关性脑病,其中ANE位居首位,占比高达42.9%。2019年刘珺等 [ 19] 回顾了2017年11月至2018年3月北京儿童医院PICU收治的52例流感危重症患儿,死亡19例,其中7例死于ANE,占死亡患儿的36.84%,从发病到死亡中位时间为3d,提示ANE也是儿童流感的主要死亡原因之一,且进展快,极为凶险。
ANE最早于1995年由Mizuguchi等 [ 1] 提出,最初在日本和中国等东亚地区的儿童中发现 [ 2] ,随后西方国家也有报道,成人病例也有发生 [ 3] 。ANE全年均可发病,多见于冬季,发病高峰年龄为6~18个月婴幼儿,男女发病率无显著差异,亦无明显种族差异 [ 4-5] 。本病多继发于病毒感染,包括甲型/乙型流感病毒 [ 6] 、新型甲型流感病毒(H1N1) [ 7] 、副流感病毒、水痘-带状疱疹病毒 [ 8] 、人类疱疹病毒-6(HHV-6) [ 9] 、风疹病毒、麻疹病毒、博卡病毒 [ 10] 、肠道病毒、轮状病毒、登革热病毒 [ 11] 、柯萨奇病毒 [ 1] 和人细小病毒B19 [ 12] 等,其中最常见的是流感病毒和HHV-6。除上述病毒外,ANE还可能继发于肺炎支原体 [ 13] 感染以及白喉、破伤风类毒素和全细胞百日咳疫苗接种等 [ 14] 。前驱病毒感染在ANE的起病过程中起着重要作用,但多数学者认为ANE并不是病毒直接感染导致 [ 15] 。虽然有个别报道ANE患者脑脊液中检出某种病毒抗原,但通过尸体病理检查并没有发现颅内感染的线索,仅表现为脑实质炎性改变 [ 16] 。
2004年Togashi等 [ 17] 回顾性分析了1994至2002年期间诊断为流感相关性急性脑病的89名日本儿童,其中74.1%患儿头颅CT显示异常,典型改变为丘脑、脑桥和脑干的对称性密度减低,病死率37.1%。2012年Hoshino等 [ 8] 对日本国内急性脑病的流行病学进行了一次全国性调查,回顾了从2007至2010年报道的共983例急性脑病,其中ANE的发病率排第3位,病死率28.2%,41%的ANE继发于流感病毒感染。2019年李旭芳等 [ 18] 回顾性分析了广州市妇女儿童医疗中心7例甲型H1N1流行性感冒相关性脑病,其中ANE位居首位,占比高达42.9%。2019年刘珺等 [ 19] 回顾了2017年11月至2018年3月北京儿童医院PICU收治的52例流感危重症患儿,死亡19例,其中7例死于ANE,占死亡患儿的36.84%,从发病到死亡中位时间为3d,提示ANE也是儿童流感的主要死亡原因之一,且进展快,极为凶险。
2诊断标准及变迁
ANE与一般的脑炎及脑病的症状相似,但病情更为凶险,存活者在临床过程中通常经历前驱期、急性脑病期和恢复期3个阶段 [ 16] 。不同病原体感染引起的前驱症状不尽相同,如咳嗽、咽痛等呼吸道感染症状;呕吐、腹泻、腹痛等消化道症状;感染相关性皮疹如麻疹、风疹和幼儿急疹等。ANE患儿在急性脑病期主要表现为发热后迅速出现脑功能障碍,如抽搐、意识障碍和局灶性神经功能障碍,并迅速进展至昏迷 [ 9] 。
由于病理诊断率和尸体解剖率低,ANE的诊断主要基于临床症状和典型的神经影像学表现,而ANE患儿的症状、体征及辅助检查结果缺乏特异性,因此只有在排除其他类似疾病之后才能明确诊断 [ 1-2] 。
1995年,Mizuguchi等 [ 1] 首次提出ANE的诊断标准,包括:(1)病毒感染相关性发热后出现抽搐、意识障碍等急性脑病症状;(2)脑脊液蛋白升高,无细胞数增多;(3)影像学提示多部位对称性病变,主要累及双侧丘脑、基底节区、脑室周围白质、内囊、脑干被盖等;(4)转氨酶不同程度升高,乳酸脱氢酶、肌酸激酶和尿素氮亦有增高,无高氨血症;(5)排除相似疾病。
1997年,Mizuguchi [ 2] 又补充了ANE的鉴别诊断:(1)基于临床症状的鉴别:严重的细菌和病毒感染、暴发性肝炎、脓毒性休克、溶血尿毒综合征和其他毒素介导性疾病;瑞氏综合征、失血性休克、脑病综合征和热射病。(2)基于影像学特点的鉴别:亚急性坏死性脑病(Leigh病)及相关线粒体细胞病变;戊二酸血症、甲基丙二酸血症和遗传性婴儿双侧纹状体坏死;韦尼克脑病和一氧化碳中毒;急性播散性脑脊髓炎、急性出血性白质脑炎、其他类型的脑炎和血管炎;动静脉炎,以及严重缺氧或头部创伤的后遗症。
2003年,Neilson等 [ 20] 首次报道了一个多代发病常染色体显性遗传的ANE家系,认为 RANBP 2基因突变为本病的致病原因,并于2009年 [ 21] 在ANE诊断标准的基础上,提出了家族性或复发性ANE的诊断标准,增加了以下3条:(1)家族中有相似的神经系统症状者;(2)复发性脑病伴发热者;(3)头颅MRI显示病灶也可累及下列部位:颞叶内侧病变、岛叶、屏状核、外囊、杏仁核、海马、乳状体、脊髓。
ANE与一般的脑炎及脑病的症状相似,但病情更为凶险,存活者在临床过程中通常经历前驱期、急性脑病期和恢复期3个阶段 [ 16] 。不同病原体感染引起的前驱症状不尽相同,如咳嗽、咽痛等呼吸道感染症状;呕吐、腹泻、腹痛等消化道症状;感染相关性皮疹如麻疹、风疹和幼儿急疹等。ANE患儿在急性脑病期主要表现为发热后迅速出现脑功能障碍,如抽搐、意识障碍和局灶性神经功能障碍,并迅速进展至昏迷 [ 9] 。
由于病理诊断率和尸体解剖率低,ANE的诊断主要基于临床症状和典型的神经影像学表现,而ANE患儿的症状、体征及辅助检查结果缺乏特异性,因此只有在排除其他类似疾病之后才能明确诊断 [ 1-2] 。
1995年,Mizuguchi等 [ 1] 首次提出ANE的诊断标准,包括:(1)病毒感染相关性发热后出现抽搐、意识障碍等急性脑病症状;(2)脑脊液蛋白升高,无细胞数增多;(3)影像学提示多部位对称性病变,主要累及双侧丘脑、基底节区、脑室周围白质、内囊、脑干被盖等;(4)转氨酶不同程度升高,乳酸脱氢酶、肌酸激酶和尿素氮亦有增高,无高氨血症;(5)排除相似疾病。
1997年,Mizuguchi [ 2] 又补充了ANE的鉴别诊断:(1)基于临床症状的鉴别:严重的细菌和病毒感染、暴发性肝炎、脓毒性休克、溶血尿毒综合征和其他毒素介导性疾病;瑞氏综合征、失血性休克、脑病综合征和热射病。(2)基于影像学特点的鉴别:亚急性坏死性脑病(Leigh病)及相关线粒体细胞病变;戊二酸血症、甲基丙二酸血症和遗传性婴儿双侧纹状体坏死;韦尼克脑病和一氧化碳中毒;急性播散性脑脊髓炎、急性出血性白质脑炎、其他类型的脑炎和血管炎;动静脉炎,以及严重缺氧或头部创伤的后遗症。
2003年,Neilson等 [ 20] 首次报道了一个多代发病常染色体显性遗传的ANE家系,认为 RANBP 2基因突变为本病的致病原因,并于2009年 [ 21] 在ANE诊断标准的基础上,提出了家族性或复发性ANE的诊断标准,增加了以下3条:(1)家族中有相似的神经系统症状者;(2)复发性脑病伴发热者;(3)头颅MRI显示病灶也可累及下列部位:颞叶内侧病变、岛叶、屏状核、外囊、杏仁核、海马、乳状体、脊髓。
3预后及预测因素
ANE的临床病程具有暴发性和多样性,预后从完全康复、轻度后遗症到重度后遗症甚至死亡不等。主要ANE患者预后相关报道归纳如下,见表1。
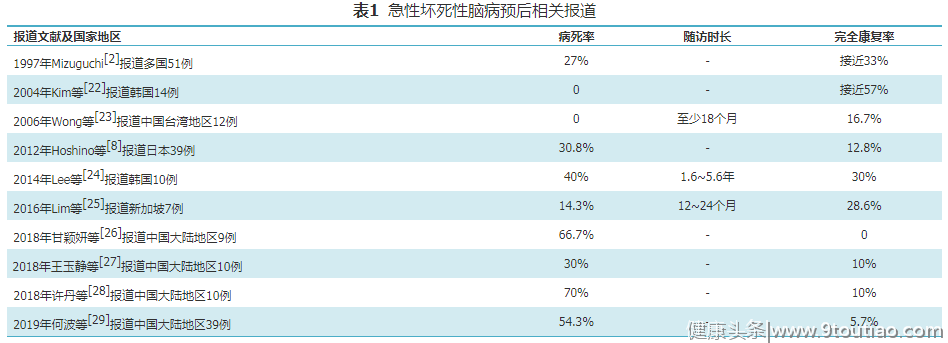
如表1所列,多数报道ANE病例数偏少,病死率多在30%~70%,完全康复的患儿10%左右,而幸存者多留有较严重的神经系统后遗症。然而,也有预后相对乐观的报道。2014年Lee等 [ 24] 回顾性研究韩国10例ANE,随访时长1.6~5.6年不等,30%患儿无神经系统后遗症。2016年Lim等 [ 25] 报道了新加坡为期8年的回顾性研究,纳入7例ANE,随访时长12~24个月,发现近30%患儿无神经系统后遗症。1997年Mizuguchi等 [ 2] 与2004年Kim等 [ 22] 报道的完全康复或轻度异常比例分别为33%、57%。上述报道的ANE患者远期完全康复比例偏高,原因可能是:(1)对轻症的认识增加;(2)早期诊断,及时恰当治疗。另外,这种差异可能与随访时间长短不同有关,推测ANE患儿可能随时间推移,神经系统后遗症将逐渐减轻甚至消失。
回顾近年的研究,有几个因素被认为与ANE的预后有关,如年龄小于2岁、血清谷草转氨酶显著升高、脑脊液蛋白显著升高以及脑干受累等预示预后不良[ 30 -32 ]。影像学特征与预后更具有相关性[ 23,33] 。
2006年,Wong等 [ 23] 通过回顾性分析12例ANE患者的磁共振(magnetic resonance,MR)特点和评估临床结局,再根据初期和后续MR显示出血、空洞形成和病变部位为每例患者计算MR评分,开发了MR评分系统,分值为0~4分[出血1分,脑干损害1分,白质(大脑和/或小脑)损害1分,空洞形成1分]。经Spearman等级相关检验后发现ANE患者的临床结局与MR影像评分之间存在显著正相关,由此提出MR评分系统可用于评估ANE患儿的预后,得分越高,预后越差。
2015年,Yamamato等 [ 33] 通过总结2009年以前报道的41例ANE患者与神经系统后遗症相关的临床因素,得出了可能影响预后的多个因素,开发了ANE严重程度量表(ANE-SS),并给出严重程度评分(年龄大于2岁,2分;发病时存在休克,3分;脑干损伤,2分;血小板计数<100×10 9 /L,1分;脑脊液蛋白>60 mg/dL,1分),其中0~1分为低风险、2~4分为中风险、5~9分为高风险,得分越高提示预后越差。然后,又将这个评分表应用于2011年报道的32例ANE患者的预后评估,最后提出ANE-SS可用于评估ANE患儿的预后。
2016年,Lim等 [ 25] 将ANE-SS评分系统用于评估患儿预后,得出后遗症高风险患儿出院时均存在严重损害,1例死亡患儿是该组ANE-SS得分最高者(7分),支持了Yamamato等 [ 33] 的发现,并指出伴有脑干损伤者80%会留有较严重的神经系统后遗症,而不伴脑干损伤者没有或仅有较轻的神经系统后遗症。
另外,还有报道称一些功能影像技术也可能是预后的预测因子。如表观弥散系数图(apparent diffusion coefficient)上呈现的丘脑病变中水弥散受限以及磁共振波谱成像(magnetic resonance spectroscopy)上表现的谷氨酸/谷氨酰胺复合物和脂质活动受限的患者通常会出现严重的后遗症或高病死率 [ 14] 。然而,以上功能影像技术在实际临床工作中应用相对较少。
2006年,Wong等 [ 23] 通过回顾性分析12例ANE患者的磁共振(magnetic resonance,MR)特点和评估临床结局,再根据初期和后续MR显示出血、空洞形成和病变部位为每例患者计算MR评分,开发了MR评分系统,分值为0~4分[出血1分,脑干损害1分,白质(大脑和/或小脑)损害1分,空洞形成1分]。经Spearman等级相关检验后发现ANE患者的临床结局与MR影像评分之间存在显著正相关,由此提出MR评分系统可用于评估ANE患儿的预后,得分越高,预后越差。
2015年,Yamamato等 [ 33] 通过总结2009年以前报道的41例ANE患者与神经系统后遗症相关的临床因素,得出了可能影响预后的多个因素,开发了ANE严重程度量表(ANE-SS),并给出严重程度评分(年龄大于2岁,2分;发病时存在休克,3分;脑干损伤,2分;血小板计数<100×10 9 /L,1分;脑脊液蛋白>60 mg/dL,1分),其中0~1分为低风险、2~4分为中风险、5~9分为高风险,得分越高提示预后越差。然后,又将这个评分表应用于2011年报道的32例ANE患者的预后评估,最后提出ANE-SS可用于评估ANE患儿的预后。
2016年,Lim等 [ 25] 将ANE-SS评分系统用于评估患儿预后,得出后遗症高风险患儿出院时均存在严重损害,1例死亡患儿是该组ANE-SS得分最高者(7分),支持了Yamamato等 [ 33] 的发现,并指出伴有脑干损伤者80%会留有较严重的神经系统后遗症,而不伴脑干损伤者没有或仅有较轻的神经系统后遗症。
另外,还有报道称一些功能影像技术也可能是预后的预测因子。如表观弥散系数图(apparent diffusion coefficient)上呈现的丘脑病变中水弥散受限以及磁共振波谱成像(magnetic resonance spectroscopy)上表现的谷氨酸/谷氨酰胺复合物和脂质活动受限的患者通常会出现严重的后遗症或高病死率 [ 14] 。然而,以上功能影像技术在实际临床工作中应用相对较少。
4总结
参考文献(略)