一批优先审评药物上市,肿瘤、儿童用药、临床急需,你关心哪个?
近日,国家食品药品监督管理总局发布《2017年度药品审评报告》,报告中有一部分内容绝对是吸引人眼球的,那就是一批纳入优先审评程序的注册申请药物审评通过,这其中包括国产自主研发的创新药重组埃博拉病毒病疫苗、口服丙肝治疗用新药阿舒瑞韦软胶囊、非小细胞肺癌靶向药甲磺酸奥希替尼片、儿童抗癫痫用药左乙拉西坦注射用浓溶液、治疗乙肝和艾滋病的国产仿制药富马酸替诺福韦二吡呋酯胶囊等一批具有明显临床价值的药品。
什么是优先审评?2016年02月26日,总局发布《关于解决药品注册申请积压实行优先审评审批的意见》,旨在加快具有临床价值的新药和临床急需仿制药的研发上市,解决药品注册申请积压的矛盾。

《意见》中指出,以下三类药物可以优先审评审批:
(一)具有明显临床价值,符合下列情形之一的药品注册申请:
1.未在中国境内外上市销售的创新药注册申请。
2.转移到中国境内生产的创新药注册申请。
3.使用先进制剂技术、创新治疗手段、具有明显治疗优势的药品注册申请。
4.专利到期前3年的药品临床试验申请和专利到期前1年的药品生产申请。
5.申请人在美国、欧盟同步申请并获准开展药物临床试验的新药临床试验申请;在中国境内用同一生产线生产并在美国、欧盟药品审批机构同步申请上市且通过了其现场检查的药品注册申请。
6.在重大疾病防治中具有清晰的临床定位的中药(含民族药)注册申请。
7.列入国家科技重大专项或国家重点研发计划的新药注册申请。
(二)防治下列疾病且具有明显临床优势的药品注册申请:
1.艾滋病;2.肺结核; 3.病毒性肝炎;4.罕见病;5.恶性肿瘤;6.儿童用药品;7.老年人特有和多发的疾病。
(三)其他
1.在仿制药质量一致性评价中,需改变已批准工艺重新申报的补充申请;
2.列入《关于开展药物临床试验数据自查核查工作的公告》的自查核查项目,申请人主动撤回并改为按与原研药质量和疗效一致的标准完善后重新申报的仿制药注册申请;
3.临床急需、市场短缺的药品注册申请。
截至2017年底,药审中心共将25批423件注册申请纳入优先审评程序,其中具有明显临床价值的新药占比最大,共191件,占45%,儿童用药共47件。
纳入优先审评程序的注册申请情况:
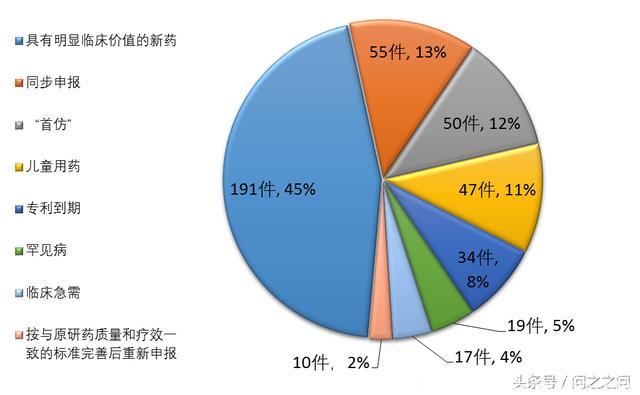
截至2017年底,纳入优先审评程序的423件注册申请中已有272件完成审评,占比为64%。自纳入优先审评程序之日起,新药临床试验申请、新药上市申请、仿制药上市申请首轮审评平均用时分别为39个工作日、59个工作日和81个工作日。
而走正常程序审评的药物,仿制药一致性评价申请平均审评审批用时约为70个工作日(法定时限为140个工作日);新药临床试验申请首轮审评审批平均用时约为120个工作日(法定时限为110个工作日),基本实现按法定时限审评审批。这样看来,的确是快了不少!
优先审评通过的上市药物都有那些?截至2017年底,共有110件注册申请通过优先审评程序得以加快批准上市(以通用名计算,共涉及57个品种),其中,2017年有50个品种。
2017年完成审评建议批准上市的优先审评药品名单:
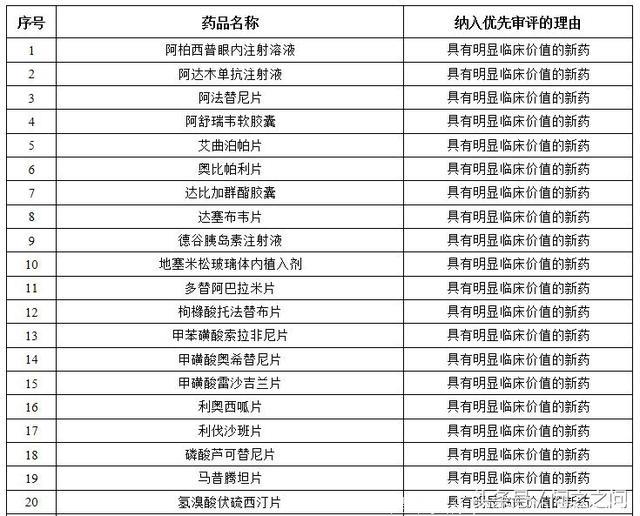
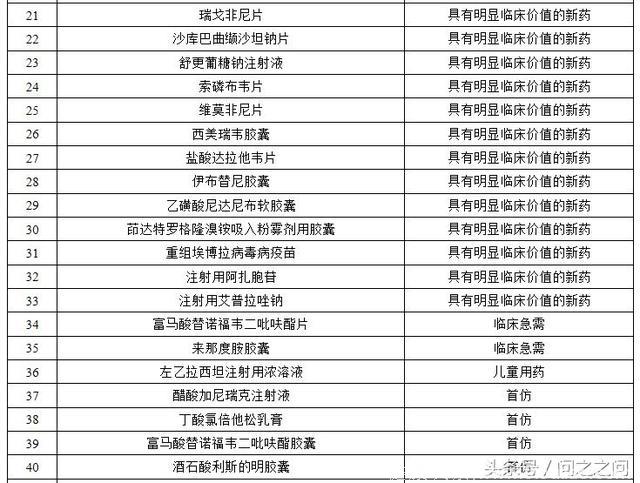
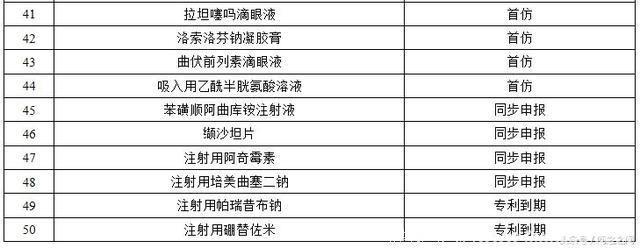
主要是抗肿瘤药物、抗感染药物、风湿性疾病及免疫药物、内分泌系统药物、循环系统药物、皮肤五官药物、神经系统药物、消化系统药物、呼吸系统药物、预防用生物制品(疫苗)。简单列举其中几种药物吧!
1.甲磺酸奥希替尼片:为全球首个第三代晚期肺癌靶向药,适用于既往经表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKI)治疗时或治疗后出现疾病进展,并且经检测确认存在EGFR T790M突变阳性的局部晚期或转移性非小细胞性肺癌(NSCLC)成人患者的治疗。对上述患者具有较好的治疗效果,安全性可以耐受,为上述特定的患者人群提供了新的治疗选择。肺癌是我国发病率和死亡率最高的恶性肿瘤,对于上述患者目前尚无有效的治疗药物,存在明确的临床急需。

2.盐酸达拉他韦片、阿舒瑞韦软胶囊、西美瑞韦胶囊、索磷布韦片、奥比帕利片、达塞布韦片:为直接抗丙型肝炎病毒(HCV)药物,适用于治疗成人慢性丙型肝炎(CHC)。我国约有1000万丙型肝炎患者,上述药物批准上市有效解决了我国没有直接抗病毒药物的局面,为我国慢性丙肝患者提供了有效的突破性治疗手段。
3.多替阿巴拉米片:为含有多替拉韦、阿巴卡韦和拉米夫定3种成分的新型抗人类免疫缺陷病毒(HIV)感染的固定剂量复方制剂,适用于治疗成人和12岁及以上的青少年的HIV感染。目前治疗艾滋病药物有不良反应发生率高、耐受性差、药物相互作用多等缺点,且长期服药存在耐药可能,该药品较已上市的治疗方案有一定的临床优势,为临床增加新的治疗选择。
4.达格列净片:为高选择性的人体肾脏钠葡萄糖共转运体(SGLT2)抑制剂,适用于II型糖尿病患者单药治疗。该药品是全球首个全新作用机制的口服降糖药物,可有效提高患者用药的可及性。
5.甲磺酸雷沙吉兰片:为选择性不可逆单胺氧化酶-B(MAO-B)抑制剂,适用于治疗原发性帕金森病。该药品在国外用于帕金森病早期的一线单药治疗,或与左旋多巴联用治疗中、重度帕金森病,可有效提高患者用药的可及性。
6.丹龙口服液:为新的中药复方制剂,适用于治疗中医热哮证、支气管哮喘患者。该药品为我国上市许可持有人制度试点实施以来首个获批的中药新药品种,为哮喘病患者提供一种全新的安全有效的治疗方案,对提高患者的生存质量具有重要意义。
7.重组埃博拉病毒病疫苗(腺病毒载体):为我国自主研发的重组埃博拉疫苗,也是全球首个2014基因突变型埃博拉疫苗。
可以看到,优先审评的药物中有针对患病率极高的肺癌的,还有抗病毒药物和抗HIV病毒药物,糖尿病和帕金森病也是急需的药物,还有创新中药制剂,当然我国在抗埃博拉病毒中做出了突出贡献,埃博拉病毒疫苗也要上市呀!
你对哪种药上市比较关心?你认为哪类药应该加快上市步伐?目前我国对抗肿瘤、抗病毒、抗HIV药物是急需的,对于糖尿病、帕金森病、阿尔兹海默症这样的慢性病也需要创新药物来治疗,此外,针对一些罕见病和儿童疾病也急切需要新药治疗,这就需要政府、药企、医药科研人员的共同努力了!
