妊娠和肺动脉高压(二)
点击跳转:妊娠和肺动脉高压(一)
作者 | 李宏亮 北京大学第三医院 危重医学科
来源 | 医学界急诊与重症频道
产前监护:
如果 PH 孕妇坚持继续妊娠,对其进行严密的监测至关重要:在孕早、中期至少每四周要进行一次专项检查(ECG,运动试验如6分钟步行试验等),孕晚期后频率增加到每周一次,且每次检查最好行超声心动图以评估心脏状态并据此调整治疗药物。多学科专家联合会诊(PH 专家、心脏病专家、产科专家、擅长高危妊娠的麻醉专家,重症监护专家、新生儿专家),与患者及家属充分沟通,告知继续妊娠过程中可能面临的风险并采取相应应对措施,有助于改善母婴预后[12]。孕妇本身要注意多休息、低盐饮食以减少心脏负担。为避免下腔静脉受压,患者应左侧卧位。建议孕中期就住院治疗,低氧血症时应该吸氧。如果肺血流动力学对血管扩张药物敏感,可以使用钙通道阻滞剂(FDA 妊娠分级 C 级)。无论是 iPAH 还是 CTEPH 都应该常规抗凝,对于合并有妊娠之外的抗凝适应症,也应该继续抗凝药物治疗,但对于有出血风险的例如艾森曼格综合征或门脉高压的孕妇建议谨慎使用,个体化用药。华法林的妊娠分级为X级,应该立即停用,如果确有抗凝需要,可以使用低分子肝素(LMWH),其中 iPAH 使用预防剂量,而 CTEPH 使用全量抗凝,每天两次。患者卧床制动或住院都应使用 LMWH,术前及术后的晚上最好都使用预防剂量。孕妇血容量以及肾小球滤过率的增加可能影响药物代谢,必须小心监测抗凝效果并调整剂量。应告知患者波生坦有致畸作用,怀孕前最好停药并换用其他药物。建议尽早使用前列环素类似物或西地那非等特异性靶向治疗措施。
由于瓦氏动作可减少静脉回流,尽可能避免便秘。一旦胎儿成熟(一般 34 孕周)建议选择性剖宫产。如果在 20 - 24 周或孕早期病情就开始出现恶化[13],应及时行治疗性流产。
围产期监护:
密切监护血流动力学至关重要。中心静脉穿刺置管(CVC)可监测右房压及混合静脉血氧饱和度,如果血容量丢失过多还可以用来快速补液;CVC 联合动脉压监测足以评估血流动力学状况。至于留置 Swan-Ganz 导管去监测肺动脉压力会增加肺动脉破裂及血栓形成的风险,弊大于利,不建议常规使用。
产后监护:
产后的急性失代偿是最危险的阶段,患者应在 ICU 内严密监护 5 - 7 日直至平稳。对于 iPAH 和 CTEPH 患者都要继续使用抗凝药物。妊娠期间血容量可增加 40 - 50%,在孕晚期达峰,分娩后快速恢复正常,但有也最长可持续至产后 24 周。产后液体从血管外间隙转移到血管内,其血流动力学改变可能需要六个月的时间才能恢复到基础状态,且并非所有患者都能恢复到基础心肺功能。围术期尽量维持液体平衡,将血压及 CVP 控制在产前水平,目标血色素 > 9 g/dl,最好 10 g/dl。CVP升高可适当利尿,利尿无效提示右心功能极差,可增加静脉前列环素使用剂量并加用小剂量的多巴酚丁胺,从 2 ug/kg/min 起始并逐渐滴定至合适剂量。如果增加肺血管扩张药物及正性肌力药物的剂量血压仍然恶化,可考虑静脉使用去甲肾上腺素。维持充足的氧合亦很重要,SaO2 维持在 94 - 98%。催产素可引起低血压及心动过速,但可以降低产后出血风险,建议持续静脉泵入 5 U/h 的催产素,需要的话可以重复使用,如果出现血压下降最好停药。
患者出院后建议每周随诊一次,逐渐延长到两周一次,每月一次直至三个月一次。
哺乳:
目前尚无证据表明治疗 PH 的药物是否能够进入乳汁,以及对新生儿的影响,鉴于这种不确定性,不建议哺乳。
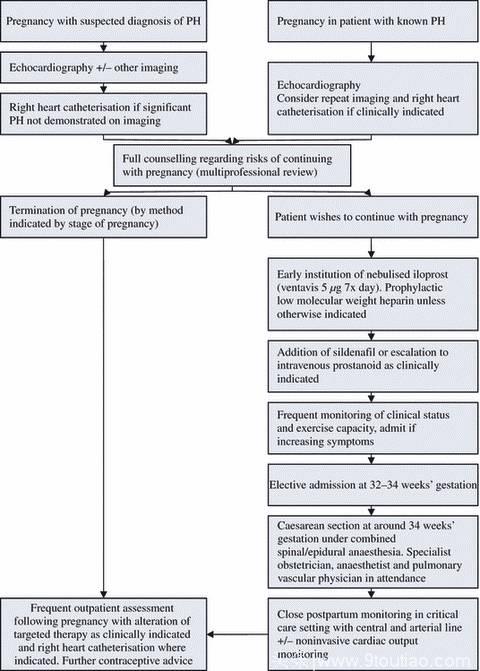
图四、处理 PH 孕妇流程(摘自BJOG. 2010 Apr;117(5):565-74.)
靶向药物治疗策略(表二、表三):
高选择性药物治疗主要局限于 1 组 PAH 患者,在其问世之前,IPAH 患者平均生存时间仅为 2.8 年,临床使用后五年生存率提高至 75%[16]。有部分 2 组患者也可考虑使用,但疗效并不理想[17,18]。
前列环素类似物:是一种通过腺苷酸环化酶作用的有效血管扩张剂,在扩张肺动脉的同时还有抗增殖、抗血小板形成和抗炎作用。
依前列醇(Epoprostenol)和曲罗尼尔 (Treprostinil):多个病例报道显示,静脉持续泵入依前列醇可有效治疗PAH孕妇[19-24]。作为第一个,也是唯一经证实强烈推荐(A级)用于治疗纽约心脏病协会(NYHA)心功能 Ⅳ 级 PAH 患者的药物,其体内半衰期短,约为 3 - 5 min,可用来快速滴定以选择合适剂量。患者在整个妊娠期间最好持续用药不要间断,直至产后。如果病情稳定,可在产后几个月的时间内逐渐减药。副作用是血小板减少,增加出血风险,可能需要输注血小板和去氨加压素治疗。另外较短的半衰期要求必须使用输液泵经由中心静脉导管(CVC)持续输注,相应增加了长期留置 CVC 的风险。平时使用吸入制剂的患者而言,围术期会多种因素导致无法用药,建议换用静脉制剂。不适合依前列醇治疗的患者可选择曲罗尼尔[25],后者为皮下注射制剂,半衰期约为 80 min,通过一个带有小型皮下导管的微泵完成(类似于糖尿病患者使用的胰岛素泵)。
伊洛前列素(iloprost):为吸入制剂,与依前列醇相比,其血浆半衰期延长,为 20 - 30 min,肺血管扩张效应可维持 1 - 2 h,且在室温下稳定。大鼠实验显示在 0.01-0.5 mg/kg/d 的静脉制剂有胎儿毒性,影响生育能力[26],但截止目前尚没有人体的对照试验,也没有胎儿致畸及母体死亡的报道,属于妊娠 C 级药物,仅限于没有其它替代药物,且获益大于风险的孕妇使用[27-29],在美国目前尚未得到 FDA 批准。
吸入一氧化氮(Nitric Oxide):
NO 吸入治疗 PAH 孕妇也见于少量病例报告[30-32],其操作简单,起效迅速(图五)。
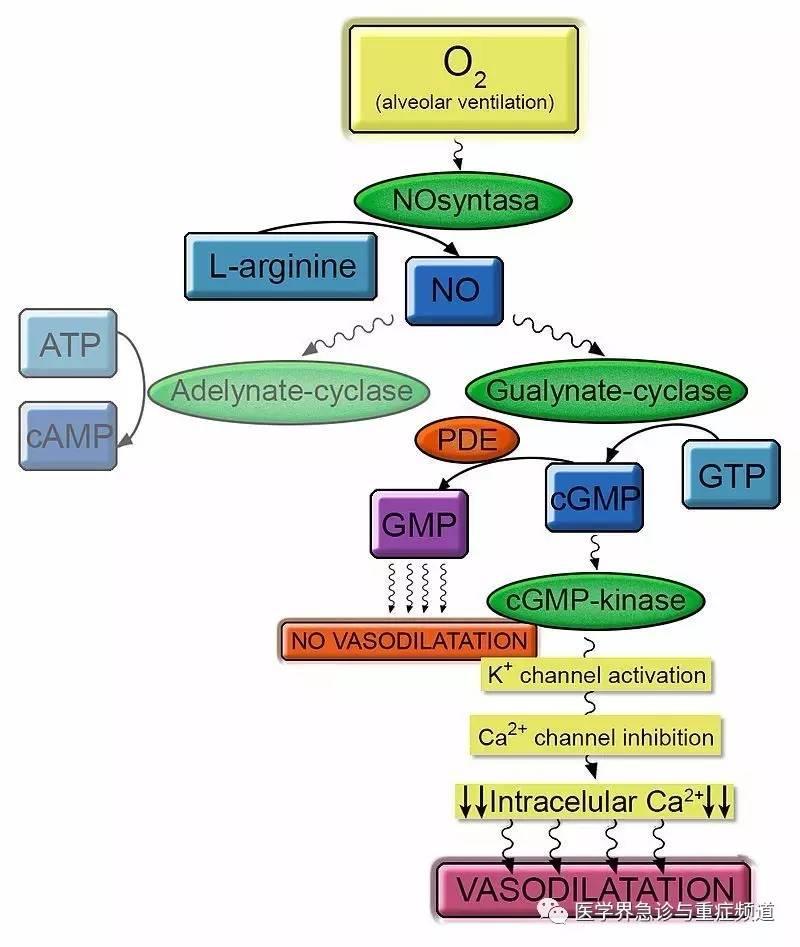
图五、NO 介导的血管扩张分子机制示意图
磷酸二酯酶-5抑制剂(口服制剂):
关于使用西地那非(sildenafil)的治疗仍然仅见于病例报告[20,33-35]。研究显示,西地那非还有其它作用,例如舒张子宫动脉,改善子宫内膜功能不良的体外受精孕妇子宫肌层厚度[36]。西地那非和 NO 均已成功应用于早产、足月产、新生儿及婴幼儿的 PH[37,38]。长效制剂他达拉非(tadalafil)也已经被 PDA 批准使用,但目前尚未见到临床报道。
内皮素受体拮抗剂(endothelin receptor antagonists):
波生坦(bosentan)及安倍生坦(ambrisentan)为口服制剂,但有胎儿毒性,孕妇要避免使用。
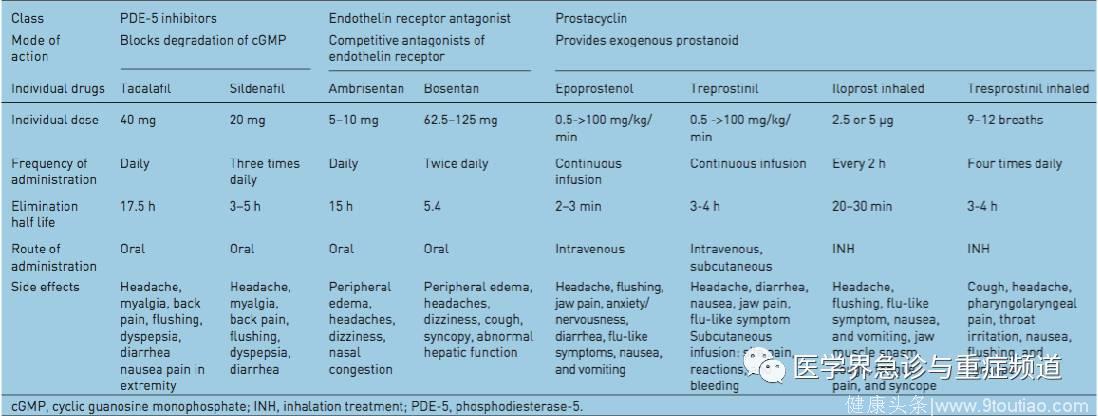
表二:用于治疗妊娠合并PH的药物一览表
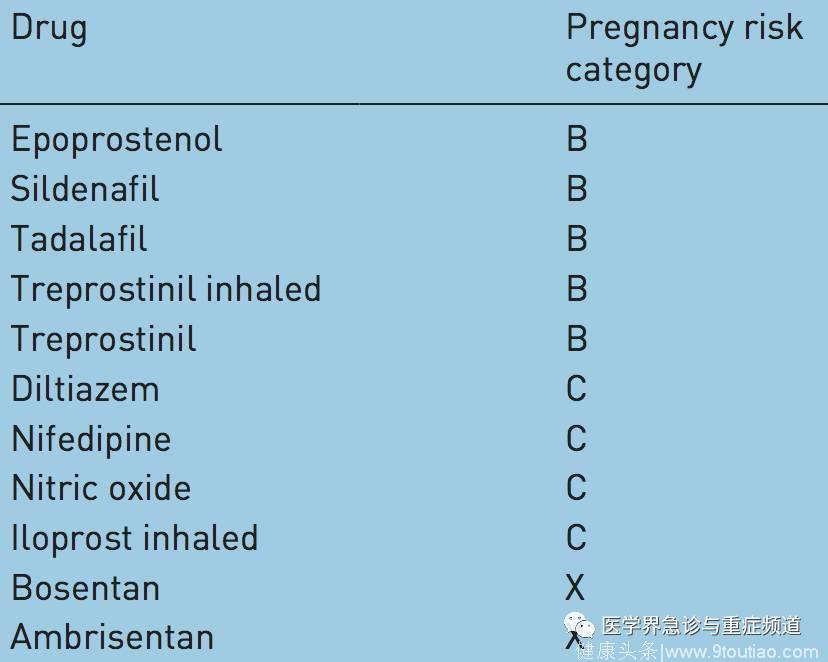
表三:美国 FDA 对 PAH 特异性治疗药物进行的妊娠风险分类
临床研究:
在 PAH 特异性治疗药物问世之前,PAH 的孕妇病死率报道不一,约 30 - 50%,但研究病例数均较少。有系统回顾研究涵盖了跨度长达 30 年,共计 198 例的 PH 孕妇资料。前期(1978-1996)研究[4]中(125例),死亡率在 73 例艾森曼格综合征中为 36%,在 27 例原发性 PH(PPH)中为 30%,在 25 例继发性血管性 PH(SVPH)中为 56%。除三例艾森曼格综合征分娩前死亡外,其余死亡病例均发生在产后 35 天以内,总体死亡率为 38%。诊断延迟和住院过晚是孕妇死亡的独立危险因素。三组新生儿存活率相似,87 - 89%。
后期(1997-2007)研究[3]中(73 例),有 29 例 iPAH、29 例 CHD-PAH 和 15 例 oPH(other reason caused PH),靶向治疗药物使用率分别为 72%、52% 和 47%,死亡率分别为17%、28% 和 33%(与之对应的前期研究中分别为 30%、36% 和 56%),总体死亡率低于前期研究(25% vs 38%, P= 0.047)。78% 死亡病例集中在分娩后一个月内(15 例产后死亡,3 例孕期死亡),主要死因是心衰和猝死,另外肺栓塞也较常见。初产妇及全麻的死亡风险最高,其中全麻死亡风险约为局麻的四倍,前者可能是因为经产妇之前都经历过生产,病情相对更轻;后者一方面是全麻本身的风险,另外一般只有在临床症状重的患者才会使用全麻。85% 的产妇使用了钙通道阻滞剂,仅五例使用了西地那非(美国 FAD 在 2005 年才批准上市)。NO 或前列环素类似物的治疗并未能改善预后,可能是因为大多数患者接受治疗时间较晚,此时往往已经病情不稳定且合并顽固性心衰。如果早期开始治疗有可能改善病情。
2016 年,Sliwa 等[39]报道了欧洲心脏病学会妊娠及心脏疾病注册项目(Registry of Pregnancy and Cardiac Disease,ROPAC)的数据,在 2966 例孕妇中,有 151 例经右心导管或超声心动图明确诊断合并PH(平均年龄 29.2 ± 5.6 岁,37% 为初产妇)中,其中 39 例(26%)为 PAH,112 例(74%)由左心疾病所致。超过 75% 的患者在妊娠前就已经诊断PH。至于右心室收缩压(right ventricular systolic pressure,RVSP),59.6% 的患者 < 50 mmHg,28.5%的患者在 50 - 70 mmHg,11.9% 的患者 > 70 mmHg。
治疗方面, 41 例患者(27.2%)使用利尿剂,14 例(9.3%)使用地高辛,其中 4 例为临时使用。9 例患者使用磷酸二酯酶抑制剂(PDE5-i),其中 4 例还使用了内皮素受体拮抗剂(endothelin-receptor antagonist,ERA),3 例患者使用前列环素类似物。1例患者同时使用了上述三种药物。在使用ERA的患者中,1 例发生产后肺栓塞合并心衰,另 1 例患者因栓塞致盲 5 天。
并发症包括流产(5.6%),胎死宫内(2%),早产(21.7%),出生低体重(19.0%),新生儿死亡(0.7%)。
75 例患者住院治疗(26例多次住院),平均住院时间 27 周。因心脏问题住院中位时间为 25.1 周,主要是心衰(42例)。虽然分娩过程中无死亡病例,但 5 例患者(3.3%)在分娩后一周内因急性心衰死亡,剩下随访到的 78 例患者中,有两例(2.6%)分娩后 6 个月内死亡。死亡率最高的是iPAH组(3/7,43%)。妊娠期间心衰发生率 27%。
在有分娩记录的 145 例患者中,92 例患者(63.4%)因心脏问题行剖宫产手术(23.9%为急诊剖宫产),其中有 65 例有麻醉记录:21 例(32.3)全麻,44例(67.7%)局麻,前者中5例(11.4%),后者中 3 例(14.3%)分娩后一周内发生心衰。急诊剖宫产术后 2 例(9.1%)死亡,择期术后死亡 2 例(2.9%), 10 例患者自然分娩,6 例患者(4.0%)行人工流产。53 例(36.6%)经阴道分娩。23 例(43.4%)经阴道引产。经阴道分娩在围分娩期或分娩后一周内的心衰发生率为3.8%,一周内死亡率 0%,而 CS 组分别为 13.0% 和 4.5%,均无统计学差异(P 分别为 0.07 和 0.19)。
胎儿预后:
关于妊娠期肺循环及对胎盘血流的影响的资料非常少,但已知在正常孕妇中,虽然肺血流增加,但 MPAP 并无变化[40],意味着肺血管阻力是下降的。PH 孕妇的肺血管阻力在妊娠期间无法降低,导致 CO 显著降低,缺氧给胎儿也带来一系列风险,例如胎儿发育迟滞、胎停滞、胎盘生长中断、早产等[41]。本研究中14例妊娠(9.3%)发生胎死宫内或新生儿出生后一周内死亡。20 例(13.8%)新生儿小于孕周,其中 13 例体重低于 2500 克。在全部 28 例(19.3%)低体重新生儿中,25 例(27.2%)为剖宫产,3 例(5.7%)为经阴道分娩(P = 0.002)。6 例新生儿(4.0%)有心脏异常。母体缺氧对胎儿的长期影响尚不明确,我们目前知道的是新生儿低体重增加了未来罹患糖尿病、心脏疾患和高血压的风险[42]。
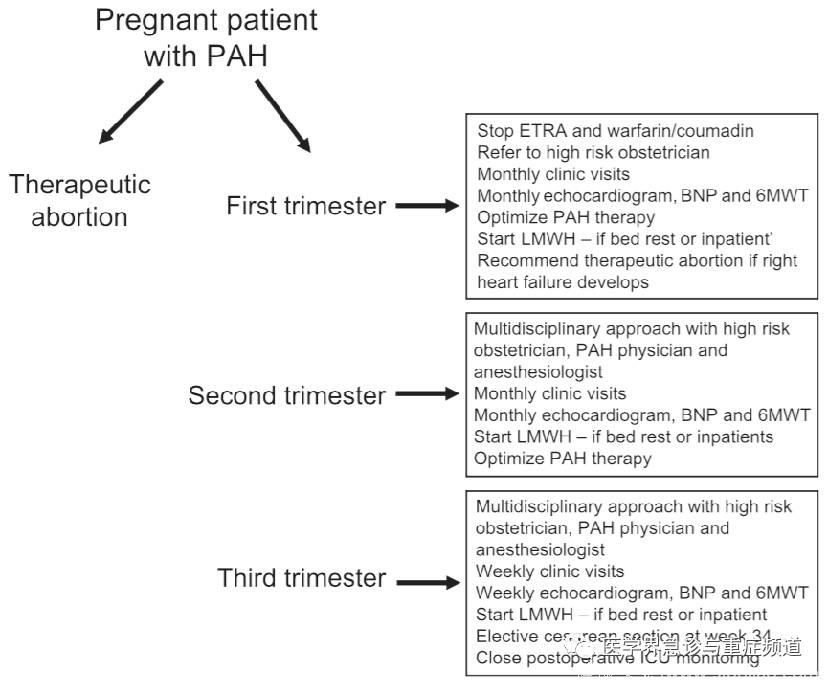
图六、对PH孕妇的评估及随诊建议。(BNP:脑钠肽;ETRA:内皮素受体拮抗剂;LMWH:低分子肝素;PAH:肺动脉高压;6MWT:6分钟步行试验)
结语:
妊娠合并肺高压虽然异常凶险,但随着医学科学技术的飞速进步,监测手段不断增多,药物研发进展迅速,加上对相关病理生理机制的持续深入认识,这一高致死率的妊娠期急危重症已经不再像既往那样让人望而生畏,但多学科的联合管理,及时救治仍然必不可少。希望在不久的将来,医学能够攻克这一难题,造福于那些同样拥有传递生命意愿,但不幸合并有PH的家庭。
参考文献
[1] Hoeper MM, Bogaard HJ, Condliffe R, Frantz R, Khanna D, Kurzyna M, Langleben D, Manes A, Satoh T, Torres F et al: Definitions and diagnosis of pulmonary hypertension. Journal of the American College of Cardiology 2013, 62(25 Suppl):D42-50.
[2] Kovacs G, Berghold A, Scheidl S, Olschewski H: Pulmonary arterial pressure during rest and exercise in healthy subjects: a systematic review. The European respiratory journal 2009, 34(4):888-894.
[3] Bedard E, Dimopoulos K, Gatzoulis MA: Has there been any progress made on pregnancy outcomes among women with pulmonary arterial hypertension? European heart journal 2009, 30(3):256-265.
[4] Weiss BM, Zemp L, Seifert B, Hess OM: Outcome of pulmonary vascular disease in pregnancy: a systematic overview from 1978 through 1996. Journal of the American College of Cardiology 1998, 31(7):1650-1657.
[5] European Society of G, Association for European Paediatric C, German Society for Gender M, Regitz-Zagrosek V, Blomstrom Lundqvist C, Borghi C, Cifkova R, Ferreira R, Foidart JM, Gibbs JS et al: ESC Guidelines on the management of cardiovascular diseases during pregnancy: the Task Force on the Management of Cardiovascular Diseases during Pregnancy of the European Society of Cardiology (ESC). European heart journal 2011, 32(24):3147-3197.
[6] Simonneau G, Galie N, Rubin LJ, Langleben D, Seeger W, Domenighetti G, Gibbs S, Lebrec D, Speich R, Beghetti M et al: Clinical classification of pulmonary hypertension. Journal of the American College of Cardiology 2004, 43(12 Suppl S):5S-12S.
[7] Pengo V, Lensing AW, Prins MH, Marchiori A, Davidson BL, Tiozzo F, Albanese P, Biasiolo A, Pegoraro C, Iliceto S et al: Incidence of chronic thromboembolic pulmonary hypertension after pulmonary embolism. N Engl J Med 2004, 350(22):2257-2264.
[8] Humbert M, Sitbon O, Chaouat A, Bertocchi M, Habib G, Gressin V, Yaici A, Weitzenblum E, Cordier JF, Chabot F et al: Pulmonary arterial hypertension in France: results from a national registry. American journal of respiratory and critical care medicine 2006, 173(9):1023-1030.
[9] Kiely DG, Elliot CA, Sabroe I, Condliffe R: Pulmonary hypertension: diagnosis and management. BMJ (Clinical research ed) 2013, 346:f2028.
[10] Galie N, Humbert M, Vachiery JL, Gibbs S, Lang I, Torbicki A, Simonneau G, Peacock A, Vonk Noordegraaf A, Beghetti M et al: 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT). European heart journal 2016, 37(1):67-119.
[11] Hunter S, Robson SC: Adaptation of the maternal heart in pregnancy. Br Heart J 1992, 68(6):540-543.
[12] Kiely DG, Condliffe R, Webster V, Mills GH, Wrench I, Gandhi SV, Selby K, Armstrong IJ, Martin L, Howarth ES et al: Improved survival in pregnancy and pulmonary hypertension using a multiprofessional approach. Bjog 2010, 117(5):565-574.
[13] Bonnin M, Mercier FJ, Sitbon O, Roger-Christoph S, Jais X, Humbert M, Audibert F, Frydman R, Simonneau G, Benhamou D: Severe pulmonary hypertension during pregnancy: mode of delivery and anesthetic management of 15 consecutive cases. Anesthesiology 2005, 102(6):1133-1137; discussion 1135A-1136A.
[14] Blaise G, Langleben D, Hubert B: Pulmonary arterial hypertension: pathophysiology and anesthetic approach. Anesthesiology 2003, 99(6):1415-1432.
[15] Duggan AB, Katz SG: Combined spinal and epidural anaesthesia for caesarean section in a parturient with severe primary pulmonary hypertension. Anaesthesia and intensive care 2003, 31(5):565-569.
[16] Ling Y, Johnson MK, Kiely DG, Condliffe R, Elliot CA, Gibbs JS, Howard LS, Pepke-Zaba J, Sheares KK, Corris PA et al: Changing demographics, epidemiology, and survival of incident pulmonary arterial hypertension: results from the pulmonary hypertension registry of the United Kingdom and Ireland. American journal of respiratory and critical care medicine 2012, 186(8):790-796.
[17] Hurdman J, Condliffe R, Elliot CA, Davies C, Hill C, Wild JM, Capener D, Sephton P, Hamilton N, Armstrong IJ et al: ASPIRE registry: assessing the Spectrum of Pulmonary hypertension Identified at a REferral centre. The European respiratory journal 2012, 39(4):945-955.
[18] Condliffe R, Kiely DG, Gibbs JS, Corris PA, Peacock AJ, Jenkins DP, Hodgkins D, Goldsmith K, Hughes RJ, Sheares K et al: Improved outcomes in medically and surgically treated chronic thromboembolic pulmonary hypertension. American journal of respiratory and critical care medicine 2008, 177(10):1122-1127.
[19] Garabedian MJ, Hansen WF, Gianferrari EA, Lain KY, Fragneto RY, Campbell CL, Booth DC: Epoprostenol treatment for idiopathic pulmonary arterial hypertension in pregnancy. Journal of perinatology : official journal of the California Perinatal Association 2010, 30(9):628-631.
[20] Goland S, Tsai F, Habib M, Janmohamed M, Goodwin TM, Elkayam U: Favorable outcome of pregnancy with an elective use of epoprostenol and sildenafil in women with severe pulmonary hypertension. Cardiology 2010, 115(3):205-208.
[21] Geohas C, McLaughlin VV: Successful management of pregnancy in a patient with eisenmenger syndrome with epoprostenol. Chest 2003, 124(3):1170-1173.
[22] Stewart R, Tuazon D, Olson G, Duarte AG: Pregnancy and primary pulmonary hypertension : successful outcome with epoprostenol therapy. Chest 2001, 119(3):973-975.
[23] Badalian SS, Silverman RK, Aubry RH, Longo J: Twin pregnancy in a woman on long-term epoprostenol therapy for primary pulmonary hypertension. A case report. The Journal of reproductive medicine 2000, 45(2):149-152.
[24] Easterling TR, Ralph DD, Schmucker BC: Pulmonary hypertension in pregnancy: treatment with pulmonary vasodilators. Obstet Gynecol 1999, 93(4):494-498.
[25] Chin KM, Channick RN, de Lemos JA, Kim NH, Torres F, Rubin LJ: Hemodynamics and epoprostenol use are associated with thrombocytopenia in pulmonary arterial hypertension. Chest 2009, 135(1):130-136.
[26] Battenfeld R, Schuh W, Schobel C: Studies on reproductive toxicity of iloprost in rats, rabbits and monkeys. Toxicol Lett 1995, 78(3):223-234.
[27] Streit M, Speich R, Fischler M, Ulrich S: Successful pregnancy in pulmonary arterial hypertension associated with systemic lupus erythematosus: a case report. Journal of medical case reports 2009, 3:7255.
[28] Elliot CA, Stewart P, Webster VJ, Mills GH, Hutchinson SP, Howarth ES, Bu'lock FA, Lawson RA, Armstrong IJ, Kiely DG: The use of iloprost in early pregnancy in patients with pulmonary arterial hypertension. The European respiratory journal 2005, 26(1):168-173.
[29] Curry RA, Fletcher C, Gelson E, Gatzoulis MA, Woolnough M, Richards N, Swan L, Steer PJ, Johnson MR: Pulmonary hypertension and pregnancy--a review of 12 pregnancies in nine women. Bjog 2012, 119(6):752-761.
[30] Robinson JN, Banerjee R, Landzberg MJ, Thiet MP: Inhaled nitric oxide therapy in pregnancy complicated by pulmonary hypertension. Am J Obstet Gynecol 1999, 180(4):1045-1046.
[31] Weiss BM, Maggiorini M, Jenni R, Lauper U, Popov V, Bombeli T, Spahn DR: Pregnant patient with primary pulmonary hypertension: inhaled pulmonary vasodilators and epidural anesthesia for cesarean delivery. Anesthesiology 2000, 92(4):1191-1194.
[32] Goodwin TM, Gherman RB, Hameed A, Elkayam U: Favorable response of Eisenmenger syndrome to inhaled nitric oxide during pregnancy. Am J Obstet Gynecol 1999, 180(1 Pt 1):64-67.
[33] Tacoy G, Ekim NN, Cengel A: Dramatic response of a patient with pregnancy induced idiopathic pulmonary arterial hypertension to sildenafil treatment. The journal of obstetrics and gynaecology research 2010, 36(2):414-417.
[34] Lacassie HJ, Germain AM, Valdes G, Fernandez MS, Allamand F, Lopez H: Management of Eisenmenger syndrome in pregnancy with sildenafil and L-arginine. Obstet Gynecol 2004, 103(5 Pt 2):1118-1120.
[35] Villanueva-Garcia D, Mota-Rojas D, Hernandez-Gonzalez R, Sanchez-Aparicio P, Alonso-Spilsbury M, Trujillo-Ortega ME, Necoechea RR, Nava-Ocampo AA: A systematic review of experimental and clinical studies of sildenafil citrate for intrauterine growth restriction and pre-term labour. J Obstet Gynaecol 2007, 27(3):255-259.
[36] Sher G, Fisch JD: Effect of vaginal sildenafil on the outcome of in vitro fertilization (IVF) after multiple IVF failures attributed to poor endometrial development. Fertil Steril 2002, 78(5):1073-1076.
[37] Karatza AA, Bush A, Magee AG: Safety and efficacy of Sildenafil therapy in children with pulmonary hypertension. International journal of cardiology 2005, 100(2):267-273.
[38] Travadi JN, Patole SK: Phosphodiesterase inhibitors for persistent pulmonary hypertension of the newborn: a review. Pediatric pulmonology 2003, 36(6):529-535.
[39] Sliwa K, van Hagen IM, Budts W, Swan L, Sinagra G, Caruana M, Blanco MV, Wagenaar LJ, Johnson MR, Webb G et al: Pulmonary hypertension and pregnancy outcomes: data from the Registry Of Pregnancy and Cardiac Disease (ROPAC) of the European Society of Cardiology. European journal of heart failure 2016, 18(9):1119-1128.
[40] Robson SC, Hunter S, Boys RJ, Dunlop W: Serial changes in pulmonary haemodynamics during human pregnancy: a non-invasive study using Doppler echocardiography. Clin Sci (Lond) 1991, 80(2):113-117.
[41] Kampman MA, Bilardo CM, Mulder BJ, Aarnoudse JG, Ris-Stalpers C, van Veldhuisen DJ, Pieper PG: Maternal cardiac function, uteroplacental Doppler flow parameters and pregnancy outcome: a systematic review. Ultrasound Obstet Gynecol 2015, 46(1):21-28.
[42] Barker DJ, Gelow J, Thornburg K, Osmond C, Kajantie E, Eriksson JG: The early origins of chronic heart failure: impaired placental growth and initiation of insulin resistance in childhood. European journal of heart failure 2010, 12(8):819-825.