《科学》:解开癌症转移之谜,CRISPR技术给每个癌细胞打上特殊“标签”
▎药明康德内容团队编辑
我们都知道对于癌症患者来说,在癌症尚未转移的时候接受治疗,往往会有良好的治疗效果。然而一旦癌症出现转移,患者的治疗前景会显著下降。据统计,90%癌症患者的死亡是因为癌症转移。然而,我们并不是完全了解癌症转移的过程。在成千上万的原位癌细胞中哪些是导致癌症转移的“罪魁祸首”?它们在转移过程中又产生过哪些变化,转移到身体的哪些组织中?如果能够给每个癌细胞打上一个独特的“标签”,就有可能追踪它们和它们后代的演变和转移过程。
日前在《科学》杂志上发表的一篇论文中,科学家们使用CRISPR基因编辑技术,给每个癌细胞打上了独特的“标签”。这一技术能够以单细胞的分辨率,追踪癌细胞在身体中的动向。它不但更为清晰地描述了癌症转移的过程,而且发现了导致转移的“热点”基因和癌症转移的“中转枢纽”。研究人员表示,这可能开启抗癌药物开发的新方向。

在这项研究中,研究人员在癌细胞中导入了表达Cas9酶的基因和指导它们在癌细胞基因组的特定区域进行切割的指导RNA。随着癌细胞的不断分裂和增殖,Cas9酶在这些指定区域会不断进行切割,而癌细胞的DNA修复机制会不断修补这些缺口,在修补的过程中,会引入各种各样的插入序列。这些插入的序列会随着细胞的分裂一代代地传递下去,成为每个癌细胞携带的独特“标签”。
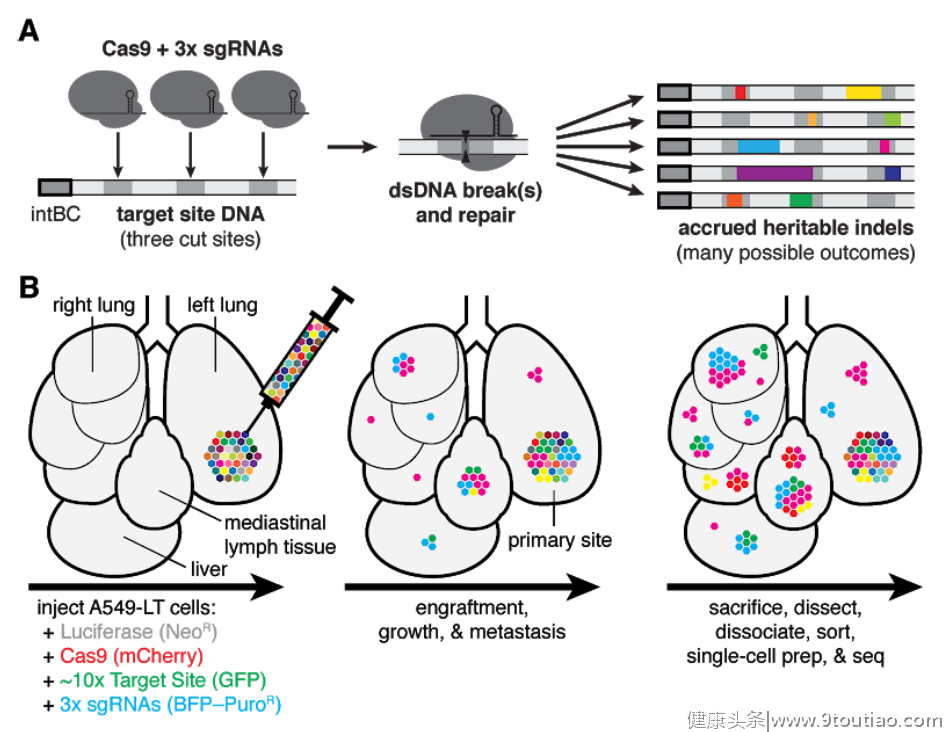
▲使用CRISPR技术在单细胞水平追踪癌细胞演变和转移的机理示意图(图片来源:参考资料[4])
然后,研究人员将这些癌细胞注射到小鼠的肺部,模拟肺癌的发生,它们同时携带着荧光标记。几十天后,携带荧光标记的转移瘤出现在小鼠身体的各个不同组织中。这时,研究人员把这些转移瘤解剖出来分解成单细胞,通过对单细胞的基因组测序来追溯它们的转移过程。由于每个癌细胞中都携带着独特的“标签”,研究人员可以画出非常精细的癌细胞演化图谱。
他们发现,虽然移植到小鼠肺中的癌细胞来自同一个细胞系,但是不同细胞之间在转移潜力上有很大的区别。有的癌细胞和它的所有后代都只在一个组织中出现,意味着它们没有发生转移,而另外一些癌细胞的后代在多个组织中出现。
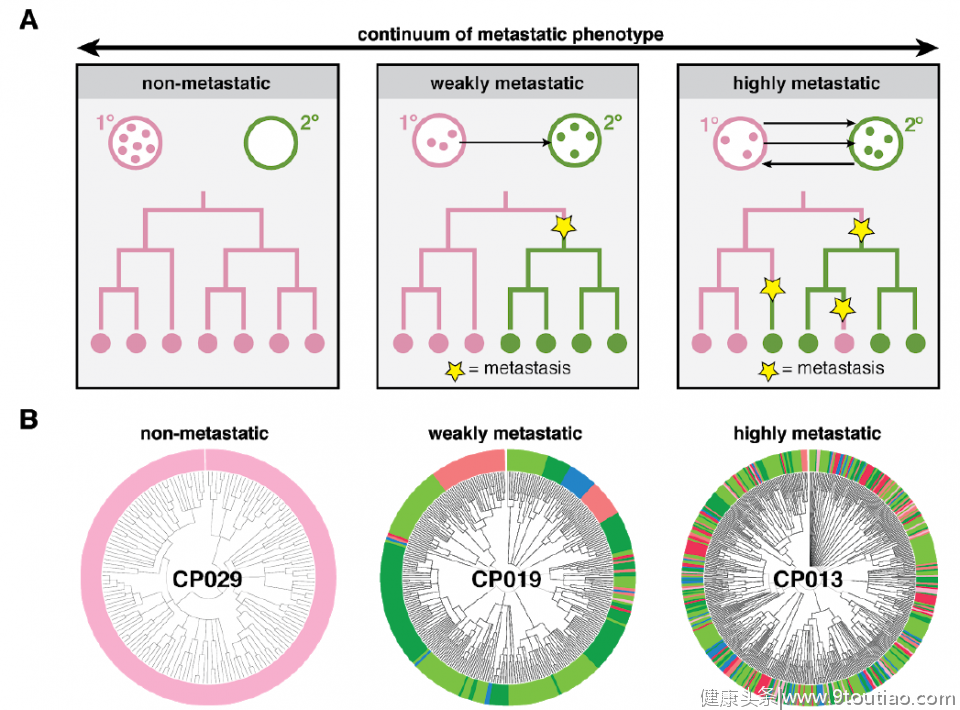
▲不同癌细胞的转移潜力差别很大。A,具有不同转移潜力的癌细胞传代示意图,不同颜色代表不同组织,黄色星标显示出现转移事件;B,癌细胞谱系追踪图,圆圈的颜色显示不同的组织,颜色越杂表明细胞转移次数越多。(图片来源:参考资料[4])
那么是什么因素导致这些癌细胞的转移潜力有所不同呢?通过单细胞RNA测序,研究人员比较了具有不同转移潜力的癌细胞的基因表达图谱。从中,他们发现了许多与高转移潜力癌细胞和低转移潜力癌细胞相关的基因。其中IF127和REG4等基因的高度表达与高转移潜力相关。而KRT17和RPS4Y1等基因的表达与低转移潜力相关。
而且,当研究人员使用CRISPR技术在另一个肺癌细胞系中降低或升高这些基因的表达水平时,它们可以影响癌细胞的转移潜力。表明这些基因表达水平的变化不仅仅与转移潜力存在相关性,而且能够影响癌细胞转移的生理过程。
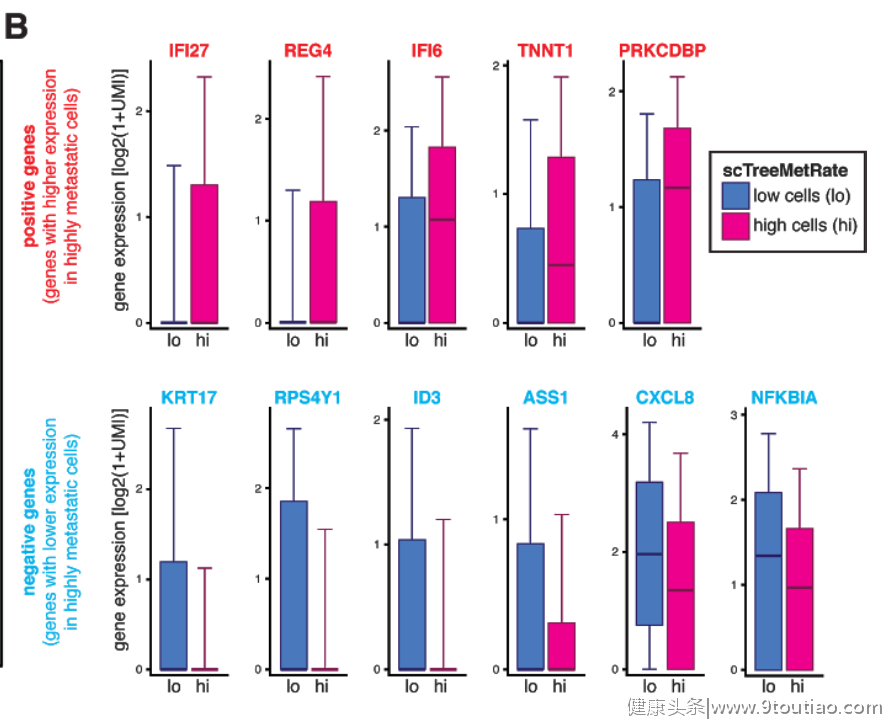
▲在具有高转移潜力的癌细胞(粉色)和低转移潜力的癌细胞(深蓝色)中高度表达的部分基因(图片来源:参考资料[4])
对癌细胞谱系的详细分析还发现了癌细胞转移行为的特定特征,比如,研究人员发现很多转移的癌细胞转移的第一步是从肺部转移到称为纵隔淋巴组织(mediastinal lymph tissue)的“中转枢纽”,然后从这里再转移到身体的其它地方。这项研究的资深作者之一,麻省理工学院(MIT)兼加州大学旧金山分校(UCSF)教授Jonathan S. Weissman博士表示,发现这些“中转枢纽”在抗癌疗法开发方面具有重要意义。“如果你能够聚焦抗癌疗法于这些地方,你可以延缓或者防止癌症转移的发生。”

▲Jonathan S. Weissman教授(图片来源:MIT官网)
展望未来,Weissman博士表示他们不满足于观察癌细胞的动向。“像牛顿力学一样,如果你知道一个球的速度、位置和施加在球上的不同作用力,那么你就知道它下面滚向哪里。” Weissman博士说,“我们希望能够在细胞层面上做同样的事。我们希望能够构建一个驱动肿瘤演化的方程式,任何时候,只要我们能够输入检测到的参数,就能够预测它们未来会发生什么。”
题图来源:123RF注:本文旨在介绍医药健康研究,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。参考资料:[1] Catching cancer in the act. Retrieved January 24, 2021, from https://www.eurekalert.org/pub_releases/2021-01/wifb-cci011521.php[2] Quinn et al., (2021). Single-cell lineages reveal the rates, routes, and drivers of metastasis in cancer xenografts. Science, DOI: 10.1126/science.abc1944.[3] Tracking cancer metastasis with CRISPR opens new areas for drug development. Retrieved January 24, 2021, from https://www.fiercebiotech.com/research/tracing-cancer-metastasis-crispr-opens-new-areas-for-drug-development[4] Quinn et al. (2020). Single-cell lineages reveal the rates, routes, and drivers of metastasis in cancer xenografts. bioRxiv, https://doi.org/10.1101/2020.04.16.045245.