2018,两款重磅新药给RET基因融合的癌症患者带来春天!
精确肿瘤学已经使EGFR,ALK和ROS1突变的患者大大获益。不幸的是,RET改变的癌症患者迄今尚未从精准肿瘤学目标中受益,目前使用的药物是多用途多激酶抑制剂如凡德他尼、卡博替尼(XL184)和仑伐替尼(E7080),他们的活性较低,毒性高。
2018年,各大英文癌症新闻网站的头条几乎都在介绍这两款新一代酪氨酸激酶抑制剂--LOXO-292和BLU-667!给RET基因融合的癌症患者带来春天!

loxo-292
2018年9月6日,Loxo Oncology公司宣布,美国FDA授予该公司的在研药物LOXO-292突破性疗法认定,用于治疗携带RET基因变异的非小细胞肺癌(NSCLC)和甲状腺髓样癌(MTC)患者。这款新药的效果毫不逊色于“传奇”抗癌药Loxo-101,取得了77%的总体缓解率!让更多的肿瘤患者看到了希望!
LOXO-292的突破性疗法认定是基于正在进行中的全球性临床1/2期临床试验的中期结果。
临床设计:
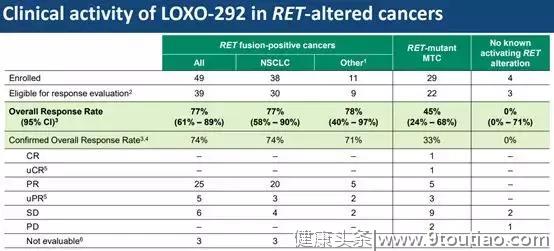
共有82名患者接受了7组LOXO-292治疗,剂量范围从每天20mg到240mg,每天两次。该研究招募的患者均为RET融合阳性癌症患者或RET突变患者。为RET融合阳性包括38例NSCLC患者,9例甲状腺乳头状癌,2例胰腺癌。RET突变组仅包括甲状腺髓样癌患者(n = 29)。
试验结果:
在带有RET融合变异的患者中,LOXO-292的总体缓解率为77%。其中,非小细胞肺癌的总体缓解率也为77%。而在RET变异的甲状腺髓样癌中,这款在研新药的总体缓解率为45%。此外,这款新药还展现出了持久的疗效。首名参与此研究的非小细胞肺癌患者,持续缓解时间已经超过了10个月。
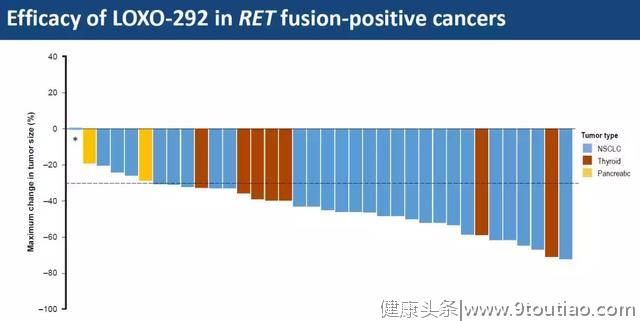
每个柱子代表一位患者,一共36位患者,包括27位非小细胞肺癌(蓝色)、7位甲状腺癌(红色)和2位胰腺癌(黄色),都有RET基因融合;柱子向下代表肿瘤缩小,可以看到除了第一根柱子,其余35根都是朝下的,代表着几乎所有的肿瘤都在缩小。
副作用:
82位患者的副作用统计结果:几乎所有的副作用都是1-2级,基本不太需要药物处理,唯一的三级副作用是呼吸困难,发生的比例只有1%,非常的安全。

Alexander E. Drilon
“LOXO-292的活性是持久的,截至截止数据时,接近90%的患者仍在接受治疗,包括所有对治疗有反应的患者,最长治疗时间超过10个月”,主要研究人员纪念斯隆凯特琳癌症中心的医学肿瘤学家Alexander E. Drilon 博士说。
LOXO-292带来的抗癌奇迹!
肺癌
2005年,现年64岁的梅丽莎克劳斯即将开始新的生活,因为她的孩子已经去上大学了,她想申请新工作。然而不幸的是,她被诊断患有肺癌。手术切除了部分左肺,之后她化疗了。但在2009年,她的肝脏又出现了癌症。她从那以后一直在进行多项临床试验。

Melissa Crouse得到了一种新的靶向抗癌药物的帮助
最后,她进行了基因检测,发现RET融合阳性,于是幸运的入组一种针对这种遗传缺陷的新药LOXO-292试验,这让克劳斯的肿瘤迅速萎缩。
“我现在感觉比现在好多了,”克劳斯说。她可以自己去商店购物,帮她的女儿照看五岁的孙女。

当然,这样的幸运者不止克劳斯一个:
40岁的M女士从不吸烟,却不幸被诊断为晚期非小细胞肺癌:3线化疗后进行了全脑放疗、抗PD1抗体治疗,效果并不理想。
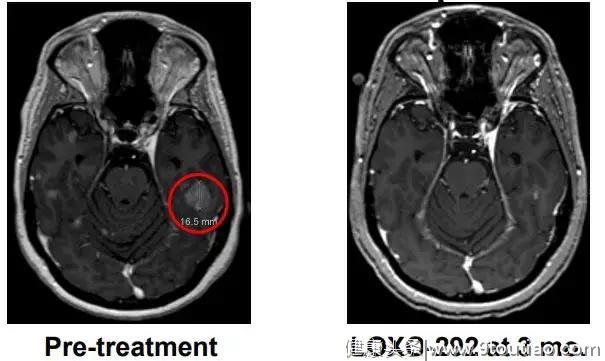
M女士走图无路的情况下接受了基因检测,发现了KIF5B-RET融合,开始接受600 mg BID靶向药 alectinib治疗(PR,7个月),由于脑转移进展增加至900mg BID,后脑转移症状严重,M女士接受了LOXO-292治疗,于是奇迹出现了,治疗两个月后,M女士肺部的病灶明显好转,脑部病灶几乎全部消失!
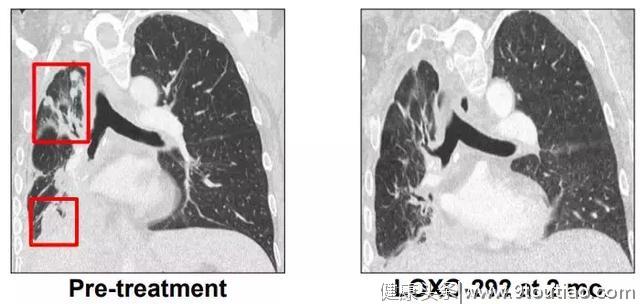
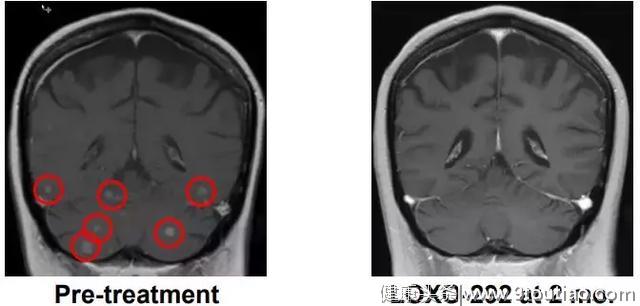

另一位52岁的肺癌患者,化疗耐药之后进行基因检测发现具有KIF5B-RET基因融合,使用LOXO292 4周之后肿瘤显著缩小。
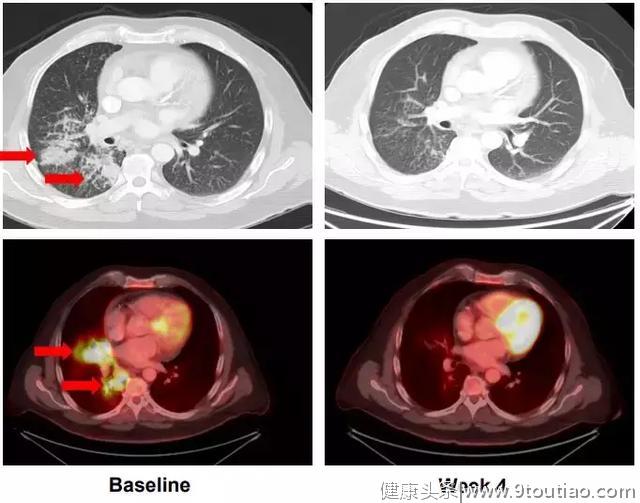
甲状腺癌
61岁男性转移性低分化甲状腺癌;NCOA4-RET融合阳性
在lenvatinib后出现进展,并有呼吸急促,胸痛的症状,LOXO-292治疗八周后评估,最大肿瘤减少-72%,并且患者的症状全部消失,已经重回工作岗位。
哪些患者适合?!
相信上面的数据和案例又让一些晚期患者看到了希望,但Rossy要提醒大家的是,LOXO-292目前没有上市,只是在临床阶段,虽然获得了突破性疗法认证,距离上市也还有不短的试验。目前,只有通过去国外参加临床试验才能用到,但Rossy建议大家先接受正规的治疗,在没有更好治疗方案的情况下可以考虑,另外,由于这款药物是针对RET基因的,所以大家做过多基因检测的患者,可以先看看是否有这个RET基因突变或者融合。没做过的可以尝试进行检测。据了解,在非小细胞肺癌里面,大约1%-2%的患者有RET基因融合,在甲状腺髓样癌中超过60%的患者有RET基因突变,在乳头状甲状腺癌中10%的患者有RET基因融合。
LOXO-292此次临床数据令人欣喜,为患者带来了新的治疗选择,我们期待这款新药能够早市上市,造福患者!

BLU-667
BLU-667是下一代酪氨酸激酶抑制剂,似乎耐受性良好,并且在先前的治疗中进展的RET突变的实体瘤患者中具有广泛的临床益处!这是由世界排名第一的癌症中心MD安德森癌症中心领导的一期临床试验,首次揭示了一种对于RET突变患者安全有效的研究药物,该药物可用来治疗既往难以治疗的甲状腺髓样癌(MTC)、甲状腺乳头状癌,非小细胞肺癌,结直肠癌和胆管癌等!
BLU-667是由Blueprint Medicines Corporation公司开发的一种高效且选择性的口服抑制剂,其靶向致癌RET-融合,抗性突变。该药物的临床前期和早期临床验证也已发表在Cancer Discovery上。

根据MD Anderson发布的新闻稿,BLU-667被选中进行调查是因为它对RET的选择性比其他激酶测试的选择性高100倍!并已被证明可有效阻止与多种激酶治疗抵抗有关的基因突变!

Vivek Subbiah教授
实验设计:
研究人员招募了51例不可切除的晚期实体瘤患者,其中包括RET突变甲状腺髓样癌(MTC) 29例,RET融合非小细胞肺癌19例,甲状腺乳头状癌2例,副神经节瘤1例。
在4周的周期内口服BLU-667,剂量范围从30毫克至400毫克,每天服用30毫克至400毫克。
实验结果:
BLU-667表现出广泛的抗肿瘤活性,对于接受剂量≥60mg且具有至少1次基线后应答评估的RET改变患者,总体反应率(ORR)最高为37%(95%CI,20%-56%) (n = 30)。特别是非小细胞肺癌和MTC患者的ORR分别为50%和40%。在具有RET融合和突变的患者中,ORR为45%。
40例可评估患者中,1例完全缓解,17例部分缓解,20例病情稳定,2例进展。
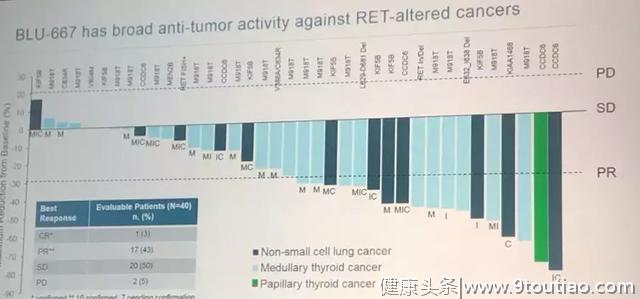
Subbiah教授也是靶向治疗临床中心的副主任医师,他指出这些结果令人鼓舞,因为无论肿瘤类型如何,都可以看到广泛的抗肿瘤活性。
I期临床试验的剂量递增部分是开放式的,并在全球招募。(NCT03037385)
“总体而言,数据显示,使用下一代激酶抑制剂的精确靶向治疗可以对RET导致癌症的患者产生强大的影响,”Subbiah说。“通过为这种致癌驱动器提供高度选择性药物,我们希望这种新疗法能够使患者受益于最近在基因组谱分析方面取得的进展,这些改进已经为激酶驱动的疾病患者的治疗方案带来了革命性变化!”
临床案例
1
72岁的汤姆卡特伊曾是空军飞行员。几十年来,他一直担任林务员,负责监督林地的地块。在他退休前的几年,一名护士在喉咙里发现了一个肿块。原来是甲状腺髓样癌(MTC),这是一种罕见且不可治愈的癌症。
化疗失败了的Cathey。他的医生将他送到MD安德森癌症中心,在那里他们有更多的MTC经验。他进入了包括免疫疗法Yervoy在内的临床试验。它只起效六个月,他的脖子和肝脏的肿瘤就又开始增长。
幸运的是,他进行了基因检测,RET阳性,他的医生建议他进入实验药物BLU-667的一期临床试验,BLU-667旨在比现有药物如Cometriq和Caprelsa更好地靶向该基因。
结果:他最大的肿瘤从6厘米缩小到了2厘米!他喜欢骑着自行车,从皮划艇上钓斑鳟,红鱼和近海鱼。
2
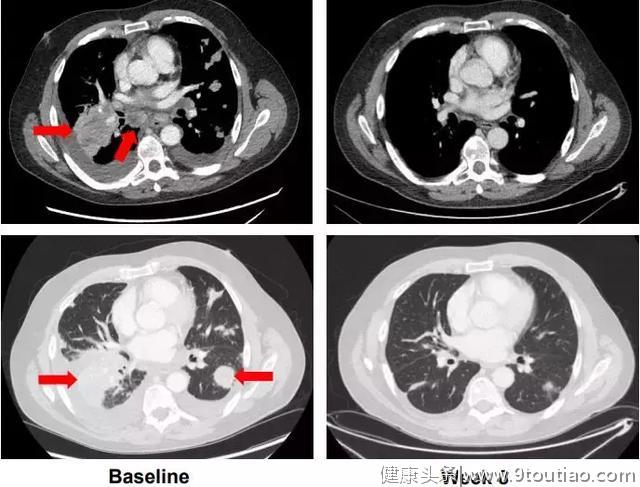
一位转移性NSCLC患者在接受治疗后“首次评估时脑部响应”。
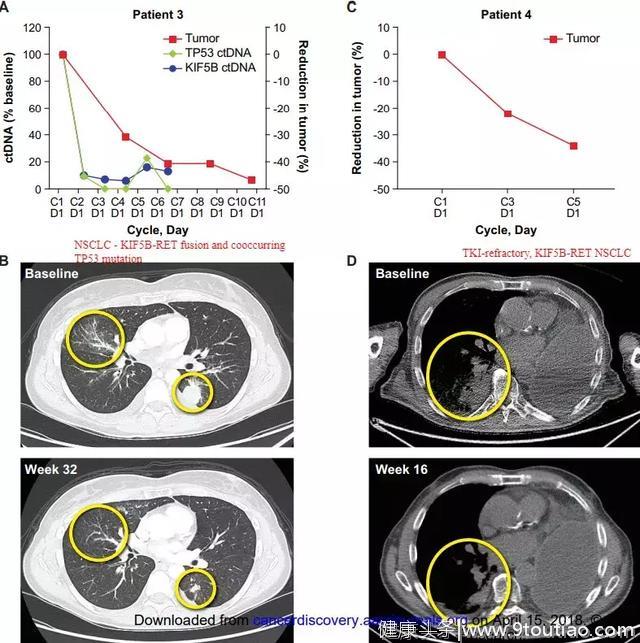
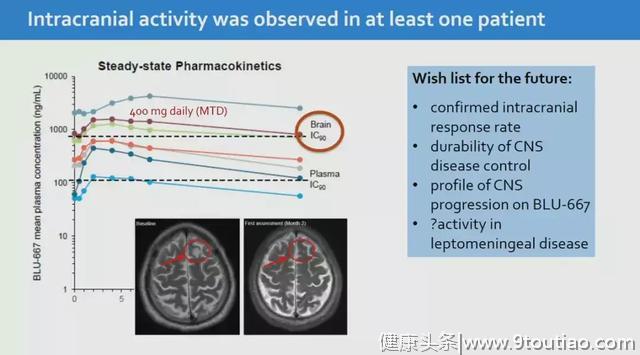
除BLU-667外,目前处于I期评估的另一种选择性RET抑制剂是LOXO-292(Loxo Oncology)耐受性也很好。希望这款新药尽快取得更多的临床试验数据,早日上市,造福患者!
参考资料:
https://www.marketwatch.com/press-release/loxo-oncology-announces-receipt-of-breakthrough-therapy-designation-from-us-food-and-drug-administration-for-loxo-292-2018-09-05
https://www.onclive.com/conference-coverage/asco-2018/loxo-292-shows-impressive-response-rates-for-ret-positive-tumors
https://www.loxooncology.com/docs/presentations/2017_LOXO292_IASLC_Presentation.PDF
"