癌症是怎么来的?解密这背后基因组的深层奥秘
众所周知,癌症是一种基因性疾病。正常细胞逐步变成癌细胞,归根结底是由于基因的改变,也就是常说的基因突变。
基因突变是在细胞DNA复制过程中出现的错误。正常来说,这种情况的发生其实概率很低,因为我们身体内部存在着非常精密的免疫系统。然而,有两种情况会促使DNA复制过程中错误的巨幅增加。洋葱会在下文中详细展开。
因此,全面发现癌症基因组发生了什么变化,正确解读这些变化展示的信息,对于指导人们开发出更加有效的降低癌症发生率和死亡率的方法至关重要。
十年前,通过基因测序来识别癌症基因组的变化,似乎是科幻小说中才有的情节。然而,经过十多年的飞速发展,这一切成为了现实。
半分钟读全文
吸烟人群的肺癌体细胞突变数量是非吸烟人群的10倍。
大多数人类癌症是由在20至30年内发展的2至8次连续“驱动“突变引起的。
驱动突变基因在细胞命运、细胞生存和基因组维持中具有重要作用。
了解肿瘤的遗传异质性,对于癌症的诊断和治疗有着重要影响。
对于癌症基因组的研究有助于预防和早期发现癌症,这对降低癌症发病率和死亡率至关重要。
人类癌症中到底有多少基因突变发生?
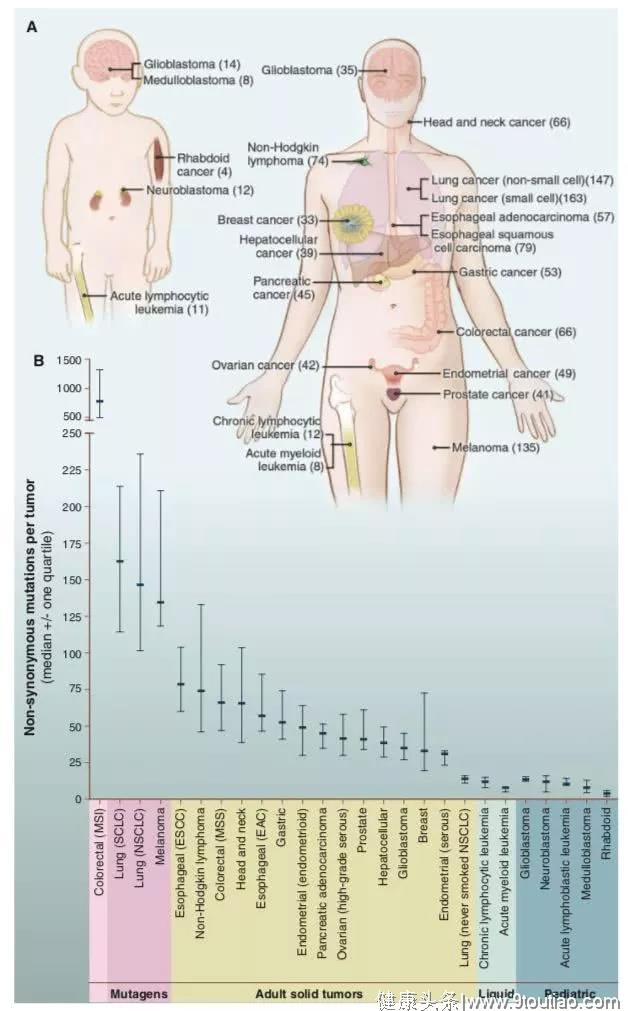
在来自结肠、乳腺、脑或胰腺等常见的实体肿瘤中,平均33至66个基因存在体细胞突变。
这些突变中约95%是单碱基替代(例如C>G),其余的是缺失和插入(例如CTT>CT)。而在碱基替代中,90.7%为错义变化,7.6%为无义变化,1.7%为剪接位点或非翻译区域变化。
也就是说,这些基因突变的大部分都会影响其蛋白质产物,进一步导致功能的变化。
我们都知道,肿瘤细胞的最基本特征就是持续增殖能力。与正常细胞相比,肿瘤细胞会对生长促进信号的解除进行控制,而这就是与生长因子受体信号相关的体细胞突变在“从中作祟”。
值得注意的是,在黑色素瘤和肺部肿瘤中,每个肿瘤含有大约200个非同义突变,这反映了紫外线和烟草烟雾这两种强效诱变剂参与到了这些肿瘤类型的发病机制中。
更重要的是,吸烟人群的肺癌体细胞突变数量是非吸烟人群的10倍。
这些体细胞突变都在什么时候发生?
现在就来回答文章开始出现的那个问题,虽然细胞在复制过程中想要出错很难,但哪两种情况会促使细胞复制过程中错误的巨幅增加?
这些错误本身就潜伏在我们的每个细胞中,遗传于父母的生殖细胞,只不过还没有日积月累达到一定的程度。这样引起的癌症基因变化叫做种系突变。
这些错误是衰老和环境因素的自然结果,如生活习惯(吸烟、酗酒),微生物感染(HPV、HBV、幽门螺旋杆菌)以及辐射等。这样引起的癌症基因变化叫做体细胞突变。
在以上两种因素的单独或共同刺激下,随着时间的推移,肿瘤细胞获得一系列突变,从而导致良性病变进入恶性病变。这一过程在结直肠肿瘤中得到了较好的研究。
第一个或“守门”突变为正常的上皮细胞提供了选择性生长优势,最常发生在APC基因中,由这种突变引起的小腺瘤生长缓慢。而发生在另一个基因中的第二个突变,如KRAS基因,则允许细胞数量扩大。这种突变的过程会随着克隆扩增继续发生,PIK3CA, SMAD4和TP53等基因的突变,最终导致恶性肿瘤的发生,通过基底膜侵入并转移到淋巴结和远处器官。
在这一过程中,“驱动”突变赋予肿瘤细胞选择性生长优势。但其实,每个驱动突变只能带来很小的生长优势,细胞出生和死亡之间的差异增加0.4%。然而,年复一年,周而复始,就导致了巨大肿块的发生。
可以说,大多数人类癌症是由在20至30年内发展的2至8次连续“驱动“突变引起的。这些突变中的每一个都直接或间接地增加了细胞出生与死亡的比例,对细胞产生选择性生长优势。
而对于种系突变,通常并不会增加选择性生长优势,而是以增加遗传不稳定性等间接方式刺激肿瘤的发生。
有多少驱动突变基因存在?
迄今为止,通过对3284个肿瘤中的20000个蛋白质编码基因进行全基因组测序,目前发现了125个驱动突变基因。其中,71个是抑癌基因,54个是原癌基因。
原癌基因和抑癌基因在细胞生长、增殖调控和凋亡中起到重要作用。
在正常情况下,原癌基因和抑癌基因彼此维持着平衡。但在致癌因素的作用下,原癌基因可被异常激活,诱导细胞发生癌变;而抑癌基因则受到抑制,导致癌细胞增殖、发展成为疾病。
当然,表观遗传驱动基因也可能导致选择性生长优势,但对于这些基因的确定一直具有挑战性。
事实上,突变频率较高的驱动突变基因数量已经接近饱和。未来仍会有新的驱动突变基因被不断发现,但这些很可能会出现在尚未深入研究的罕见肿瘤中。
驱动突变基因有什么重要作用?
所有目前已知的驱动突变基因在12个信号通路的一个或多个中起到重要作用。
关于这些通路的发现是生物医学研究的最大成就之一,并可以进一步组织成三个核心细胞过程:细胞命运、细胞生存和基因组维持。
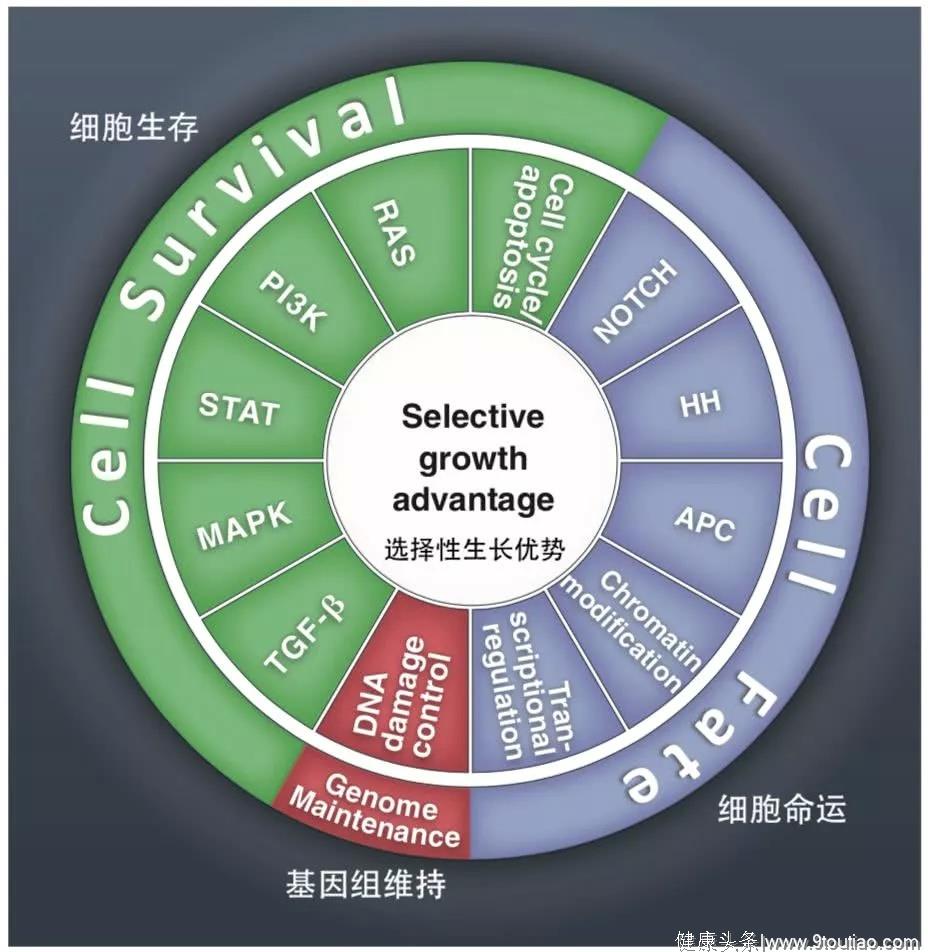
更好地了解这些途径是基础癌症研究中最迫切的需求之一。
细胞命运
分裂还是分化?这就是细胞的命运。
癌症中的许多遗传变异都致力于消除分化和分裂之间的精确平衡,有利于后者的发生。这导致了选择性生长优势,因为分化细胞最终会死亡或静止。
APC, HH和NOTCH在这一过程中发挥着重要功能,控制着从蠕虫到哺乳动物等生物体的细胞命运。
细胞分裂是指细胞增殖的过程,细胞数量由一个分裂成为两个。
细胞分化是指细胞类型变化的过程,从一种类型转变为另一种类型。
细胞生存
在营养物浓度被限制的情况下,
肿瘤细胞将如何存活?
肿瘤细胞中的EGFR, HER2, FGFR2, PDGFR, TGFbR2, MET, KIT, RAS, RAF, PIK3CA和PTEN基因突变,一些负责编码生长因子受体,一些负责将信号从生长因子传递到细胞内部,在激活状态下刺激细胞生长,从而允许肿瘤细胞在限制营养物浓度的情况下进行繁殖。
也就是说,即使营养物不够,肿瘤细胞也能通过竞争获得生存优势。
当然,还有一些基因可以直接调节细胞周期或凋亡的驱动基因。
基因组维持
DNA复制或分裂发生错误时,
肿瘤细胞该怎么办?
细胞会在DNA复制或分裂时发生错误,正常情况下,检查点会使细胞的生长速度变慢或自我凋亡。
但是,肿瘤细胞中的TP53和ATM基因突变,可以使这些检查点失去功能。肿瘤细胞在损伤中也能够存活,具有选择性生长优势。
什么是遗传异质性?
如果把肿瘤比喻成雪花,世界上没有两片雪花是相同的,也没有两个肿瘤是相同的。了解肿瘤的遗传异质性,对于癌症的诊断和治疗有着重要影响。
1. 肿瘤细胞内的异质性。
同一肿瘤内的肿瘤细胞也可能出现微小甚至显著的不同。
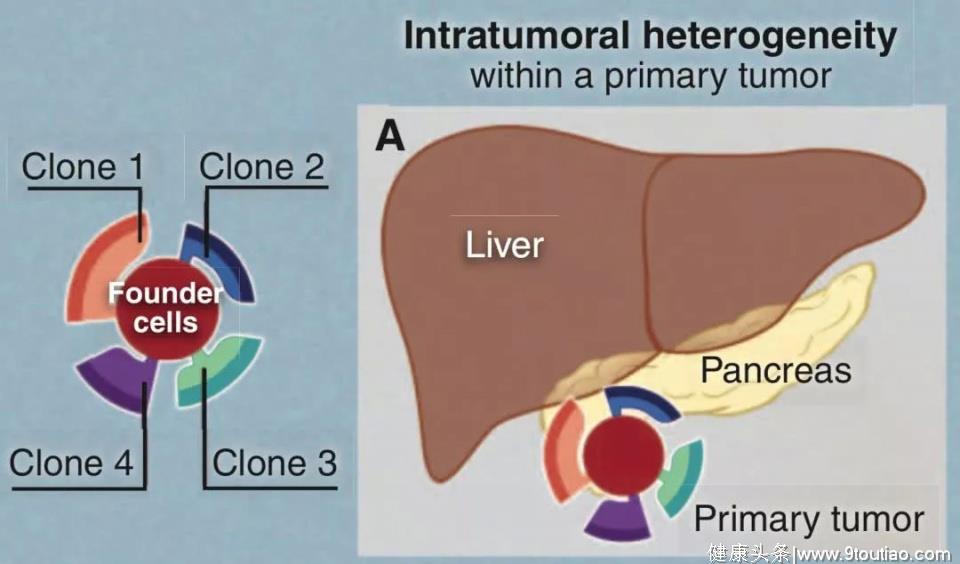
图示一个原发肿瘤病灶中有四种不同的克隆组成。
2. 同一患者不同转移性肿瘤病灶之间的异质性。
大多数情况下,癌症患者的每一个转移性病灶都是由非常不同的细胞组成,化疗几乎不可能实现治愈。
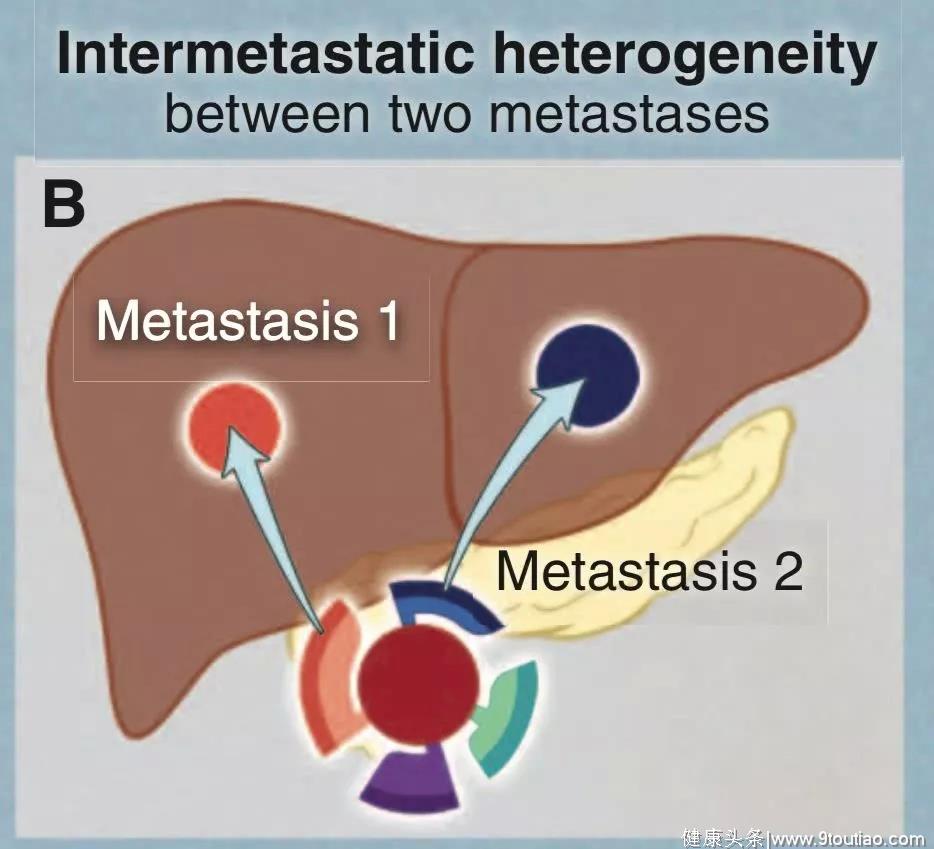
3. 个体转移性肿瘤细胞之间的异质性。
计算表明,医学成像中可见尺寸的任何转移性病灶都有数千个细胞,几乎可以抵抗任何药物。因此,复发只是时间问题,完全可以根据已知的突变频率和肿瘤细胞生长速率来预测。
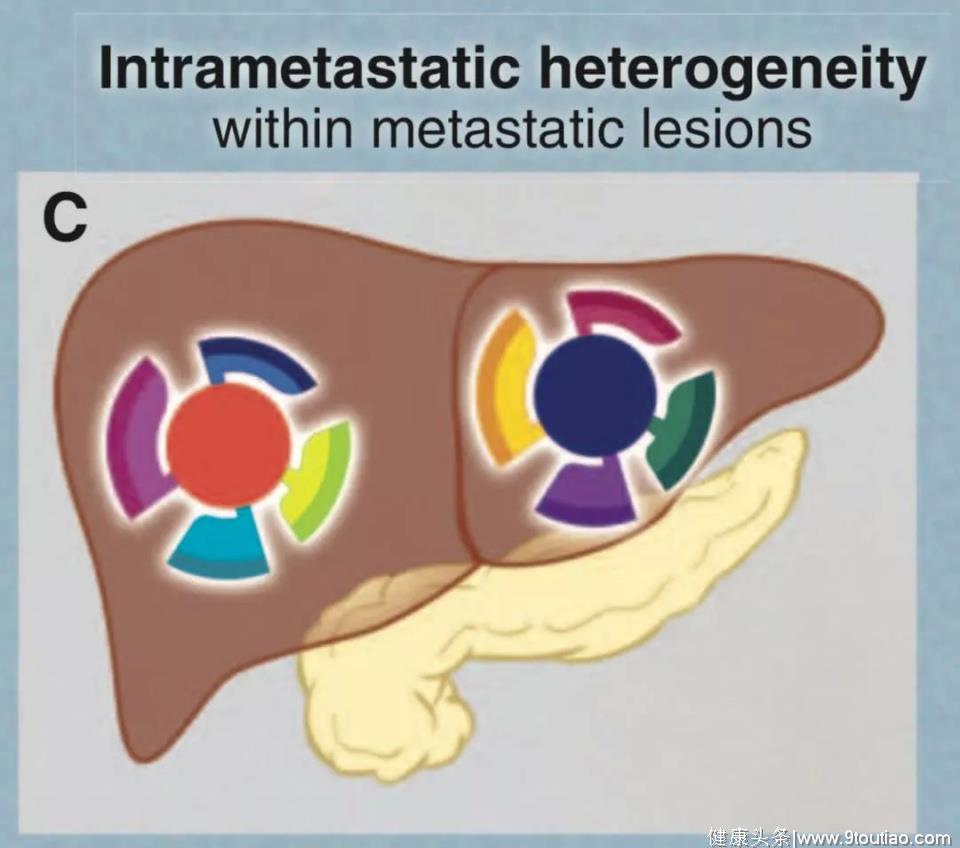
4. 不同患者的肿瘤之间的异质性。
没有两个癌症患者的肿瘤是完全相同的。这种患者间的异质性大部分可能与肿瘤内的体细胞突变有关。致力于癌症患者的个性化治疗主要基于对这种异质性的认识。

写在最后
基于癌症基因组测序的飞速发展,人们已经对癌症基因组信息有了较为全面的认识,对癌症患者的临床诊断和治疗产生了深刻影响。毕竟“知此知彼,百战不殆”。
此外,对于癌症基因组的研究有助于预防和早期发现癌症,这对降低癌症发病率和死亡率至关重要。
参考文献
[1]Vogelstein B, Papadopoulos N, Velculescu V E, et al. Cancer genome landscapes[J]. science, 2013, 339(6127): 1546-1558.