2017年癌症治疗热点回眸 :免疫治疗现重要突破,靶向药物创历史进展
摘要
癌症治疗在2017年迎来了一系列新的希望,其中最为重要的是CAR-T治疗的正式登场,两种靶向CD19 的CAR-T细胞获得对复发性/难治性B细胞急性淋巴细胞白血病以及大B细胞淋巴癌治疗的批准。同时,免疫检查点抑制剂也获得更多实体瘤适应症的批准,尤其是将MSI-H或dMMR作为生物标志物,作为临床治疗的指导。在靶向治疗方面,一些新的药物获得批准,比如FLT3突变抑制剂Midostaurin与化疗的联合使用,是25年来FDA首次批准的AML新药。此外,在临床研究中也出现一些比较激动人心的结果,癌症疫苗在黑色素瘤的治疗中获得了突破。本文将对这些热点研究结果进行回顾性综述。
随着人口老龄化到来,癌症病例越来越多,但由于医疗技术的创新,癌症的死亡率出现了下降的趋势。在美国,从1991年到2014年,癌症的总体死亡率下降了25%。同一时期,由于戒烟等生活方式以及对某些癌症筛查指南的改变,癌症的年龄标化发病率也有所下降,尤其是在男性中,但晚期癌症的发病率基本保持稳定,因此,死亡率的下降应该主要归功于医疗技术的进步。
2017年中,癌症治疗的研究取得了很多值得回眸的进展,这些进展主要集中在癌症免疫治疗领域,包括CAR-T治疗的正式批准,PD-1/PD-L1抗体治疗对更多适应症的批准,以及针对肿瘤新抗原的癌症疫苗研究在临床试验中振奋人心的结果。此外,靶向药物的研究也取得了值得庆贺的成绩,不但有新的靶向药物得到批准,也有之前批准的药物在更多的适应症中显示出很好的治疗效果。
嵌合抗原受体T 细胞免疫治疗:血液系统癌症的新希望
2017年,必定是癌症治疗历史上值得纪念的1年。在2017年,美国FDA分别批准了诺华公司和凯特制药公司的2种嵌合抗原受体T细胞免疫治疗(chimeric antigen receptorT-cell immunotherapy,CAR-T)产品上市,这意味着CAR-T细胞治疗的新时代的正式开始。CAR-T属于免疫治疗,最早尝试用于艾滋病的治疗,但效果并不明显。宾夕法尼亚大学医学院的Carl June 教授,在其妻子因癌症去世后,把研究重点转移到癌症治疗,终于将CAR-T技术推进成一个成熟的治疗技术。
在人体内,有很多免疫T细胞,但是大多数T细胞都不能很好地识别肿瘤细胞。CAR-T技术首先从癌症患者身上分离免疫T细胞,然后利用基因工程技术给T细胞安置一个嵌合抗原受体,这个受体对肿瘤细胞有很高的亲和力,而且在与癌细胞结合后能够激活T细胞,引发T细胞杀死肿瘤细胞的功能。这些基因改造过的细胞就叫CAR-T细胞,经过体外培养并大量扩增之后,再把大量的CAR-T细胞(约几十亿)输回给患者,让它们在患者体内清除癌细胞(图1)。
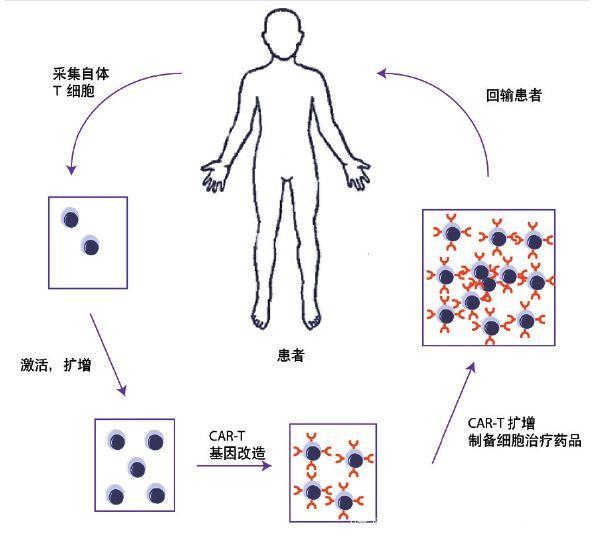
图1 CAR-T治疗制备过程
CAR-T技术最先在白血病的治疗中取得突破。最先接受CAR-T临床试验的30位白血病患者,27例发生了完全缓解,比例高达90%,这在癌症的治疗历史上是前所未有的。这些白血病患者之前一般都接受了各种治疗,包括化疗、靶向治疗,其中15位患者甚至进行了骨髓移植,但不幸是治疗都失败了。在这些病人中,一个名为Emily Whitehead 的患者,当时只有7 岁,经CAR-T治疗后到目前已有5年,在其体内已经检测不到癌细胞,达到了治愈的标准。
第一种CAR-T的靶点是CD19,是B细胞上的一个最常见的受体。这个由Carl June 实验室建立的CAR-T,在二期临床实验中保持不凡的疗效,在对63例复发性或难治性B细胞急性淋巴细胞白血病治疗6个月后,完全缓解率达到了83%,该技术因此获得了美国食品药品监督管理局(FDA)的批准。第二种被批准的CAR-T,也是针对CD19,但是适应证是耐药或复发性大B细胞淋巴癌。
CAR-T虽然治疗效果好,但也有风险,最常见的临床风险事件包括细胞因子风暴和神经系统毒性,其中以细胞因子风暴更为常见。T细胞在杀死癌细胞时,会释放很多促进细胞炎症的细胞因子,这属于免疫应答的正常机制,因为这样可以激活更多的免疫细胞来一起对抗异物,达到对病原体的快速清除。但是,由于大量细胞因子的突然产生,对机体的细胞也是一场“风暴”,在临床上会导致患者高烧不退,若不及时使用激素和抗IL-6受体的抗体进行治疗,患者就会有性命危险。
目前CAR-T的突破主要是血液系统的癌症,对实体瘤还有巨大的技术壁垒,没有展示出有效的治疗效果。CAR-T治疗价格昂贵,也是医保系统和病人要面对的问题。第一种CAR-T,仅细胞药物的价格就接近50万美元,如果把住院费用考虑进去,整个治疗的花费将超过100万美元。CAR-T成本高昂的主要原因是要从患者体内提取T 细胞进行制备,现在已经有异体CAR-T技术在临床试验,包括使用CRISPR 基因编辑T细胞的技术,如果异体CAR-T治疗能够通过临床验证,改造的CAR-T细胞就可以大规模化生产,也许可以降低CAR-T的成本。
2017 年在芝加哥举办的美国临床肿瘤学会(ASCO)年会上,中国的南京传奇生物科技有限公司(Nanjing Legend Biotech)也公布了一个惊喜的结果:在一项难治性或复发性的多发性骨髓瘤临床试验中,共有35名患者接受了CAR-T 疗法,客观缓解率(ORR)为100%,其中19名患者中位随访时间为6个月,18名患者病情完全缓解,1名患者部分缓解。南京传奇生物CAR-T的靶点是BCMA(CD269),该靶点也是美国蓝鸟生物技术公司(Bluebird)CAR-T治疗的靶点,他们的工作也同样有可喜的结果:对于15名发性骨髓瘤患者,27%的患者出现了完全缓解,47%的患者出现了非常好的部分缓解,其余的患者为部分缓解。中国国家食品药品监督管理总局(CFDA)规定CAR-T治疗可以作为I类新药进行审批,由于BCMA CAR-T目前的不凡表现,南京传奇生物科技有限公司成为中国第一家正式递交CAR-T临床试验申请的公司。
PD-1 /PD-L1 抗体治疗:从黑色素瘤到各种肿瘤
PD-1(programmed death 1)和它的天然配体PD-L1是一组重要的免疫调节的蛋白分子。PD-L1免疫T细胞表面的PD-1结合,可以传递抑制性的信号,减少T细胞增生,因此PD-1/PD-L1就称为免疫检查点,而它们的抗体则属于免疫检查点抑制剂。如今已经有5种PD-1或者PD-L1的抗体被FDA批准,用来治疗多种癌症(表1)。除此之外,还有超过160 个PD-1或者PD-L1的抗体在进行临床或临床前研究,截止于2017年9月,有1105个PD-1/PD-L1抗体与化疗等的联合用药在进行临床试验。
表1 目前在美国获批准的PD-1/PD-L1抗体及适应证

并非所有的病人都能获益于PD-1/PD-L1抗体治疗。通常,可以通过生物标志物来选择敏感人群,但是PD-1/PD-L1抗体治疗的生物标志物并不好找。
在治疗黑色素瘤的时候,不需要任何生物标志物来筛选有效病人,从PD-1 抗体的治疗效果就能看出来。与化疗相比较,转移性黑色素瘤患者在使用免疫检查点抑制剂治疗一年后,总生存率从38.8%提高到了51.2%。但是,通过回顾分析治疗过的病例发现,肿瘤细胞表达PD-L1的患者比没有表达这个蛋白的患者更能从PD-1抗体的治疗获益。现在的理论认为,肿瘤细胞就是因为表达PD-L1,才麻醉了免疫系统,让癌细胞逃逸免疫监控。
对于非小细胞肺癌,一开始,Opdivo批准的适应症是已经接受过铂类化疗、却又发生疾病进展的转移性患者。这属于二线治疗,也不需要任何生物标志物来筛选病人,虽然不是对所有患者都有效,但治疗效果也非常明显。后来在推进一线治疗的临床试验里,Opdivo还是选择无需生物标志物的粗犷型风格,导致临床试验结果不尽如人意,总体治疗效果差于化疗。与此相反,Keytruda就比较谨慎,选择了PD-L1阳性的患者,虽然商业市场缩小,但是治疗效果明显,反而弯道超车,抢先成为非小细胞肺癌的一线治疗方案。
但是PD-L1也不是一个完全理想的生物标志物。研究发现,癌细胞里DNA修复机制常常会发生缺陷,这种情况的生物标志物是错配修复缺陷(dMMR)和微卫星高度不稳定性(MSI-H)。DNA修复机制有缺陷的癌细胞更容易产生新抗原(neoantigen),而这些新抗原有可能导致免疫系统对癌细胞的识别,这时候如果配合使用免疫检查点抑制剂,就会达到很好的治疗效果。dMMR的检测方法是免疫组化,用于检测MMR相关蛋白表达,包含MLH1、PMS2、MSH2和MSH6,如果4个蛋白都表达了属于正常,但是如果缺失某种蛋白的表达就会导致错配修复缺陷(dMMR)。检测MSI的技术是PCR,通过检测5个预设的微卫星位点来判断是否存在微卫星不稳定,如果大于等于2个发生改变则判读为MSI-H。临床试验的结果也验证如此,所以Opdivo批准治疗结直肠癌时就要求应有dMMR/MSI-H的患者。
2017年5月,对于接受过化疗,但是治疗无效或疾病发生进展的实体瘤,只要这些肿瘤属于MSI-H 或dMMR,FDA加速批准了这类患者可以使用Keytruda进行治疗。这意味着,癌症治疗的适应症已经不受原发灶是何种组织的限制了,只要有生物标志物,就可以使用Keytruda。这在FDA 的审批历史上是前所未有的。FDA这一批准是基于149名实体瘤患者的临床数据,所有的患者在入组前都有过化疗,但依然出现疾病进展。这些患者入组于5个单臂临床试验,90个患者是结直肠癌,其余59名患者分别为14种其他实体瘤。接受Keytruda治疗后,客观缓解率为39.6%,包括11个完全缓解的患者和48个部分缓解的患者,有效患者中平均应答时间为6个月以上。当然,FDA的这项批准属于加速审批,之后会有进一步的数据出来,确认MSI-H/dMMR这种生物标志物在不同种实体瘤里的效果是否会有区别。
2017年11月,FDA批准了Foundation One 公司的CDx 伴随诊断,这个基于二代测序的可以检查出MSI 和肿瘤突变负荷(TMB),而TMB 也可以用来预测PD-1/PD-L1抗体治疗是否有效。
虽然PD-1/PD-L1的临床适应症在不断扩大,也有一些研究指出这些免疫检查点抑制剂并非神药,比如在动物模型里发现对T细胞非霍奇金淋巴癌(T-NHL)不但没有疗效,反而有恶化的作用。同时,临床治疗中,发现有大约1%的患者在接受PD-1/PD-L1抗体治疗后出现I型糖尿病。
癌症疫苗:免疫治疗时代的新希望
2017年7月,在同一期《Nature》杂志上,美国和德国的2个团队分别发表论文,报道了针对黑色素瘤的“个性化疫苗”临床试验。2个试验的制备疫苗的方法不同,但都取得重大突破。
在德国的临床试验中,治疗的13个中晚期黑色素瘤病人都是高复发的病人,在接种疫苗之前病情反复,复发以后都要接受手术切除癌变组织。在接种疫苗之后,病情复发率就大大降低了,其中8个病人在接种后1~2年的观察期内都没有复发,另外5个病人在接种疫苗时或接种之后很快就发现病情有复发,但是其中2个病人对疫苗也产生应答,病情出现好转;所有病人中只有2例在观察期内死亡。在美国的临床试验中,共有6个病人,其中4个癌症中期的病人接种疫苗后一直没发生什么问题,而2个晚期有转移的病人在接种疫苗后发生复发,但在使用PD-1抗体免疫疗法后,肿瘤也再次消失。
为什么以往的癌症疫苗临床试验效果都不好,但这次却轰动了学术界?关键点在于,这两项研究中,都采用“肿瘤新抗原”(tumor neoantigen)来制备疫苗。
肿瘤新抗原,指的是癌症细胞在增殖过程中,由于基因突变而产生的与正常细胞不一样的蛋白编码,这些突变可以成为新的抗原,可以更好地被免疫T细胞识别。以往的癌症疫苗研究,通常采用癌细胞表面比较丰富的抗原,虽然也是使用MHC-class I 或者MHC-class II肽段作为抗原,但很难诱导产生有效的对癌细胞有杀伤能力的T细胞。目前对这一现象解释是,这些表达量比较高的肿瘤表面抗原,也比较容易诱导产生调节性T细胞(Treg),甚至能通过诱导外周CD4+CD25-T细胞转变成为Foxp3+的Treg,从而抑制对癌细胞有杀伤性的T细胞。
相比之下,由于基因突变而产生的肿瘤新抗原,能够更有效地诱导产生杀伤性的T细胞。正因如此,基因突变率较高的黑色素瘤等癌症(图2),有更活跃的免疫环境,更容易显示出免疫检查点抑制剂的治疗效果;同样,有dMMR/MSI-H 实体瘤患者,同样会有更多的基因体突变比例,所以PD-1抗体的治疗也就有了更好的效果。

图2 不同肿瘤组织中基因突变的发生率
如今这两个肿瘤疫苗的试验,都选用黑色素瘤患者作为样本,也正是因为这类肿瘤的体突变率比较高。正如Kathreine Wu所说,现今在癌症疫苗领域取得突破有3个重要因素:1)如今的DNA测序技术可以很快地找出患者肿瘤组织里的个性化突变;2)对于肿瘤新抗原所积累的知识和数据库,可以推算出最有效的新抗原肽序列,用来制造疫苗;3)有临床效果很好的PD-1/PD-L1抗体,一旦癌症疫苗诱导产生特异性免疫T细胞,PD-1/PD-L1抗体可以用来增强这些针对癌细胞的免疫反应。
尽管目前肿瘤新抗原让癌症疫苗的研究取得了突破,该领域还是有许多技术问题需要突破。例如疫苗制备的周期问题,首先要给病人的癌细胞进行基因测序,才知道肿瘤新抗原的类型,然后无论是制备肽还是RNA作为疫苗,都需要一定的时间。以目前的技术条件,病人至少要等3个月才能使用个性化的疫苗。对于一些病人来说,3个月可能就把病情耽误了。
此外,对肿瘤新抗原的甄别和筛选也需要提高。在这两个临床试验里,筛选出来的肿瘤新抗原序列,只有大约60%能够真正激活免疫细胞,需要给每个病人同时使用10个抗原才能看到效果。今后如果筛选程序能够进一步优化,也许能筛选出更强大的癌症疫苗,甚至可以用来对付突变率不高的“冷免疫”肿瘤。
靶向治疗研究进展
最近2年的肿瘤治疗领域,免疫治疗是重头戏,但靶向治疗的一些进展将改写目前的临床治疗标准,此外,一些靶向治疗的药物在早期的临床试验里也展现出了令人惊喜的结果。
泰瑞沙(Tagrisso):通吃一代到三代EGFR 靶向突变
在2017 欧洲肿瘤内科学会年会(ESMO),一项FLAURA三期临床试验的结果引起了关注。这是EGFR靶向药物泰瑞沙在非小细胞肺癌进行一线治疗的试验,泰瑞沙治疗组中位无进展生存期达到18.9 个月,而一代EGFR靶向药物组(易瑞沙、特罗凯)只有10.2个月。跟目前的治疗标准一代靶向药相比,泰瑞沙降低了50%以上的疾病进展或死亡。
不但效果好,泰瑞沙的安全性也更高。使用一代EGFR抑制剂的有44.8%的人曾出现≥3级的不良反应,18.1%因此中止治疗;相比之下,使用泰瑞沙的患者只有33.7%曾出现≥3级的不良反应,有13.3%中止治疗。EGFR靶向药的副作用,主要是腹泻及皮肤不良反应。一代药的皮肤不良反映是皮疹,而泰瑞沙这方面的副作用已经减弱变为皮肤干燥,同时泰瑞沙对肝的副作用也有所减少。
这项研究表明,泰瑞沙有望成为非小细胞肺癌一线治疗的新标准,治疗目前所有可以靶向治疗的EGFR突变。目前,泰瑞沙已经获得FDA审批的突破性治疗通行证,等待获得批准作为有EGFR突变的非小细胞肺癌的一线治疗,也在等待在欧洲和日本的批准。与此同时,美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)也更改了非小细胞肺癌的治疗指南,建议使用泰瑞沙作为目前EGFR突变的一线治疗。
Midostaurin:FLT3 抑制剂
类FMS酪氨酸激酶受体3(FLT3)是一个急性骨髓性白血病(AML)中最常见的突变基因,25%~30%的新发AML 患者有FLT3内部串联重复(FLT3-ITD),另外有5%~10%的患者在酪氨酸激酶结构域(TKD)中具有点突变。2017年,美国FDA批准了Midostaurin与化疗联合使用,用于FLT3突变阳性AML成年患者的一线治疗。这是25年来FDA首次批准的AML新药。
复发一直是AML治疗中存在的重要问题,在总生存(overall survival,OS)的获益才能真正说明一个药物的有效性。在一期临床试验中,Midostaurin联合cytarabine在≤60岁的新诊AML患者中取得了92%完全缓解率。在导致FDA批准的决定性临床试验中,与单独使用常规化疗相比,合用Midostaurin显著改善了OS(HR0.77,p=0.016),把中位数OS从25.6个月提高到了74.7个月,治疗4年后的OS从44.3%提高到了51.4%。Midostaurin是多个激酶的抑制剂,除了FLT3之外,还抑制PKC、c-Kit、c-Src等。另外一个特异性比较高的FLT3抑制剂Quizartinib,现也在进行三期临试验,希望在有效性和安全性方面可以比Midostaurin有所提高。
BTK 和IDH2 抑制剂
2017 年,FDA 还批准了其他几个靶向药物,包括BTK(Bruton酪氨酸激酶)抑制剂acalabrutinib 和IDH2(异柠檬酸脱氢酶)抑制剂Enasidenib。Acalabrutinib用于二线治疗套细胞淋巴瘤(mantle cell lymphoma,MCL)成年患者,在临床试验中,客观缓解率(objective response rate,ORR)达到81%,其中完全缓解率(complete response,CR)达40%。Acalabrutinib是第二代BTK 抑制剂,比第一代抑制剂ibrutinib活性和选择性更好。
Enasidenib用于IDH2基因突变的AML治疗,在复发性或难治性AML 患者的单臂试验中,经Enasidenib治疗后,ORR 为40.3%,中值应答时间为5.8 个月;19.3%的患者在治疗后完全缓解,中值总生存期为19.7个月。IDH2是一个依赖NADP+的异柠檬酸脱氢酶,存在于线粒体上,有IDH2突变的患者仅占全部AML的8%~19%,但是由于IDH2突变体在癌细胞的柠檬酸循环产生能量的过程中有重要作用,所以Enasidenib也是第一个上市的肿瘤能量代谢抑制剂。
结 论
2017年是癌症治疗历史上重要的一年,除了CAR-T治疗的正式登场,在其他的免疫治疗、靶向治疗领域都取得了很好的进展。期待在新的一年里有更多的癌症治疗方式来给患者带来利益。
文 /张洪涛,宾夕法尼亚大学医学院病理及实验医学,研究副教授,研究方向为癌症靶向治疗、免疫治疗。
《科技导报》
中国科协学术会刊
联系电话:010-62194182
欢迎投稿:[email protected]