“骨”舞人心 ,类风湿关节炎患者的骨保护有了新方案!

类风湿关节炎(RA)是以关节破坏为主要不良结局的慢性自身免疫性疾病,软骨及骨破坏在其疾病发生发展中占有重要地位,严重影响了患者功能结局和疾病预后[1],对患者生活和工作造成了极大不便。此前,北京大学人民医院栗占国教授等人进行了一项流行病学研究[2],结果显示我国35.2%的RA患者出现工作能力障碍,其中病退者占8.0%,减少工作量者占24.8%,更换工作者占2.4%。因此,关注和重视RA患者关节影像学进展至关重要。
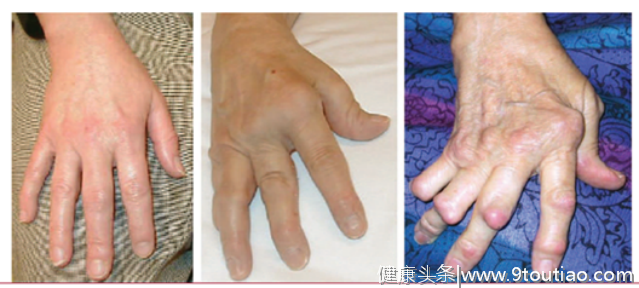 图1:RA患者手部关节破坏及进展[3]在RA中,软骨及骨破坏是如何形成的?如何减缓或阻断这一过程以防止关节畸形甚至残疾?今天,我们就此话题展开讨论,快打开小本本记笔记啦~
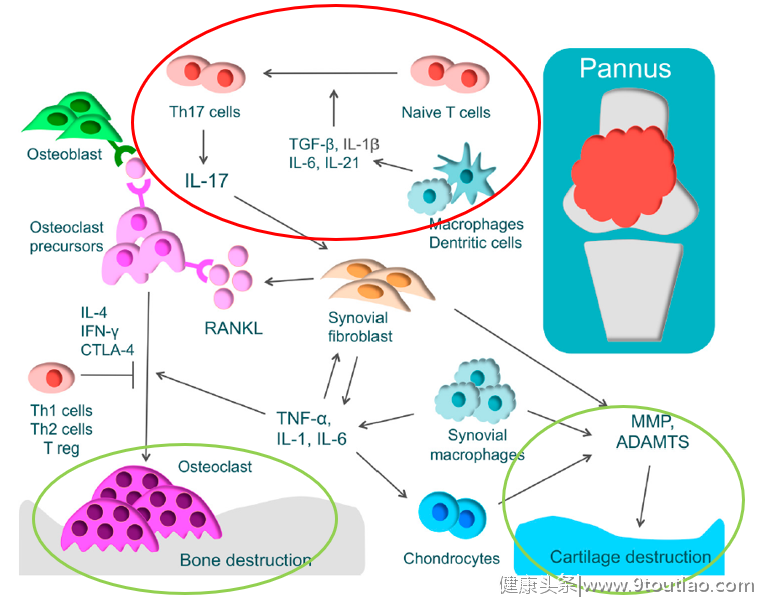
图1:RA患者手部关节破坏及进展[3]在RA中,软骨及骨破坏是如何形成的?如何减缓或阻断这一过程以防止关节畸形甚至残疾?今天,我们就此话题展开讨论,快打开小本本记笔记啦~健康状态下,正常骨组织处于骨吸收和骨形成的动态平衡中,但破骨细胞过度活化和成骨细胞功能被抑制时将打破此平衡。目前的研究认为,软骨及骨破坏包括以下核心机制(图2)[4]:
1
过度的T细胞免疫反应
原始T细胞在白介素(IL)-1β、IL-6、IL-21和转化生成因子(TGF)β作用下分化为Th17细胞,Th17细胞产生并释放IL-17,作用于各种免疫细胞、激活炎症,通过诱导核因子-κB受体活化因子配体(RANKL)激活破骨细胞;
多种炎症因子的活化
肿瘤坏死因子(TNF)-α、IL-1、IL-6和IL-17等细胞因子诱导滑膜成纤维细胞或成骨细胞膜上RANKL过表达,继而激活破骨细胞活化的胞内信号蛋白,如核因子κB(NF-κB)、丝裂原活化蛋白激酶(MAPKs)等;
3
软骨破坏
软骨破坏由软骨细胞、滑膜成纤维细胞和滑膜巨噬细胞产生金属蛋白酶(MMP)和含凝血酶敏感蛋白基序的解聚蛋白样金属蛋白酶(ADAMTS)引起。
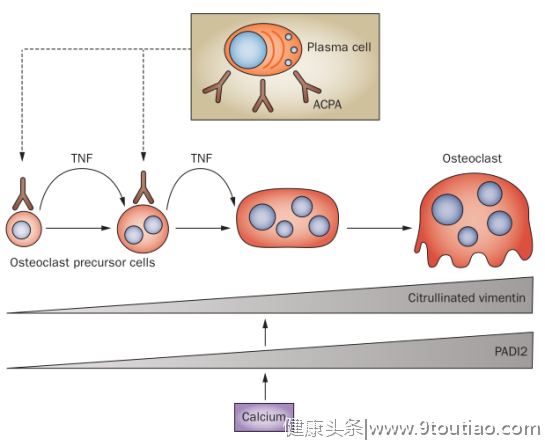
除此之外,RA自身抗体也可直接或间接促进破骨细胞发育,参与骨破坏的发生。如抗瓜氨酸化蛋白抗体(ACPA)可与破骨前体细胞结合,刺激TNF产生和释放,进而诱导破骨细胞形成(图3)[5-6];而巨噬细胞也可在自身抗体刺激下,释放炎性细胞因子,增强破骨细胞分化和功能,促进慢性炎症,诱导关节损伤[6]。
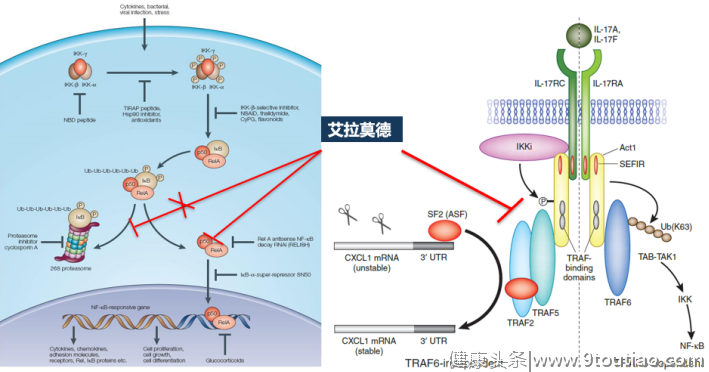
抑制炎性因子及破骨细胞胞内信号通路:鲍春德团队在胶原诱导关节炎的小鼠(CIA)中发现,IGU可抑制IL-17表达,同时降低TNF-α、IL-1β和IL-6水平[7];南京大学徐强等则证实,IGU可通过靶向Act1阻断IL-17通路,而IL-17是参与RA患者骨破坏的重要细胞因子[8];NF-κB通路是破骨细胞活化过程中重要的细胞内传导通路,日本研究学者M Kohno等研究表明,IGU可干扰NF-κB p65转移入核并抑制NF-κB活性[9](图4)。
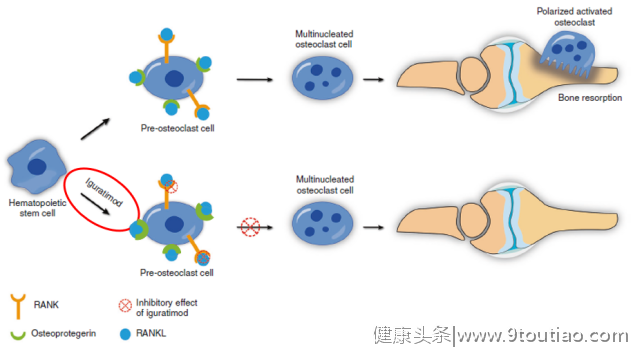
- 抑制骨吸收:RANKL是启动破骨细胞活化的重要信号。张缪佳等人通过体外试验证实,在小鼠RAW264.7细胞中,IGU可抑制RANKL诱导其向破骨细胞分化数量,减少骨吸收凹坑[10];而郭风劲等人在骨髓单核细胞中也发现,IGU以剂量依赖性方式强烈抑制RANKL介导的破骨细胞生成和骨吸收功能[11](图5)。
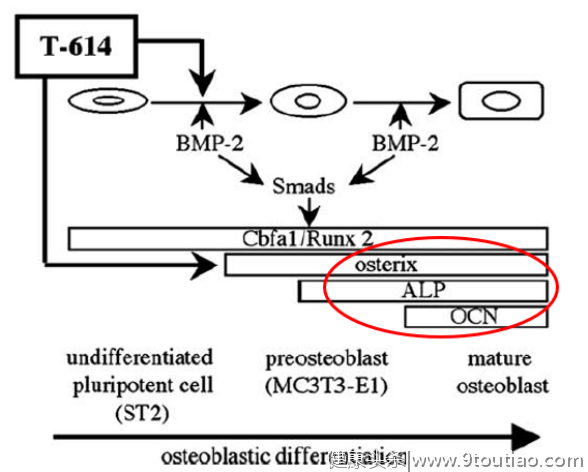
促进骨形成:日本学者Kohji Kuriyama等人发现IGU在体外可促进小鼠骨髓基质细胞ST2和胚胎成骨细胞前体细胞MC3T3-E1向成骨细胞分化,在体内可促进骨形态蛋白-2(BMP-2)诱导骨形成[13](图6)。此外,Osterix是调控骨形成的核心转录因子,在成骨细胞分化过程中发挥关键作用[14],而IGU可增加Osterix以及骨钙素表达水平[13];陈广洁等人研究还发现,IGU在间充质干细胞中可通过增加Dlx5和Osterix表达以及调节p38通路来促进成骨细胞分化和成熟[15]。
减轻软骨破坏:MMP是导致软骨破坏的重要物质。鲍春德教授等对接受IGU治疗后的RA患者体内MMPs水平进行检测发现,IGU可显著降低患者血清中MMP-1和MMP-3水平[16];张缪佳教授等研究则显示IGU可降低患者滑膜成纤维细胞中的MMP3表达[17]。
因此,以上机制研究结果均表明,IGU可通过多靶点调控,对RA病理过程中的软骨及骨破坏发挥全方面抑制作用,具有骨保护作用基础。
显著改善骨代谢相关指标:戴璐等研究者曾开展过一项针对中重度老年活动性RA患者的临床研究[18]。结果显示,治疗后两组骨代谢指标均显著改善,表现为25(OH)D及TPINP表达水平显著增加,NTX-1、β-CTX表达显著减少。但联合IGU组的4项骨代谢指标改善更为显著(P<0.05,表1)。
表1:2组骨代谢指标变化水平比较[18]
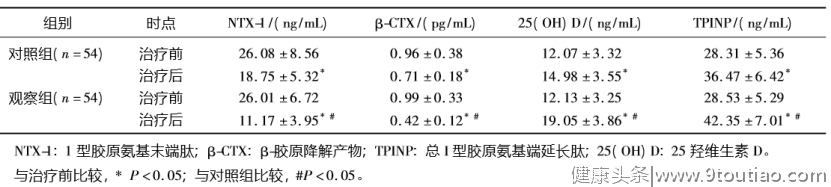
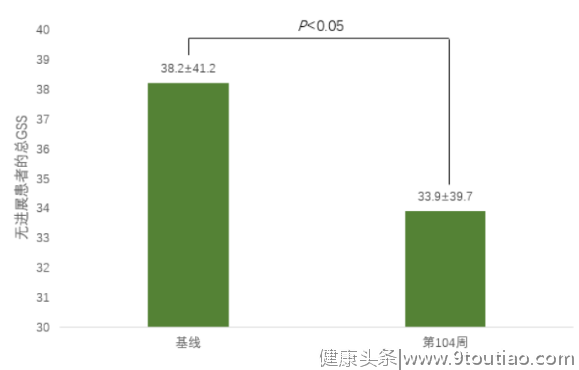 图7:IGU可延缓影像学进展,起到明显骨保护作用[19](GSS:Genant改良的sharp评分,用于评估RA关节损伤进展)
图7:IGU可延缓影像学进展,起到明显骨保护作用[19](GSS:Genant改良的sharp评分,用于评估RA关节损伤进展)
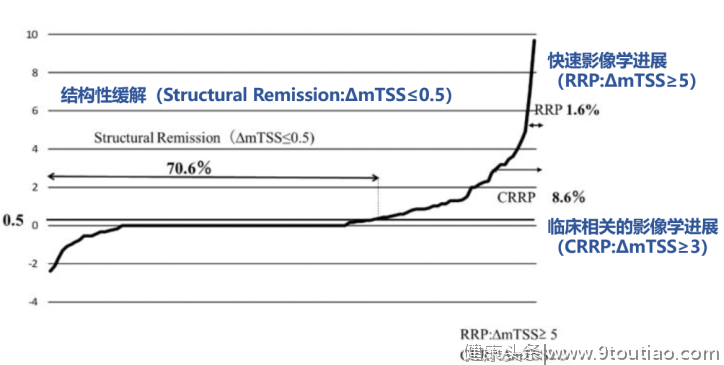
4小结软骨及骨破坏是RA患者关节损伤的重要机制,与疾病严重程度和患者功能结局相关。临床上应关注RA患者影像学进展,以实现达标治疗,改善患者预后。IGU作为一种新型DMARDs,从作用机制到临床研究,均证实其能发挥全面骨保护作用、延缓影像学进展。
参考文献:
[1] 孙晓萱,周慧琼. 类风湿关节炎骨吸收指标与关节破坏的相关性[J]. 中华骨质疏松和骨矿盐疾病杂志. 2014,7(2): 173-177.
[2] 张晓盈,段天娇,穆荣,等. 类风湿关节炎患者工作能力障碍的现况调查[J]. 中国风湿病学杂志. 2012,16(2): 77-81.[3] Sparks JA. Rheumatoid Arthritis[J]. Ann Intern Med. 2019 Jan 1;170(1): ITC1-ITC16.[4] Tateiwa D, Yoshikawa H, Kaito T. Cartilage and Bone Destruction in Arthritis: Pathogenesis and Treatment Strategy: A Literature Review[J]. Cells. 2019 Aug 2;8(8):818. [5] Schett G, Gravallese E. Bone erosion in rheumatoid arthritis: mechanisms, diagnosis and treatment[J]. Nat Rev Rheumatol. 2012 Nov;8(11):656-64.[6] Steffen U, Schett G, Bozec A. How Autoantibodies Regulate Osteoclast Induced Bone Loss in Rheumatoid Arthritis[J]. Front Immunol. 2019 Jul 3; 10:1483. [7] Du F, Lü LJ, Fu Q, et al. T-614, a novel immunomodulator, attenuates joint inflammation and articular damage in collagen-induced arthritis[J]. Arthritis Res Ther. 2008;10(6): R136. [8] Luo Q, Sun Y, Liu W, et al. A novel disease-modifying antirheumatic drug, iguratimod, ameliorates murine arthritis by blocking IL-17 signaling, distinct from methotrexate and leflunomide[J]. J Immunol. 2013 Nov 15;191(10):4969-78. [9] Kohno M, Aikawa Y, Tsubouchi Y, et al. Inhibitory effect of T-614 on tumor necrosis factor-alpha induced cytokine production and nuclear factor-kappaB activation in cultured human synovial cells[J]. J Rheumatol. 2001 Dec;28(12):2591-6. [10] Gan K, Yang L, Xu L, et al. Iguratimod (T-614) suppresses RANKL-induced osteoclast differentiation and migration in RAW264.7 cells via NF-κB and MAPK pathways[J]. Int Immunopharmacol. 2016 Jun; 35:294-300.[11] Wu YX, Sun Y, Ye YP, et al. Iguratimod prevents ovariectomyinduced bone loss and suppresses osteoclastogenesis via inhibition of peroxisome proliferatoractivated receptorγ[J]. Mol Med Rep. 2017 Dec;16(6):8200-8208. [12] Li J, Bao J, Zeng J, et al. Iguratimod: a valuable remedy from the Asia Pacific region for ameliorating autoimmune diseases and protecting bone physiology[J]. Bone Res. 2019 Sep 3;7:27.[13] Kuriyama K, Higuchi C, Tanaka K, Yoshikawa H, Itoh K. A novel anti-rheumatic drug, T-614, stimulates osteoblastic differentiation in vitro and bone morphogenetic protein-2-induced bone formation in vivo[J]. Biochem Biophys Res Commun. 2002 Dec 20;299(5):903-9. [14] Nakashima K, Zhou X, Kunkel G, Zhang Z, Deng JM, Behringer RR, de Crombrugghe B. The novel zinc finger-containing transcription factor osterix is required for osteoblast differentiation and bone formation[J]. Cell. 2002 Jan 11;108(1):17-29. [15] Song J, Liu H, Zhu Q, et al. T-614 Promotes Osteoblastic Cell Differentiation by Increasing Dlx5 Expression and Regulating the Activation of p38 and NF-κB[J]. Biomed Res Int. 2018, 2018:4901591.[16] Du F, Lü LJ, Teng JL, et al. T-614 alters the production of matrix metalloproteinases (MMP-1 andMMP-3) and inhibits the migratory expansion of rheumatoid synovial fibroblasts, in vitro[J]. Int Immunopharmacol. 2012 May;13(1):54-60.[17] Wei Y, Sun X, Hua M, et al. Inhibitory Effect of a Novel Antirheumatic Drug T-614 on the IL-6-Induced RANKL/OPG, IL-17, and MMP-3 Expression in Synovial Fibroblasts from Rheumatoid Arthritis Patients[J]. Biomed Res Int. 2015; 2015:214683.[18] 戴璐,宋欣丽, 邱肖明, 等. 艾拉莫德联合来氟米特治疗中、重度老年活动性类风湿性关节炎的效果观察[J]. 实用临床医药杂志. 2019, 23(3): 73-77.[19] Ishikawa K, Ishikawa J. Iguratimod, a synthetic disease modifying anti-rheumatic drug inhibiting the activation of NF-κB and production of RANKL: Its efficacy, radiographic changes, safety and predictors over two years' treatment for Japanese rheumatoid arthritis patients[J]. Mod Rheumatol. 2019;29(3):418-429.[20] K. Katayama, T. Okubo, K. Yujiro, et al. INHIBITION OF RADIOGRAPHIC PROGRESSION BY IGURATINOD IN 116 JAPANESE RHEUMATOID ARTHIRITIS PATIENTS DESPITE CONVENTIONAL SYNTHETIC DISEASE-MODIFYING ANTIRHEUMATIC DRUGS THERAPY[J]. Ann Rheum Dis, volume 79, supplement 1, year 2020, page 1007.