肝病领域下一个“突破”何在?
吉利德公司开发的索磷布韦及其复方产品,从而开启了“丙肝治愈”的新时代。然而,其他肝脏疾病适应症中,制药行业能否寻找到“治愈”的新疗法呢?
在过去的几年里,寻找非酒精性脂肪性肝炎(NASH)和乙型肝炎的治疗方法引起了业界广泛关注,但进展缓慢。于11月13-16日举行的2020年第71届美国肝病研究协会(AASLD)年会/虚拟会议无疑是获取该领域最新进展的机会之一。
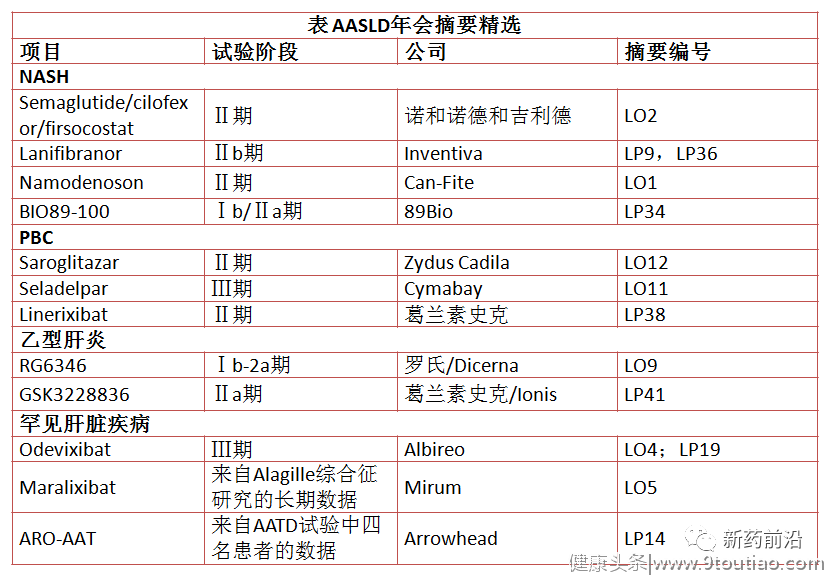
在提前发布的AASLD年会摘要中,诺和诺德和吉利德合作开发的NASH项目的试验尤为引起业界的兴趣,令人鼓舞的试验结果或许将可以说服两家公司继续合作。在乙型肝炎中,罗氏和葛兰素史克将争夺着业界的注意力,而罕见肝脏疾病也将成为关注焦点。

尽管NASH新药研发领域屡屡遭遇挫折,但仍然是研究人员和投资者关注的重点肝脏疾病,而AASLD年会摘要缺乏晚期研究数据更说明了该领域取得进展的艰辛程度。
诺和诺德和吉利德强强联合,诺和诺德的胰升血糖素样肽1(GLP-1)受体激动剂司美格鲁肽(semaglutide)与吉利德在研疗法乙酰辅酶A羧化酶(ACC)抑制剂firsocostat和法尼醇X受体(FXR)激动剂cilofexor联用治疗NASH患者,将发布更详尽的Ⅱ期临床试验数据。该研究之所以引起人们的极大兴趣,因为其结果可以为后来者是否可能在这一领域采取进一步行动提供线索。
去年,吉利德在NASH新药研发连续遭遇失败:2月,细胞凋亡信号调节激酶1(ASK1)抑制剂selonsertib(GS4997)在其第一个Ⅲ期临床试验(STELLAR-4)错过一级终点后,4月,selonsertib在另一项STELLAR-3研究中未能到达预定的48周临床终点。12月,在另一项名为ATLAS的Ⅱ期临床研究,评估了firsocostat、cilofexor、二者双药联合以及二者分别联合ASK1抑制剂selonsertib治疗严重纤维化(F3-F4)NASH患者对改善纤维化的疗效和安全性,最终也遭遇失败。
NASH新药研发连连失败让大型生物技术公司似乎对进入该领域感到不寒而栗。AASLD摘要数据中,semaglutide/cilofexor/fistocostat组合无疑是该领域的主要竞争者。此外,诺和诺德独自开发的semaglutide用于治疗NASH,在获得FDA的突破性认定后,有望于明年开始启动Ⅲ期临床试验。
尽管遭遇失败的ATLAS研究包括cilofexor和firsocostat,但这两种药物组合对纤维化的解决效果影响最大。到目前为止,在AASLD摘要中揭示的数据表明,添加semaglutide可以带来其他益处。
目前尚不清楚诺和诺德和吉利德是否愿意继续推进semaglutide/cilofexor/fistocostat的开发。
此外,Inventiva公司将试图说服怀疑者:过氧化物酶体增殖剂激活受体(PPAR)激动剂在治疗NASH方面仍具有重要的一席之地。今年6月,在一项Ⅱb期试验中,Inventiva实验性PPAR激动剂lanifibranor治疗NASH达到了主要终点以及主要次要终点。该公司表示,根据这些数据,计划将lanifibranor推进到Ⅲ期临床中。
另外两款PPAR激动剂同样赢得了最新的机会。印度仿制药公司Zydus Cadila的Saroglitazar正在NASH和原发性胆源性胆管炎(PBC)中进行测试,而Cymabay的seladelpar在NASH失败后于8月在治疗原发性胆汁性胆管炎Ⅲ期ENHANCE研究达到了阳性临床试验结果。
02乙型肝炎:两强之争乙型肝炎的新药开发也正在逐步推进,最引人注目的是罗氏和葛兰素史克公司各自开发的RNAi和反义寡核酸(ASO)项目的最新进展。
去年,罗氏与Dicerna公司就后者在研RNAi疗法RG6346达成合作开发协议。今年8月,Dicerna在其线上研发日活动中发布了RG6346治疗慢性乙肝Ⅰ期临床试验概念验证结果,RG6346能够降低已经接受抗病毒疗法的慢性乙肝患者血液中的乙肝表面抗原(HBsAg)水平,并且在有些患者身上显示出长久的疗效。根据罗氏与Dicerna公司的协议,罗氏将接手进行Ⅱ期临床试验及以后的开发工作。
在今年4月欧洲肝脏研究学会年会(EASL)上,葛兰素史克公布了其与Ionis公司合作开发的反义寡核酸创新药GSK3228836数据,可降低乙肝表面抗原水平,有望称为成为“功能性治愈”乙肝的新一代疗法。
03罕见肝脏疾病:或有惊喜在罕见肝脏疾病领域,Arrowhead公司开发的针对罕见遗传病α-1抗胰蛋白酶缺乏症(AATD)新二代皮下给药RNAi疗法ARO-AAT,9月公布的一项开放标签Ⅱ期AROAAT2002临床研究的4名受试者24周中期肝活检结果表明,ARO-AAT具有显著的药效学效应,导致相关生物标志物改善,包括肝内Z-AAT(引起肝损伤的突变蛋白)显著下降。当时有人质疑在所有患者中是否都报告了Z-AAT显著下降,摘要中发布的数据似乎打消了这种疑虑。但是,由于参与患者人数较少,因此该项目需要更多的安全性和有效性数据;关键的Ⅱ/Ⅲ期Sequoia试验正在进行中。
另外,Albireo公司的odevixibat的全部细节披露也将引起关注,该药用于治疗罕见的儿童期肝病——进行性家族性肝内胆汁淤积症。9月,该公司公布了odevixibat治疗进行性家族性肝内胆汁淤积症(PFIC)全球Ⅲ期PEDFIC-1临床研究的阳性结果,从而筹集了1.6亿美元,但仍在等待更多有关安全性的披露和更详尽的数据。
作为odevixibat的竞争者,Mirum公司的maralixibat也将在AASLD展出,还会公布该药治疗Alagille综合征的最新信息。葛兰素史克在会议上也会发表有关回肠胆汁酸转运体(IBAT)抑制剂linerixibat的演讲。