国内团队发现抑郁症患者血浆外泌体可改善炎症诱导的抑郁样行为
本文由brainnews脑科学世界团队原创编译,转载请联系授权。
外泌体在神经精神类疾病的病理过程中发挥着重要的作用,然而它在重度抑郁症(MDD)中发挥的作用仍然未知。
来自徐州医科大学的郭琳团队在Brain Behav Immun上发表了关于源于抑郁症患者的血浆外泌体能够减轻LPS诱导的抑郁样行为的文章,并且解释了其抗抑郁的机制是依赖外泌体上的Sigma-1受体进行的,因此为MDD患者提供了一种新的依赖外泌体上Sigma-1受体的靶向治疗手段。

1.血浆外泌体对脂多糖诱导的抑郁样行为的影响
为了证明血浆外泌体在抑郁症中发挥的作用,该研究团队首先从抑郁症患者和健康志愿者,以及LPS诱导的抑郁小鼠和慢性束缚诱导的抑郁小鼠的外周血中中分离出了典型的外泌体。
在LPS诱导的小鼠抑郁症模型中,研究人员发现和CON-EXO,hCon-EXO相比,LPS-EXO,CRS-EXO及MDD-EXO能够显著降低小鼠在悬尾实验以及强迫游泳实验中的不动时间,并且显著升高其糖水消耗百分比以及在旷场实验中停留在中心区域的时间,改善LPS诱导的抑郁样行为。

图1 血浆外泌体对LPS诱导的抑郁样行为的影响
2.抑郁症来源的外泌体能够减轻LPS诱导的抑郁症中BDNF缺乏和小胶质细胞活化
脑源性神经营养因子(BDNF)是一种和突触可塑性相关的关键调控蛋白,因此研究人员接下来研究了外泌体对BDNF表达的影响。采用蛋白质免疫印迹法发现LPS诱导的抑郁小鼠海马区域的BDNF表达量显著下降,LPS-EXO,CRS-EXO及MDD-EXO治疗后可显著增加BDNF表达量。
神经炎症是抑郁症中常见的风险因素,脑中小胶质细胞是炎症应答的主要介导者,通过免疫组织荧光法采用Iba1抗体对小胶质细胞进行标记,研究人员接下来研究了小胶质细胞的激活情况。
发现和对照外泌体治疗组相比,LPS-EXO,CRS-EXO及MDD-EXO治疗后Iba1阳性细胞数量显著降低,表明小胶质细胞激活量降低,同时也发现小鼠脑组织中促炎症因子TNF-ɑ、IL-1β和iNOS表达量降低。因此抑郁症来源的外泌体能够起到一定的抗炎效果。
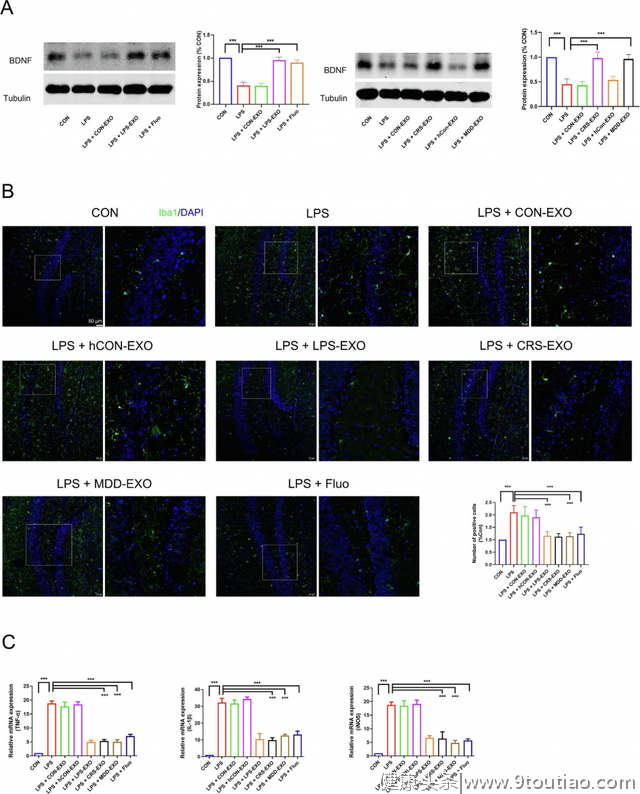
图2 血浆外泌体在LPS诱导的抑郁症中对BDNF的表达和激活的小胶质细胞的影响
3.抑郁症来源的外泌体能够抑制LPS诱导的BV2小胶质细胞炎症反应
接下来,研究人员进一步通过细胞实验验证了外泌体在BV2小胶质细胞中发挥的作用。首先通过Dil对外泌体进行标记,发现DiL标记的外泌体能够和体内海马小胶质细胞核体外BV2小胶质细胞共定位,表明外泌体能够进入小胶质细胞从而发挥作用。
然后采用LPS激活BV2小胶质细胞,发现促炎型因子IL-1β、TNF-α、iNOS mRNA表达量升高,NO释放量升高,而LPS-EXO,CRS-EXO及MDD-EXO治疗后这些炎症介质显著降低。因此,抑郁症来源的外泌体能够缓解小胶质细胞激活后介导的神经炎症。
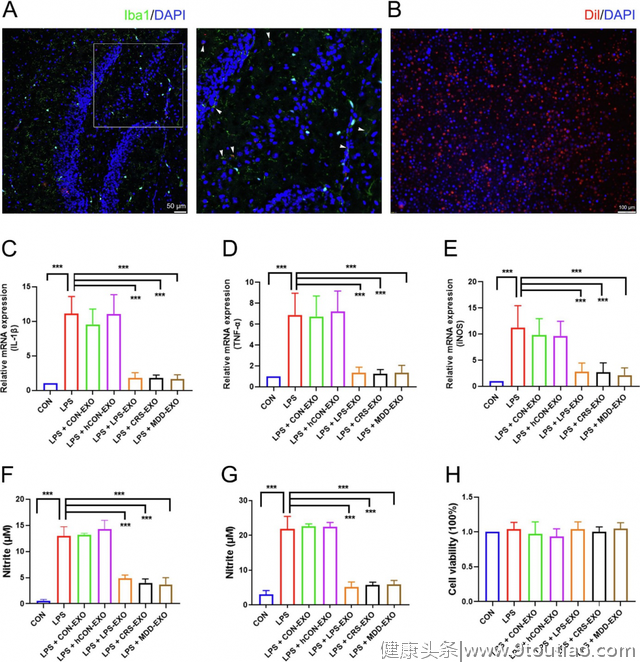
图3 血浆外泌体对BV2小胶质细胞中LPS诱导的炎症的影响
4.抑郁症来源的外泌体中存在Sigma-1受体缺失后相应的抗抑郁作用亦消失
接下来,该研究团队进一步研究了抑郁症来源的外泌体抗抑郁作用的机制。先前文献中报导包含223个氨基酸的分子伴侣Sigma-1受体是一种潜在的抗抑郁靶标,对BDNF和神经炎症有很好的调控作用。
研究人员发现抑郁症来源的血浆外泌体中高表达Sigma-1受体,进一步通过敲除该受体后与LPS-EXO共孵育能恢复血浆外泌体中高表达的Sigma-1受体。Sigma-1受体能够使ERK1/2磷酸化从而发挥作用。
最后,研究人员验证了外泌体中富集的Sigma-1受体在外泌体抗抑郁作用中的必要性。敲除Sigma-1受体后抑郁来源的外泌体是无法恢复抑郁小鼠的抑郁样行为,也无法抑制小胶质细胞激活后的炎症反应。
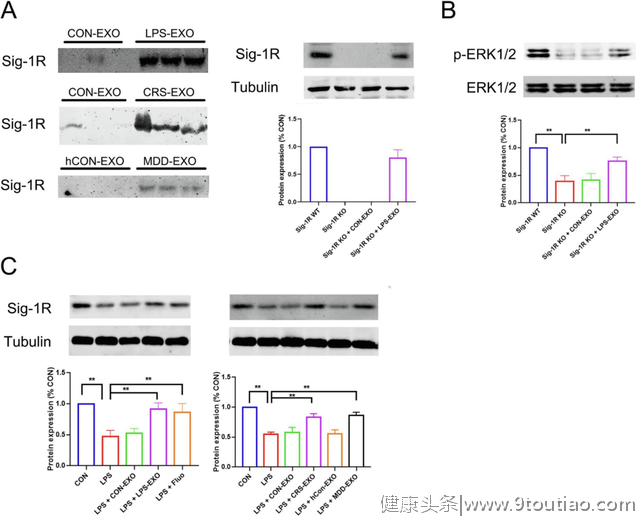
图4 Sig-1R在血浆外泌体中的表达
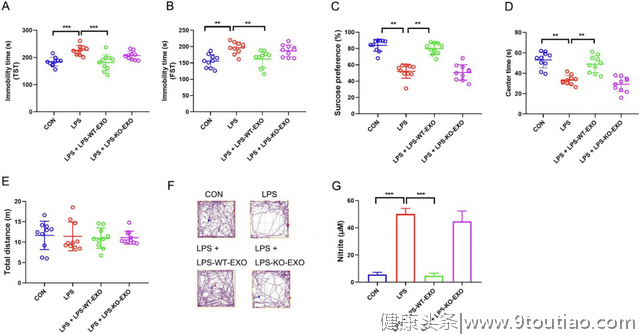
图5 敲除外泌体中Sigma-1受体对血浆外泌体的抗抑郁样活性的影响
总 结
抑郁症来源的外泌体能够在一定程度上起到抗抑郁的疗效,并且这种作用是通过外泌体中上调的Sigma-1受体调控BDNF表达量和小胶质激活后的炎症应答进行的,因此外泌体甚至可以说是包含Sigma-1受体的外泌体可以作为重度抑郁症患者抗抑郁治疗的新策略。
当然,并非所有的抑郁症血浆外泌体均能起到抗抑郁作用,这和相关外泌体中复杂的内容物相关,还需要进一步的研究。
参考文献
Wang Y, Gao C, Gao T, Zhao L, Zhu S, Guo L. Plasma exosomes from depression ameliorate inflammation-induced depressive-like behaviors via sigma-1 receptor delivery. Brain Behav Immun. 2021 May;94:225-234. Epub 2021 Feb 16. PMID: 33607235.
编译作者:日兮(brainnews创作团队)
