肿瘤免疫治疗:哪些真靠谱,哪些不成熟,哪些纯忽悠?
肿瘤的免疫治疗
1、免疫治疗的工作机制免疫治疗是如何开始的呢?这就要从头说起。致癌物(吸烟、电离辐射、幽门螺杆菌等)引起细胞的DNA损伤,细胞内部防御机制参与修复,从而引起免疫反应;细胞外的防御机制也参与进来,免疫系统被激活,保护机体;由于有免疫系统的保护,通常我们不会得癌症。免疫系统能清除掉一看就不是好人的“癌细胞”。
免疫细胞清除癌细胞需要两个重要步骤,第一步是识别,第二步是消灭。免疫细胞需要识别肿瘤细胞的一些表面特征,发现它是坏人。这就像警察从时间、地点和线索等综合信息,判断一个人是不是罪犯。警察光知道一个人是罪犯是不够的,还需要能铲除他们。同样道理,免疫细胞也不能光发现癌细胞,还需要清除它。
但是当免疫系统出现问题时,癌症细胞就可能逃脱免疫的杀伤,此时免疫系统常常因为分不清敌我,而放过了本应该被杀伤的癌细胞。癌症的发生,说明免疫细胞的监管作用失灵了,这叫做“免疫逃逸”。
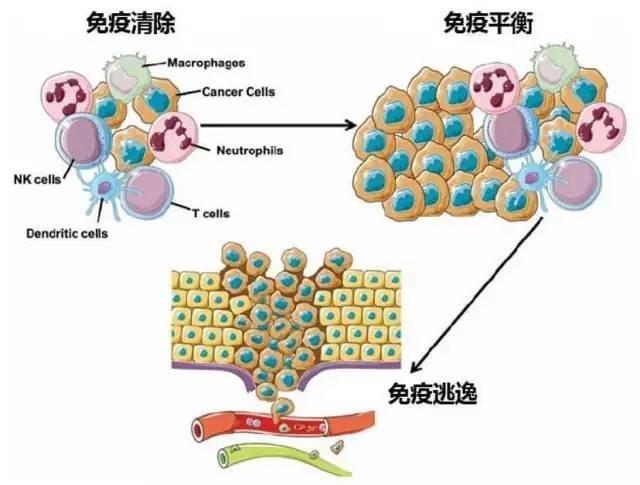
识别和消灭这两步之中,至少其中一个出了问题。有些时候,“识别”会出问题,因为癌细胞通过伪装,外表怎么看怎么像好人,免疫细胞无法识别。还有些时候,“消灭”这一步出了问题。免疫细胞明明识别了癌细胞,但却没啥反应,变成“围观吃瓜警察”。这是因为癌细胞很聪明,它们能给免疫细胞发送各种信号,来抑制免疫细胞的活性。就像罪犯给警察送礼一样,让它们“高抬贵手”。此外,还有一个特别的原因,肿瘤中的细胞大多来源于人体自身,免疫系统不会轻易把它们视为异物,因此不会主动对它们展开攻击。

适应性免疫系统与肿瘤细胞的作用机制示
2、肿瘤免疫治疗概述肿瘤免疫治疗被认为是近几年来癌症治疗领域最成功的方法之一。肿瘤免疫治疗在《科学》杂志2013年十大科学突破中位居首位。2016年~2017年,肿瘤免疫治疗两度被美国临床肿瘤学会评选为年度首要进展。
毫无疑问,免疫疗法是现在抗癌领域最火爆的概念,自然也在国内外的肿瘤患者、投资机构、新闻媒体等圈子,掀起了讨论和追逐的热潮—PD-1、PD-L1、CAR-T、生物治疗、肿瘤疫苗、细胞治疗,林林总总,不一而足!一时间,各种相关的、不相关的中英文词汇,连篇累牍,激起濒临绝症的病友心底强烈的求生愿望。
不少肿瘤患者,对免疫治疗,盲目乐观、跃跃欲试;有的患者,甚至不惜重金、冒着生命危险,去尝试依然处于研发早期阶段的、连安全性都无法保证的“肿瘤免疫治疗新技术”。
到底什么样的肿瘤免疫治疗是靠谱的?什么是不成熟的?什么是大忽悠?
肿瘤免疫治疗,实际上主要分为两大类:一种把肿瘤的特征“告诉”免疫细胞,让它们去定位,并造成杀伤,这种疗法一般就是细胞免疫疗法。
另一种是解除肿瘤对免疫的耐受/屏蔽作用,让免疫细胞重新认识肿瘤细胞,对肿瘤产生攻击,这种疗法就是免疫检查点抑制剂疗法。
细胞免疫疗法细胞免疫疗法是把患者体内免疫细胞拿到体外进行改造,让这些细胞具备对癌细胞更有效、更精准的免疫能力,改造后的免疫细胞回输到患者体内后,它们会定向消灭癌细胞。这类疗法包括LAK、DC、CIK、DC-CIK、CAR-T、TCR-T、NK、CAR-NK以及肿瘤浸润性淋巴细胞(TIL)等。
经过数十年的研究,大浪淘沙始到金,眼下有出色临床效果的是TCR-T、CAR-T,而LAK、DC、CIK、DC-CIK基本被证明是无效的,而NK、CAR-NK、TIL等技术还有待成熟,有待进一步完善。
DC-CIK疗法谈到DC-CIK疗法,“魏则西事件”不得不提。2016年5月,一个年轻人的去世,曾经点燃了举国的怒火,引燃了一场席卷全国、波及肿瘤治疗全行业的大整顿。这个年轻人,就是魏则西,晚期滑膜肉瘤患者,他所接受的治疗就是“DC-CIK”的肿瘤免疫细胞治疗。
因为求生心切,魏泽西及其家人被无良的商家和昧心的假医生合谋欺骗,支付了巨额的花费,而病魔依然肆虐。临死之前,魏泽西在网上留下了愤怒的质问“什么是人性最大的恶?”。可以这么说,公众开始熟悉“肿瘤免疫疗法”,始于这一事件,媒体聚焦于这一领域也始于这一事件。
DC-CIK疗法是一种疗效尚未明确、国外已经淘汰多年的肿瘤免疫治疗。DC细胞(树突状细胞)的发现者是洛克菲勒大学教授Ralph Steinman,他在2007年患上胰腺癌后,先后采用了三种基于DC细胞的试验性肿瘤疫苗治疗(不是单纯的DC-CIK疗法),使其生命延长了4年,远高于一般患者的数周到数月。然而,这种类似于“打鸡血”的T细胞回输疗法,在国外已经探索和改良了三四十年,在国内已经红火了十几年,却最终被证实无效,是国内病友上当受骗最多的“重灾区”。
“魏则西事件”让我们知道,并非所有打着“免疫疗法”旗号的方法都靠谱。“魏则西事件”无疑给免疫疗法蒙上了一层阴影,但我们不能以偏概全,因噎废食。一方面政府需要加强监管,防止无效疗法泛滥;另一方面,患者家庭自己要多关注和了解被证明有效的免疫疗法。
TCR-T疗法TCR-T和CAR-T这两种技术的共同点在于通过基因改造的手段提高T细胞受体对特异性癌症细胞抗原的识别能力和进攻能力,因此也都统称为“T细胞受体重新定向”技术,但两者所使用的方法是不同的。
打一个简单的比喻。CAR-T是一种“换头”技术,它把TCR的“头”直接换成一个特异性的抗体,这样就可以让T细胞在抗体的指引下直接进攻癌细胞。和CAR-T这种大手笔的改动相比,TCR-T可以说只是简单地“理了理发”,做做修饰和改造。当然用来“理发”的T-细胞并非任何T细胞,而是对癌细胞有一定的识别能力的T细胞,但它们的识别能力通常较弱。通过部分基因修改的方法来提高这些TCR对相应癌细胞抗原的“亲和力”和战斗力,就形成了TCR-T技术。
比如Adaptimmune公司联合研发的TCR-T药物,针对有NY-ESO-1过量表达的多发性骨髓瘤患者。临床试验结果显示80%的多发性骨髓瘤患者有了很好的临床应答,其中70%的患者达到完全或接近完全应答,平均无进展生存期达到了19个月。这样的结果可以说是非常令人振奋的。
CAR-T疗法我们来看远隔重洋的另外一个正能量的故事。2012年,宾夕法尼亚大学的Carl June教授,开始了一项叫做嵌合抗原受体T细胞(CAR-T)技术应用于儿童急性淋巴细胞白血病的研究,治疗的第一个病人是一个7岁的女孩,名字叫Emily Whitehead。
这个小姑娘经历九死一生,奇迹般获得了新生。从那以后,CAR-T技术名声大噪。四五年过去了,原本已经无药可治的Emily,依然健康地活着,她的家人和医生团队,一起成立了以小姑娘的名字命名的慈善基金会,还受到了美国奥巴马总统的亲切接见。Emily和她的基金会,俨然成了CAR-T技术的“代言人”。
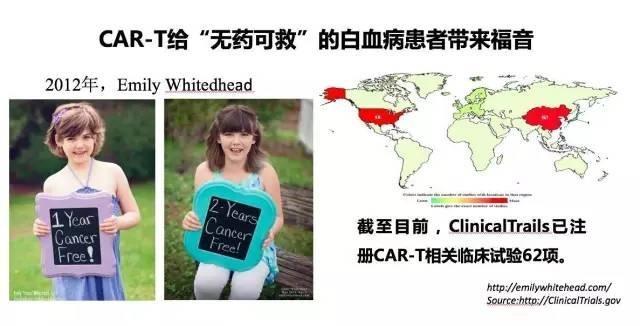
CAR-T技术究竟是什么呢?
CAR-T疗法的概念最早来自于Zelig Eshhar教授,他提出将抗体的轻重链连接到T细胞表面TCR的恒定区上,随后又将scFv(T细胞表达的抗体单链的的可变区)替换轻重链,避免了多次重复的转基因,这就是第一代CAR-T疗法。其实质是将嵌合抗原受体(CAR)导入T细胞中从而产生肿瘤特异性识别的T细胞。一旦T细胞表达这种受体,便可用单个融合分子与抗原进行特异性结合并激活T细胞。这一技术最重要的一点,能够在相对较短的时间内产生大量有肿瘤杀伤效力的T细胞,从而使得这一技术走向临床。
迄今为止,CAR-T技术已经发展到了第三代,最成功的莫过于选择CD19这个B细胞抗原做靶标了,CAR-T的光芒注定开始闪耀,在慢性粒细胞性白血病、急性粒细胞性白血病、非霍奇金淋巴瘤、多发性骨髓瘤中取得了显著的疗效。
目前,诺华(Norvatis)以CD19为靶点的CAR-T疗法药物CTL019已经获得了美国FDA颁发的优先审评资格,有望在近期上市,治疗儿童或年轻人中复发或难治性的急性B细胞型淋巴性白血病。2017年4月,CTL019又获得了美国FDA颁发的突破性疗法认定,治疗复发性或难治性弥漫性大B细胞淋巴瘤(DLBCL)。
Kite Pharma不甘落后也完成了其以CD19为靶点的CAR-T候选药物KTE-C19的生物制品许可申请的机动送审。

在国内,CAR-T的临床试验领先的是中国人民解放军总医院(301医院),使得中国研发团队跻身于全球CAR-T细胞技术转化医学研究领域的前列。已公布的关于CAR-T CD19针对急性淋巴细胞白血病,CAR-T CD20针对弥漫大B细胞淋巴瘤以及CAR-T CD30治疗霍奇金淋巴瘤的三项I期临床数据,初步显示了301医院CAR-T细胞靶向肿瘤免疫疗法相对安全、可行和有效。
CAR-T疗法带来的不良反应不容忽视
最显著的毒性就是细胞因子释放综合征,又称为细胞因子风暴,细胞因子的大量释放引起炎症,临床表现为恶心、高热、肌痛、不稳定的低血压和呼吸衰竭。
另外一个不良反应是神经毒性,临床表现为谵妄、语言障碍、运动障碍、缄默症和癫痫发作。
此外还存在引起自身免疫性疾病的风险。
有一点是明确的,虽然以CAR-T为代表的新型肿瘤免疫细胞治疗已经在血液肿瘤中取得了不俗的疗效。但是,至今尚未有一款肿瘤免疫细胞治疗,获得欧美国家的上市许可。目前,在国外,都是以免费的、自愿的临床试验的方式做深入的研究和探索。
去年“魏泽西事件”爆发后,国家卫计委明确规定:任何类型的肿瘤免疫细胞治疗,在全世界范围内,都没有正式上市,在国内也同样处于临床研究阶段,不得收费;未来,将按照药品管理,只有经过科学、规范、严谨的临床试验确认其安全性和有效性,获得有关部门的正式批准之后,方可大规模推广。
说说CAR-T在实体瘤中的临床应用和实践。2015年,Novartis/UPenn(制药巨头诺华公司和美国宾夕法尼亚大学)在AACR2015上公布了CART-meso的初步临床结果,表明CAR-T疗法的安全性和有效性在实体瘤方面同样值得期待。研究人员使分离获得的T细胞识别一种名叫间皮素(mesothelin)的蛋白,这种蛋白在多种实体瘤中都有高表达。5名多种疗法均告失效的受试患者,安全性基本没有问题,不良反应主要是败血症、气短及白细胞水平升高。2名受试者影像上略有好转,持续有效时间比较短。

一石激起千层浪,有人认为是好消息,有人认为是坏消息。面对并不惊艳的结果,总会找一些理由来鼓舞我们继续前行。
首先,这次的I期临床试验的终点评价指标是安全性,采用的是传统的“3+3”剂量爬坡方案,剂量范围从1-3×107/m2到1-3×108/m2,这个剂量不算高。在安全为主的前提下,剂量保守是必须的。
其次,间皮素在多种实体瘤中高表达,正常组织也有表达,并且Novartis/UPenn构建CAR采用的ScFv为鼠原性的,具有一定的免疫原性,其有被自身免疫系统排出的可能,限制了持续存在,而Juno/MSKCC针对间皮素的CAR采用的人源化的scFv,不妨再期待一下。
再者,CAR-T在实体瘤发挥作用需要浸润到实体瘤并克服肿瘤微环境的抑制作用,虽然在肿瘤部位和外周血中发现了CAR-T,但其与CD19 CAR-T的水平相差甚远,什么原因限制了CART-meso的持续存在和扩增呢?已经在研发一些增强归巢和转运能力的CAR-T,打破肿瘤微环境的CAR-T,这些CAR-T的结果也许值得我们期待。
此外,试验评价主要终点的ORR可能不是免疫治疗的一个比较好的指标,大多数免疫治疗的终点评价指标为OS。
最后,我们对CAR-T的了解可能还远远不够。
在ASCO2015年4月的快报上报道了CAR-T细胞治疗实体瘤的一个临床结果。这个由Baylor医学院Nabil Ahmed医生主导的临床实验共招募了17位复发的Her-2阳性肉瘤病人。CAR-T细胞是针对Her-2设计。给药从104细胞/每平方米体表面积的起始剂量开始一直升到108细胞/每平方米体表面积,没有发现显着的药物毒性。在所检测的9位患者中有7位病人血液中检测到CAR-T细胞存活超过六周的证据,中位总存活期为10个月,其中一位病人观察到肿瘤超过90%坏死的临床表现。
对于CAR-T来说,安全性是第一道坎。在其开发过程中,超敏反应和细胞因子风暴一度被FDA叫停并终止临床,所以这个报道是令人鼓舞的。至于有效性,尚难评估,一是样本量太小,二是那例发现肿瘤坏死的病例尚无CAR-T细胞在肿瘤内浸润的资料。CAR-T细胞治疗实体瘤还有许多的坎,比如药靶,比如CAR-T细胞进入肿瘤的量等。不过,万事开头难,过了安全性这一关,后面的路就能继续走下去。
(原文载于中国癌症防治网,了解更多内容,搜索关注微信“kang-ai-120”)