减少320万例癌症死亡,美国癌症研究协会发布2021年抗癌进展报告
近日,美国癌症研究协会(AACR)发布了2021年抗癌进展报告(AACR Cancer Progress Report 2021)。AACR成立于1907年,是世界上成立最早,规模最大,致力于全面、创新和高水平癌症研究的科学组织之一。这一综合性报告回顾了截至2021年7月底,过去一年里抗击癌症路上获得的众多进展。

全球面对的癌症挑战
根据世界卫生组织的估计,在2019年,癌症在112个国家中是年龄70岁以上人群的第一大或第二大死亡原因。在2020年造成接近1000万人的死亡。随着人口增长和社会老龄化的加快,全球的癌症负担预计会继续增长。预计到2040年,每年新确诊癌症患者将达到2840万人,比2020年增长47%。因此,我们急需癌症预防、检测、和治疗方面的新手段并且将它们在全球范围内应用。
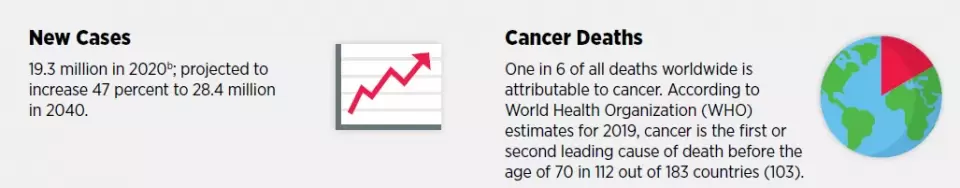 ▲癌症是全球性的公共卫生挑战(图片来源:参考资料[1])
▲癌症是全球性的公共卫生挑战(图片来源:参考资料[1])早期筛查和诊断有望挽救患者生命
癌症是一种渐进性疾病,正常细胞因为出现基因突变,开始不受控制的增殖。随着基因突变的不断积累,癌前病变转化为癌症病灶,并且扩散到周围的淋巴节,最终转移到身体的其它器官。
早期筛查有望在早期阶段发现癌症,从而做出相应的干预方案。比如,如果筛查发现癌前病变,可以手术切除这些组织,防止它们进展成为癌症。
在癌症早期发现肿瘤会大幅度提高患者的生存可能,比如早期或局部乳腺癌患者的5年生存率达到99%,而晚期或转移性乳腺癌患者的5年生存率降低到29%。在前列腺癌方面有类似的现象,早期患者的5年生存率超过99%,而晚期患者的生存率只有31%。这些数据强调了开发有效早期筛查手段的重要性。
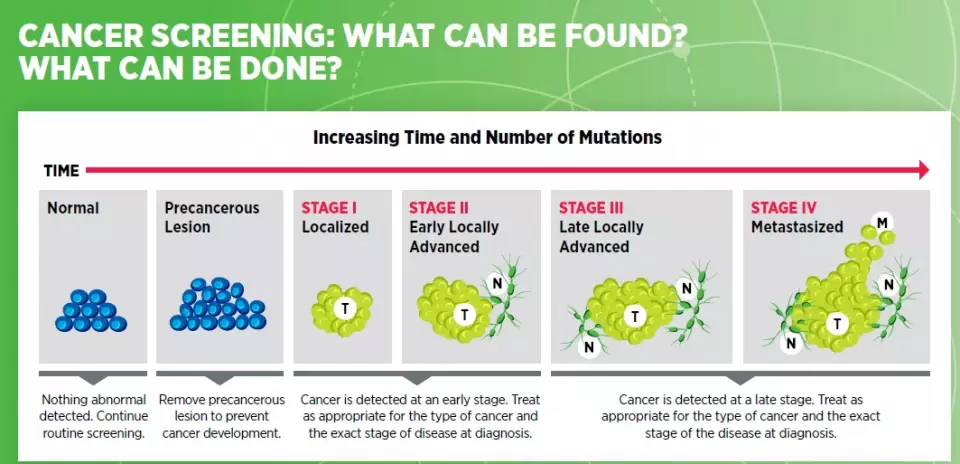 ▲早期筛查发现癌症可以根据癌症进展阶段做出针对性干预(图片来源:参考资料[1])
▲早期筛查发现癌症可以根据癌症进展阶段做出针对性干预(图片来源:参考资料[1])目前早期筛查领域的重要研发方向之一是减少筛查检测的侵袭性,这会降低接受筛查人群可能受到的损伤,提高筛查的依从率。
液体活检是早期筛查研发的一个重要方向。它通过检验血液或其它体液中与肿瘤相关的物质,包括游离癌细胞,无细胞DNA,以及外泌体,来发现肿瘤存在的痕迹。与传统的组织活检相比,它的侵袭性非常小。而且,已有研究显示,有的多癌种液体活检测试已经能够通过一次血检,发现多种不同癌症存在的早期迹象。
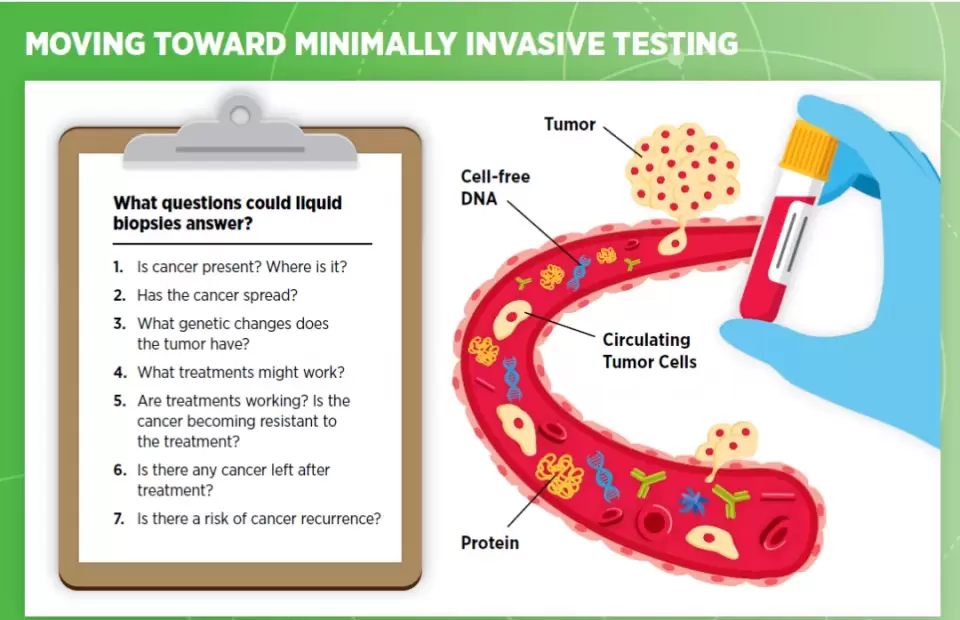 ▲液体活检等降低检测侵袭性的筛查手段是早期筛查领域的重要研发方向
▲液体活检等降低检测侵袭性的筛查手段是早期筛查领域的重要研发方向将科学突破转化为挽救生命的疗法
在生物医药研究生态圈中所有成员的共同努力下,创新疗法的开发和获批不但改善了患者的生活质量,也延长了他们的生命,从2020年8月到2021年7月底,美国FDA总计批准了16款创新抗癌疗法,11款已经获批的抗癌疗法同期也扩展了它们能够治疗的癌症类型。
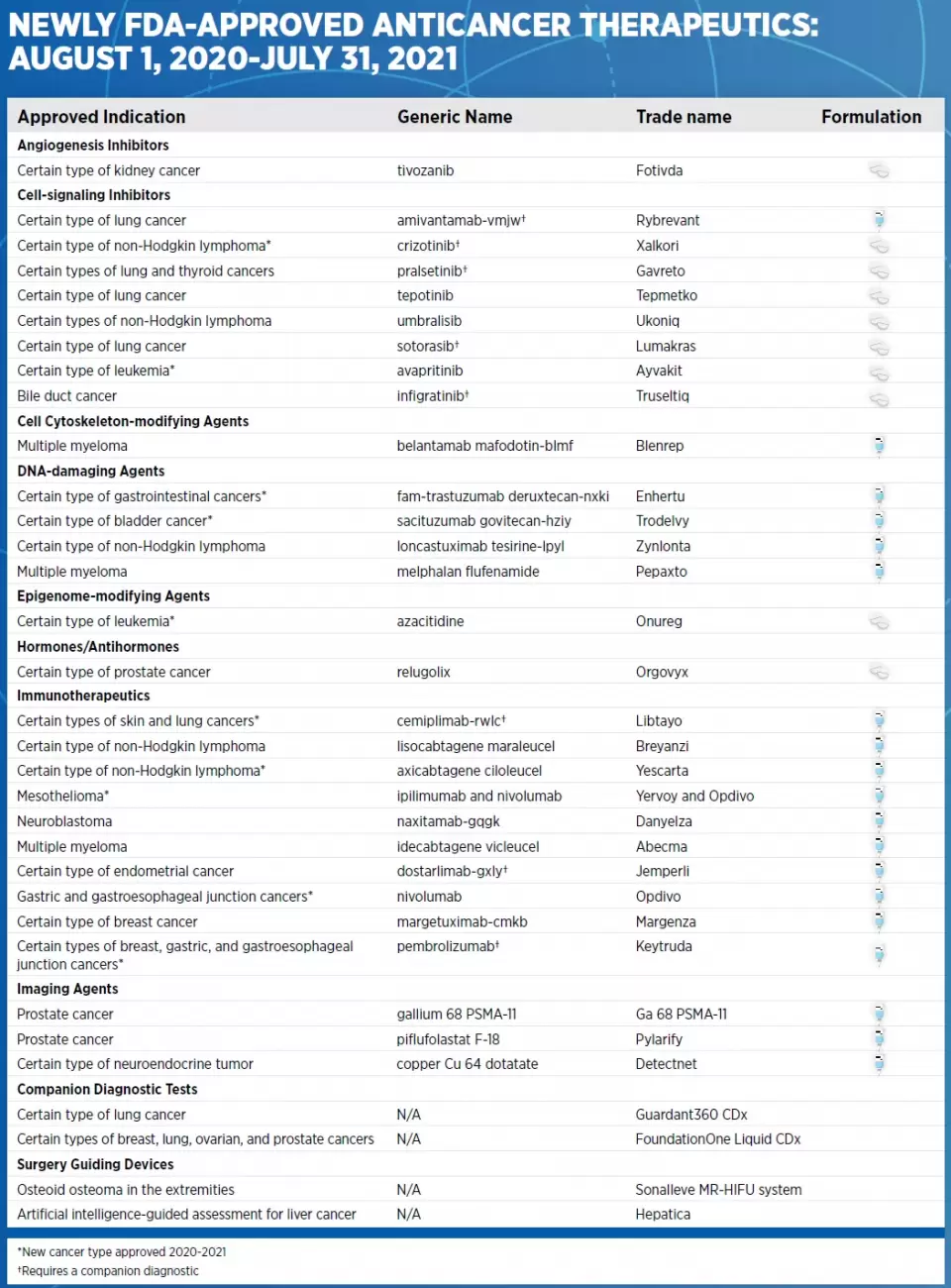 ▲2020年8月-2021年7月FDA批准的创新抗癌疗法
▲2020年8月-2021年7月FDA批准的创新抗癌疗法其中,精准疗法的开发正在成为抗癌疗法开发的一个重要方向。基于对驱动癌症进展的基因突变的深入理解,研发人员开发出一系列靶向特定基因突变的创新疗法,为医生们提供了多种治疗工具。
这些疗法不但能更为精准地针对影响癌细胞增生和生存的分子,而且与化疗相比,显著降低了对健康组织的毒副作用,改善了患者的生活质量。
从去年8月到今年7月底,FDA批准的16款新抗癌疗法中10款是靶向特定分子或基因突变的精准疗法。其中,最重要的突破之一是治疗肺癌的KRAS G12C抑制剂sotorasib的批准。它是首个获批直接靶向KRAS G12C突变体的精准疗法。KRAS G12C是非小细胞肺癌患者中最常见的基因突变之一。Sotorasib的获批是近40年来科学研究和药物研发的结晶。
 ▲攻克KRAS不可成药性的里程碑(图片来源:参考资料[1])
▲攻克KRAS不可成药性的里程碑(图片来源:参考资料[1])Sotorasib之外,FDA还批准了多款靶向特定蛋白激酶变异的精准疗法,包括针对EGFR,RET,MET,和FGFR2基因变异的Rybrevant,Gavreto,Tempetko和Truseltiq。
在精准消灭癌细胞的同时避免影响健康组织的另一个重要研究方向是抗体偶联药物(ADC)。它们利用抗体将偶联的毒素选择性地递送到癌细胞中。这些抗体与癌细胞表面高度表达的蛋白相结合,引导细胞毒素被吞入癌细胞中,发挥它们的杀伤力。从去年8月到今年7月,FDA批准了两款新抗体偶联药物,其中靶向B细胞成熟抗原(BCMA)的Blenrep是一款“first-in-class”抗体偶联药物,治疗多发性骨髓瘤。靶向CD19的抗体偶联药物Zynlonta也获得了FDA的批准,治疗B细胞淋巴瘤。
此外,2021年1月,FDA扩展了ADC疗法Enhertu的适应症,用于治疗HER2阳性胃癌或胃食管链接部腺癌。靶向Trop2的抗体偶联药物Trodelvy的使用范围也得到扩展。这些批准体现了抗体偶联药物这一独特靶向疗法开发领域的加速创新。
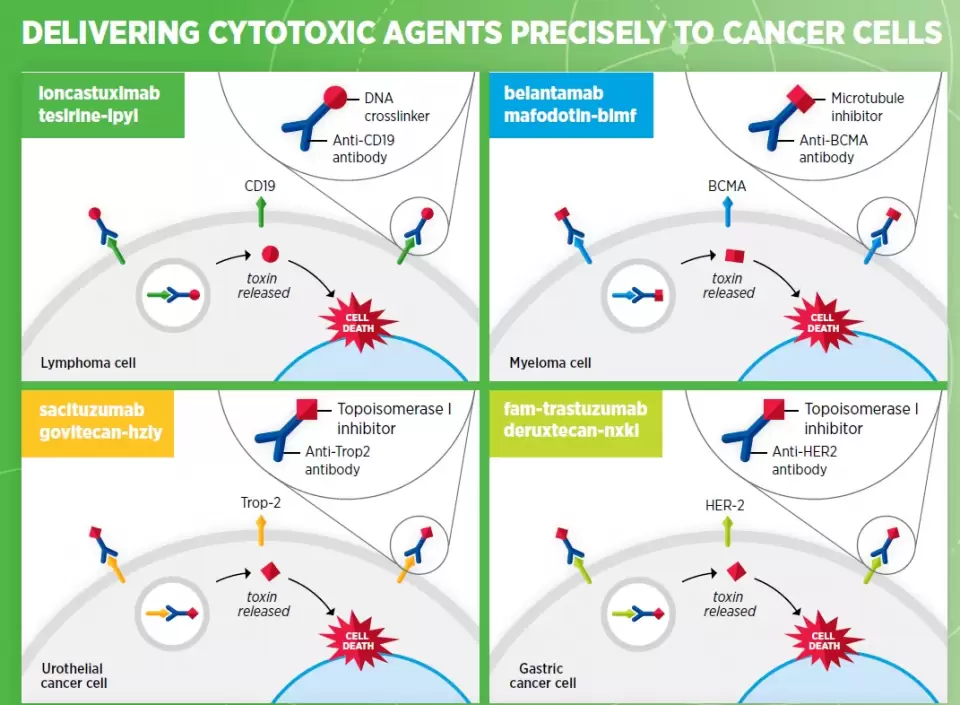 ▲将细胞毒素精准递送到癌细胞的抗体偶联药物(图片来源:参考资料[1])
▲将细胞毒素精准递送到癌细胞的抗体偶联药物(图片来源:参考资料[1])以免疫检查点抑制剂为代表的免疫疗法在过去10年的成功已经让它成为癌症治疗的支柱性疗法之一。这一疗法的重要优势之一是可以用于治疗多种癌症。从去年8月到今年7月,在实现免疫检查点抑制剂潜力方面的重要进展包括:FDA批准了新免疫检查点抑制剂Jemperli上市,用于治疗转移性子宫内膜癌。在这段时间里,FDA同时扩展了4款已经获批的免疫检查点抑制剂的适应症。截至2021年7月31日,已经有18种不同癌症类型可以用一种或者多种免疫检查点抑制剂治疗。
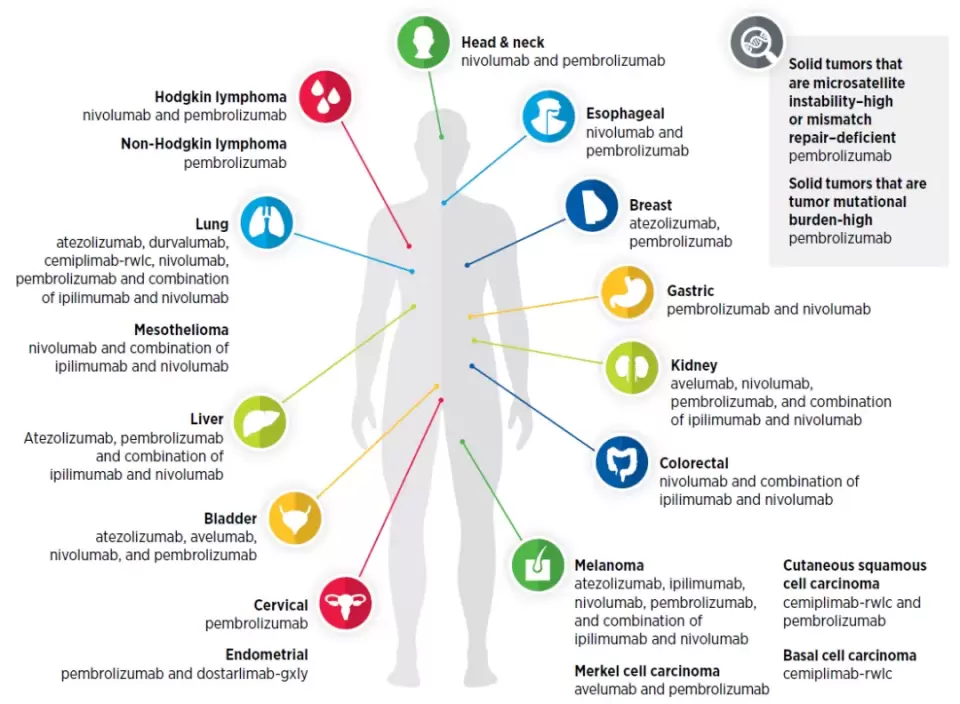 ▲18种不同癌症类型可以用免疫检查点抑制剂治疗(图片来源:参考资料[2])
▲18种不同癌症类型可以用免疫检查点抑制剂治疗(图片来源:参考资料[2])另一种利用人体免疫系统治疗癌症的方法是将免疫系统中的T细胞改造成杀伤癌症的细胞武器。截至今年7月的过去12个月里,FDA批准了两款新CAR-T疗法,其中靶向BCMA的CAR-T疗法Abecma是首款获批治疗多发性骨髓瘤的CAR-T疗法。靶向CD19的CAR-T疗法Breyanzi也获得批准治疗B细胞淋巴瘤。
第三种利用免疫系统杀伤癌细胞的策略利用抗体依赖性细胞毒性(ADCC),这类药物帮助免疫细胞发现和杀死癌细胞。在这一报告覆盖的12个月中,FDA批准了两款利用ADCC消灭癌细胞的疗法,它们是靶向HER2的单克隆抗体Margenza(用于治疗HER2阳性乳腺癌)和靶向GD2的单抗Danyelza(用于治疗神经母细胞瘤)。
这些创新疗法的不断进展在为患者提供更多治疗选择的同时,也显著提高了癌症患者的生存率。以常见的肺癌为例,在过去10年里, 肺癌的治疗产生了翻天覆地的变化。在2010年,只有三款靶向疗法获批治疗肺癌,包括两款EGFR抑制剂(Iressa,Tarceva)和一款血管增生抑制剂(Avastin)。截至今年7月底,治疗肺癌的靶向疗法和免疫疗法数目达到30款,与2010年相比翻了10倍!肺癌患者的5年生存率从1975-1977年间的12.3%提高到2011-2017年间的21.7%。
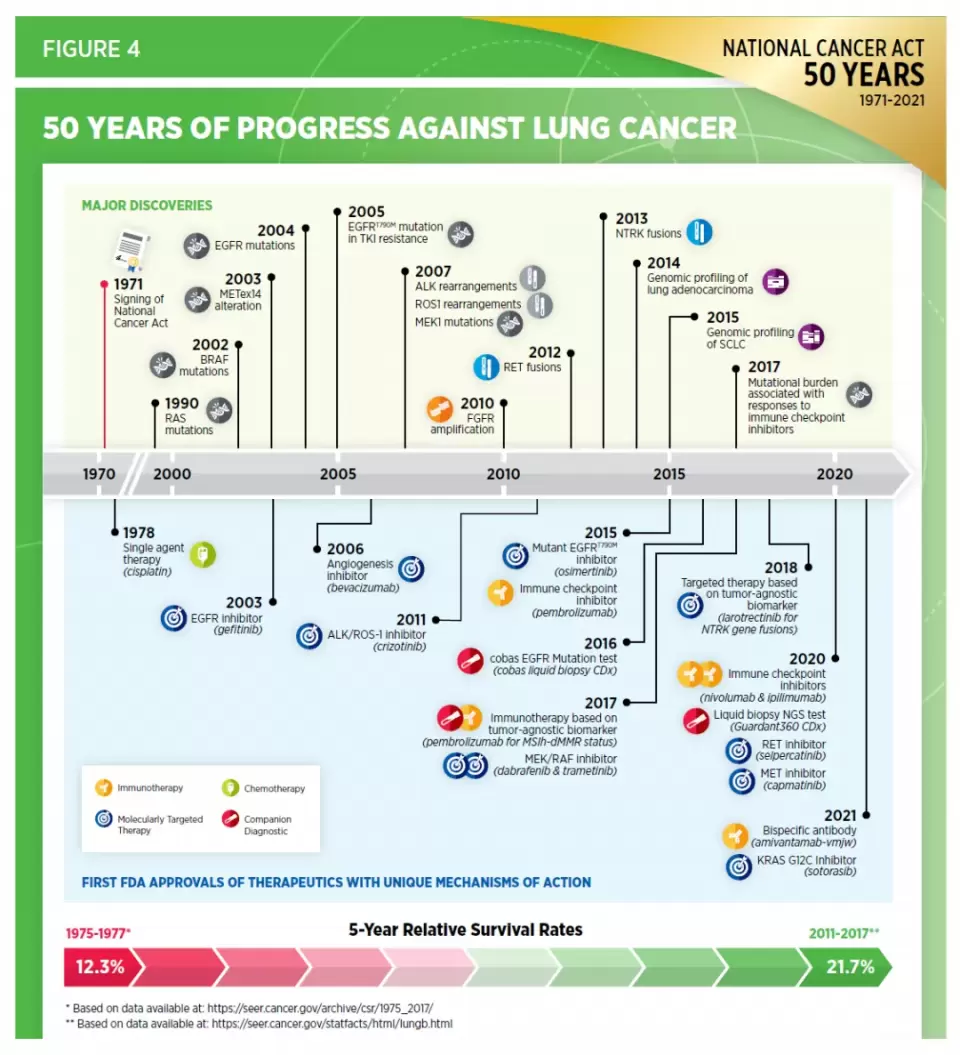 ▲肺癌治疗在过去50年中的突破(图片来源:参考资料[1])
▲肺癌治疗在过去50年中的突破(图片来源:参考资料[1])整体来看,在癌症预防、诊断和治疗多个方面的进展让美国的癌症死亡率从1991年到2018年下降了31%。相当于同期的癌症死亡人数减少了320万!
展望未来
报告指出,新一代科技的发展正在全面推动癌症科学研究从实验室向临床实践转化的速度。其中:
蛋白基因组学(proteogenomics)将是精准抗癌医疗研发的新前沿。癌症基因组学已经是现代精准医疗的核心之一,然而,DNA或RNA层面上的改变并不能完全揭示癌症背后的生物学机理。因为基因突变并不能完全可靠地预测在蛋白水平上的功能变化。而蛋白组学(对细胞中所有蛋白的全面综合分析)有望为癌症研究增添新的有力工具,发现单靠基因组学无法揭示的洞见。结合蛋白组学和基因组学的蛋白基因组学具有巨大的诊断和治疗潜力。
人工智将重塑癌症科学和医药的未来。人工智能在癌症科学和医药方面的应用正在飞速扩展。它有望简化解释病理学或放射学图像的流程,帮助医生们更快做出决策。在药物研发方面,人工智能也已经渗透到药物研发的多个步骤。
 图片来源:123RF
图片来源:123RF新一波创新剑指癌症中最难于靶向的靶点。虽然癌症治疗取得了长足的进步,然而目前的靶向疗法和免疫疗法大多数是小分子药物或单克隆抗体。它们靶向的靶点数目仍然有限。在癌症中多种常见的基因突变仍然难于靶向,例如TP53,RAS和MYC。
随着科学和技术的创新,研究人员正在开发新策略来靶向这些难于靶向的蛋白靶点。比如双特异性抗体可以通过将免疫细胞招募到肿瘤细胞附近,利用免疫细胞来消灭表达难于靶向蛋白的癌细胞。今年3月在《科学》和Science Immunology上发表的两项研究中,研究人员利用双特异性抗体成功靶向RAS和p53蛋白突变体,在小鼠模型中显著缩小了肿瘤的大小。
报告重点介绍的另一种创新策略是靶向蛋白降解疗法,这种双功能分子能够给致病的蛋白贴上“回收”的标签,引导它们被细胞中的蛋白酶体降解。因为它们的作用方式是降解致病蛋白而不是抑制致病蛋白活性,这类分子可能克服对已有疗法的耐药性。而且一个蛋白降解分子可以重复使用,诱导多个致病蛋白的降解,因此可能在更小的剂量下产生有效抗癌效果。