全球首个获批辅助治疗NSCLC的癌症免疫疗法:Atezolizumab
2021年10月15日,美FDA已批准PD-L1抑制剂Tecentriq(Atezolizumab)作为辅助疗法,在手术和含铂化疗之后,治疗II-IIIA期非小细胞肺癌(NSCLC)患者。这些患者的肿瘤表达PD-L1(≥1%)。值得一提的是,Tecentriq是首个获批辅助治疗NSCLC的癌症免疫疗法。
Tecentriq是一种单克隆抗体,可与PD-L1结合并阻断其与PD-1受体的相互作用,通过抑制PD-L1,可以激活T细胞消灭肿瘤细胞。
商品名:Tecentriq(特善奇)
通用名:atezolizumab(阿替利珠单抗/阿特珠单抗)
美国首次获批:2016年5月
中国首次获批:2020年2月
获批适应症:三阴性乳腺癌、尿路上皮癌、非小细胞肺癌(中国)、小细胞肺癌(中国)、肝癌(中国)
肺癌辅助治疗的推荐剂量: 840 mg每次,每2周一次;1200 mg每次,每3周一次;1680mg每次,每4周静脉注射一次,每次60分钟以上。
临床数据
这一批准是基于一项随机、多中心、开放标签、III期的IMpower010临床试验的中期分析结果。
该试验共有1280例IB期(肿瘤≥4 cm)至IIIA期NSCLC患者在完全切除后入组,最终1005例患者在辅助化疗后1:1随机分组接受Tecentriq辅助治疗(n=507)或最佳支持治疗(n=498)。
入组患者的人群特征包括:中位年龄为62岁,67%的患者为男性。大多数患者为白人(73%)和亚洲人(24%)。大多数(78%)患者是目前或以前的吸烟者;ECOG评分为0(55%)或1(44%)。总体而言,12%的患者为IB期,47%为II期,41%为IIIA期。肿瘤细胞表达PD-L1的百分比为:53%的患者中PD-L1表达≥1%,44%的患者中<1%,2.6%的患者中未知。
研究人员评估的主要疗效结果是无病生存期(DFS)。关键的次要疗效结果衡量指标是意向治疗人群的总生存期(OS)。主要疗效分析人群(n=476)为II - IIIA期、PD-L1在≥1%肿瘤细胞上表达的NSCLC患者。
研究结果显示,在进行中期DFS分析时,研究显示PD-L1≥1%、II - IIIA期患者的DFS有统计学显著改善。
具体试验结果如下:在对II-IIIA期人群中位随访32.2个月后,与最佳支持治疗相比,Tecentriq显著延长了无病生存。
在PD-L1表达≥1%的II-IIIA期患者中,中位DFS为尚未达到(NR) VS 35.3个月;但与最佳支持治疗相比,Tecentriq治疗组使疾病进展或死亡风险降低34%(HR= 0.66)。
在PD-L1表达为1~49%的II - IIIA期患者中,中位DFS为32.8个月 VS 31.4 个月(HR=0.87)。
在PD-L1表达≥50%的II-IIIA期患者中,中位DFS为尚未达到 VS 35.7个月,Tecentriq治疗组的死亡风险降低57%(HR=0.43)。
探索性分析中,在II-IIIA期患者中,大多数患者亚组中都能普遍看到Tecentriq的无癌生存优势。
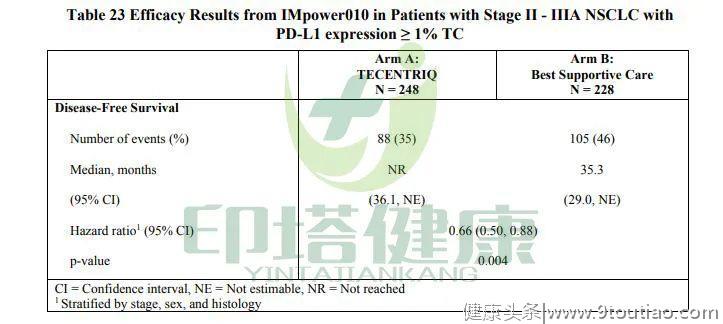 图注:Tecentriq辅助治疗II至IIIA期非小细胞肺癌的临床数据
图注:Tecentriq辅助治疗II至IIIA期非小细胞肺癌的临床数据 图注:PD-L1表达≥1%的II - IIIA期NSCLC患者的无病生存期的Kaplan-Meier
图注:PD-L1表达≥1%的II - IIIA期NSCLC患者的无病生存期的Kaplan-Meier不良反应
Tecentriq治疗组最常见的任何级别的不良反应包括:皮疹(17%)、咳嗽(16%)、甲状腺功能减退(14%)、发热(14%)、乏力(14%)、肌肉骨骼疼痛(14%)、周围神经病变(12%)、关节痛(11%)、皮肤瘙痒(10%)。
最常见的3~4级不良反应包括:皮疹(1.2%)、发热(0.8%)、肌肉骨骼疼痛(0.8%)、乏力(0.6%)、关节痛(0.6%)、周围神经病变(0.4%)。
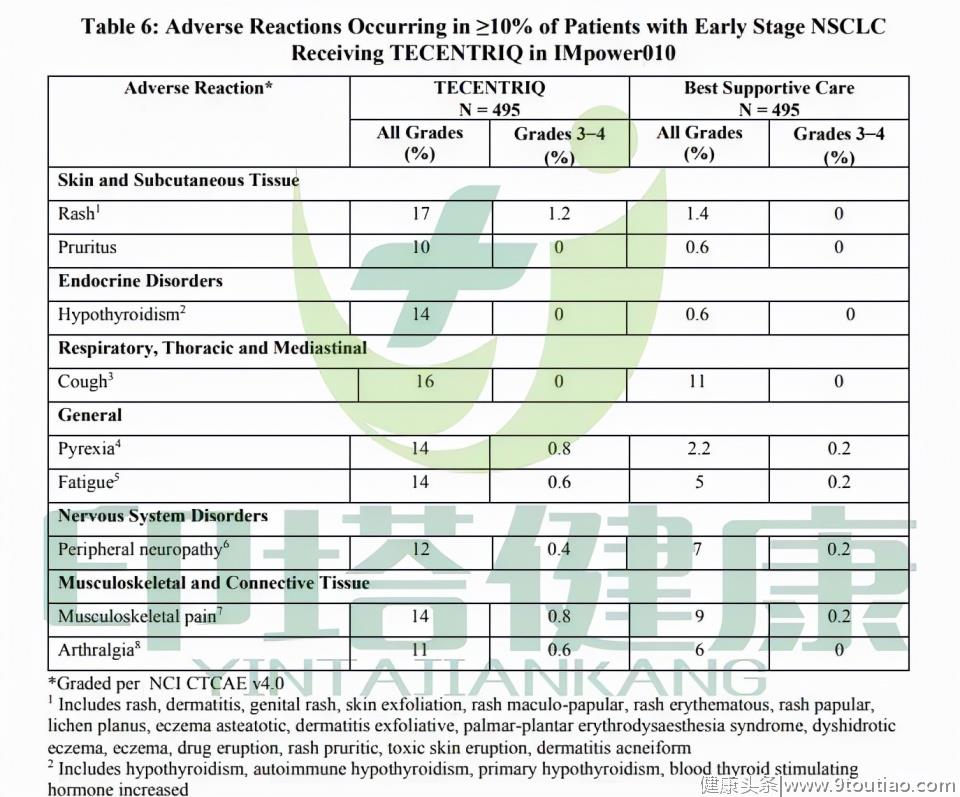 图注:Tecentriq辅助治疗II至IIIA期非小细胞肺癌的不良反应
图注:Tecentriq辅助治疗II至IIIA期非小细胞肺癌的不良反应Tecentriq治疗组最常见的任何级别的实验室异常数据包括:天冬氨酸转氨酶升高(34%)、血肌酐增加(31%)、丙氨酸转氨酶升高(30%)、高钾血症(24%)。
最常见的3~4级实验室异常数据包括:高钾血症(3.5%)、丙氨酸转氨酶升高(3.3%)、天冬氨酸转氨酶升高(2.5%)、血肌酐增加(0.2%)。
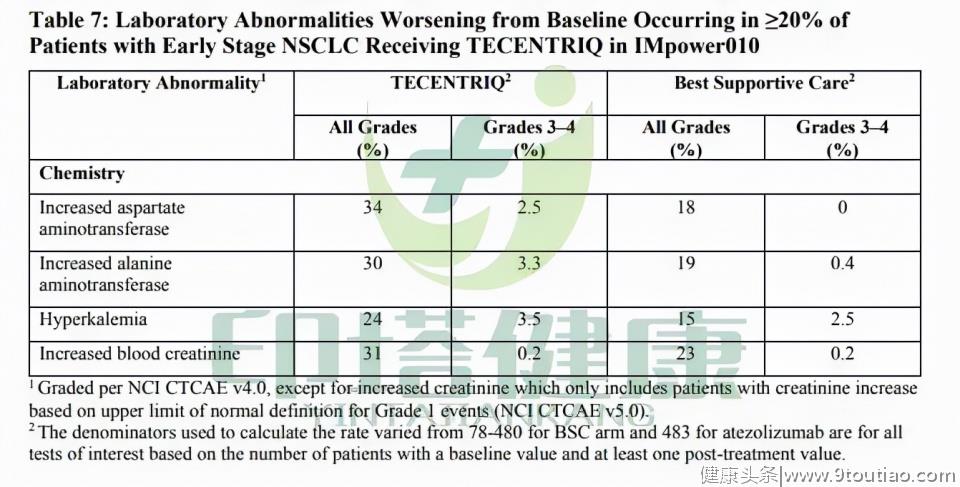 图注:Tecentriq辅助治疗II至IIIA期非小细胞肺癌的实验室异常数据
图注:Tecentriq辅助治疗II至IIIA期非小细胞肺癌的实验室异常数据警告和注意事项
免疫介导性肺炎
免疫介导性结肠炎
免疫介导性肝炎
免疫介导性内分泌病
伴有肾功能障碍的免疫介导肾炎
免疫介导的皮肤病不良反应
其他免疫介导的不良反应
输注相关反应
PD-1/PD-L1抑制剂后异体造血干细胞移植的并发症
胚胎毒性