免疫检查点抑制剂治疗癌症的十年
使用免疫检查点调节剂的免疫疗法彻底改变了肿瘤学领域,远远超过了它们在某些病人身上的显著疗效。它在评估治疗效果和毒性方面产生了根本性的变化,对癌症患者有了更全面的视野。
1 肿瘤免疫疗法的复兴
过去十年来,癌症治疗中最重要的成就无疑是引入靶向T细胞的免疫调节剂来阻断免疫检查点CTLA-4和PD(L)1。2011年,第一个阻断免疫检查点(CTLA4)的抗体ipilimumab被批准。紧随其后的是针对PD1(pembrolizumab and nivolumab)和PDL1(atezolizumab and durvalumab)的单克隆抗体。
抗PD1 /PDL1抗体已经成为某些最广泛的处方抗癌疗法。目前,以T细胞为靶标的免疫调节剂以单一或与化疗联合使用方式,已成为约50种癌症类型的一线或二线治疗手段。有超过3000项的相关临床试验正在进行,占所有肿瘤学临床试验的约2/3。
调节T细胞活性的共刺激和共抑制配体受体配对的简化视图
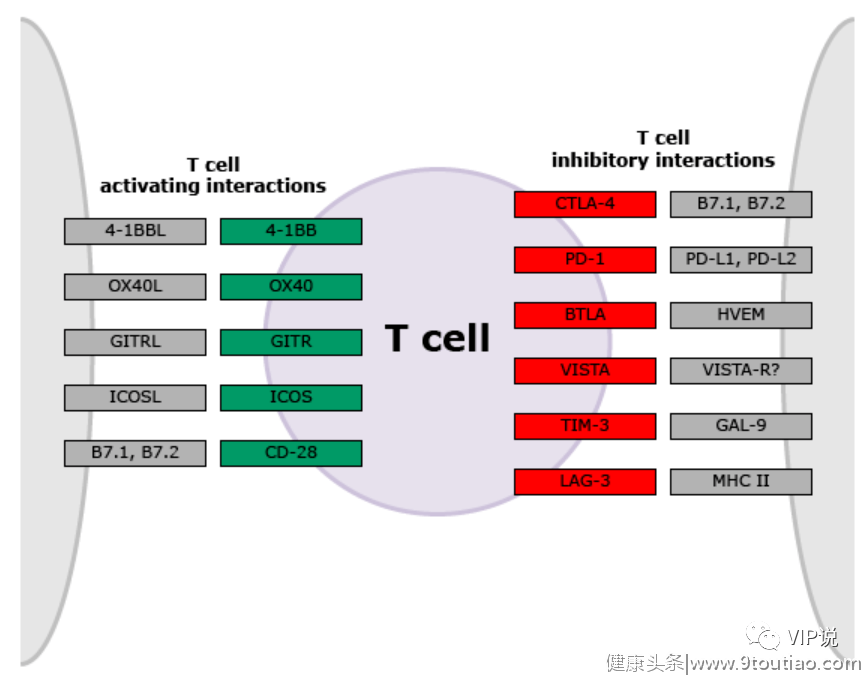
然而,十年前,在免疫检查点抑制剂(ICI)时代尚未来临之时,实体肿瘤免疫疗法其实处于一个较为严峻的状态。当时免疫疗法主要基于免疫细胞因子如:白细胞介素2或α-干扰素,其效果不佳并且毒性很高。临床试验还开展了多种形式的癌症疫苗研究,但这些疫苗大多无效,因此免疫疗法在当时的国际肿瘤学会议上的听众越来越少,而与新兴的靶向治疗领域有关的会议却四处满溢。
但是,在ICI免疫疗法取得首个成功之后,直到今天,情况发生了逆转,免疫疗法引领了这一领域,免疫学家重新获得了对癌症研究的重大影响,正如2018年诺贝尔医学奖授予的两位免疫学家James Allison和Tasuku Honjo阐述的那样,也正是他们开启了基于ICI免疫治疗的概念。
肿瘤免疫编辑、免疫激活和检查点抑制
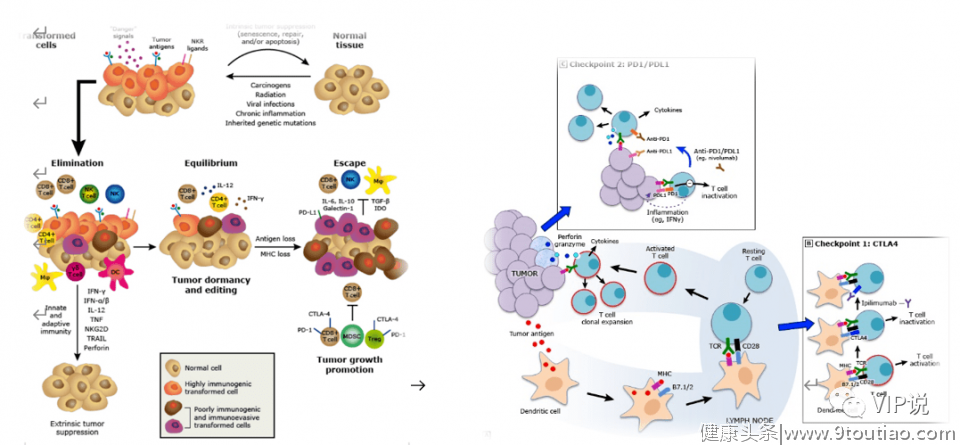
2 癌症治疗的全新视野
免疫治疗的这份荣誉毫无疑问是由于ICI带来的在某些侵袭性癌症的治疗中的巨大临床进展,如转移性黑色素瘤这一ICI疗效被首次证实的癌种。ICI疗法在某些患者中已经远远超出了其显著疗效,并以多种方式革新了肿瘤学领域,它改变了医生评估疗效或处理不良事件的方式。除单纯的癌细胞外,它还使人们对癌症患者有了更全面的认识,并在免疫学家,肿瘤学家和其他器官专科医生之间产生了新的富有成果的互动。
确实,依靠通过激活宿主免疫系统来破坏癌症的免疫疗法取得的成功,使人们对癌症有了更完整的认识。现在,不仅靶向杀死肿瘤细胞被考虑,同时癌症的免疫微环境也被考虑在内。我们目前已完全意识到对培养的癌细胞系和免疫功能低下的动物进行的药物常规临床前试验的意义并不大,后者完全忽略了免疫系统。现在,使用具有免疫功能的动物的新的、更可靠的临床前模型已得到更广泛的使用。
现在,用于转化和临床研究的新工具包括了免疫参数,例如肿瘤浸润T细胞的存在和活化状态,免疫检查点PD-L1的表达或肿瘤突变负荷(TMB)的评估。有趣的是,TMB----代表每MB肿瘤基因组区域中包含的体细胞非同义突变的总数,既往显示大多与化疗或靶向治疗的耐药性相关,而现在却相反,来自肿瘤细胞的高突变情况似乎是治疗应答的有利因素。
这就是为什么肺癌患者中吸烟人群比非吸烟人群的免疫治疗应答效果更好,前者有更多的体细胞突变,而后者通常是低TMB状态。高TMB与免疫治疗反应之间的相关性使得抗PD1药物被授权用于错配DNA修复缺陷(微卫星不稳定性)和高突变的癌症。这是癌症治疗史上罕见的例子---根据生物肿瘤学机制特性批准药物,而无关肿瘤类型。
即使在转移灶的大小最初增加之后,ICI免疫疗法仍可以诱导延迟的肿瘤反应。这样的假进展可能是由于免疫疗法的功效延迟或免疫细胞的最初的集中而导致暂时性肿瘤尺寸增加。
因此,用于通常监测化学疗法或靶向疗法反应的常规标准的放射学评估标准(RECIST-1.1)已经不适用这些新的反应动力学表现。新的评估标准指南,包括延期以确认或反对肿瘤增加的情况,已经纳入了iRECIST (immune RECIST)评价体系。
imRECIST、 RECIST v1.1 和 irRC之间的比较
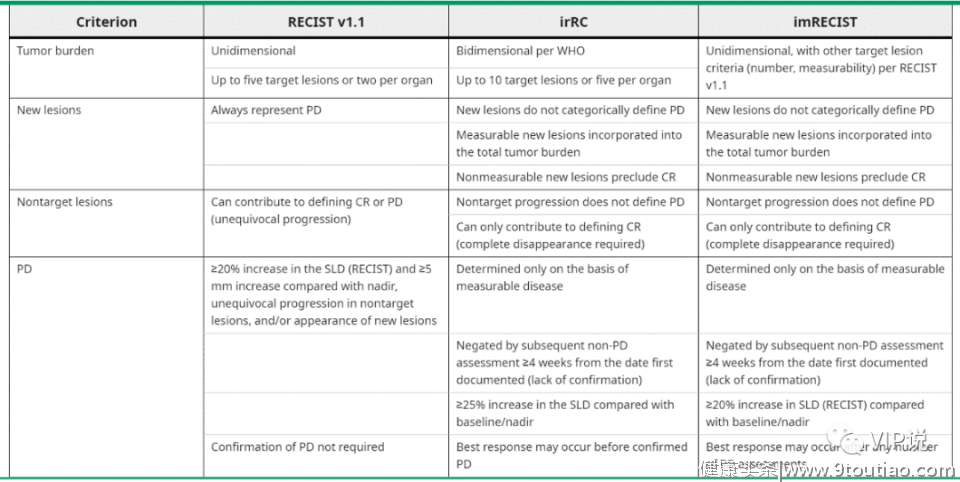
我们还必须修改评估ICI的临床试验的主要终点。ICI的益处无法通过经典终点(例如中位无进展生存期,缓解率或危险比(HR))正确地体现出来,因为ICI对不定比例的长期幸存者(平稳期或数据曲线尾部)可能存在延迟效应。在晚期时间点的OS率或PFS率(具有里程碑意义的分析)或限定的中位生存时间(测量从0到指定时间的平均生存时间)的分析更适合于ICI免疫疗法。
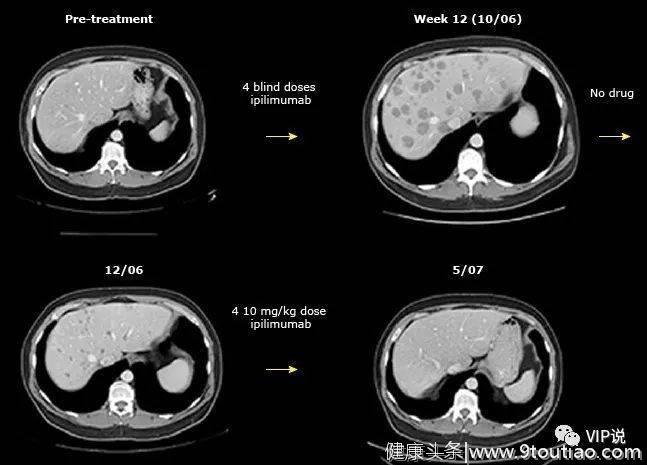
对ipilimumab治疗的延迟反应:该转移性黑素瘤患者在基线时肝脏无明显病灶。经过四次伊匹木单抗治疗后,明显可见许多病变,通常认为其进展。但是,两个月后,在没有药物的情况下,这些病变逐渐消退。在再加四次伊匹木单抗后,患者完全缓解。
另一个重大变化与免疫疗法相关的不良事件类型有关。毫不奇怪,它们与以前的治疗,细胞毒性或靶向治疗等疗法完全不同。由于ICI的作用机制依赖于抑制免疫激活的生理制动作用,因此它们通常具有脱靶效应,从而导致免疫介导的各种器官或组织炎症。
治疗相关的广泛而全新的副作用,被称为免疫介导的或免疫相关的疾病,看起来像自身免疫性疾病,例如自身免疫性甲状腺炎,最终导致永久性甲状腺功能减退症或炎症性肠病等。它们有时可能很严重,尤其是当抗CTLA和抗PD1组合使用时,会产生高达60%的3-5级不良事件。
尽管罕见,免疫治疗相关的死亡事件也存在,例如心肌炎,脑炎、严重的垂体炎等,他们不容易被诊断出来,并且需要高剂量的类固醇或强效免疫抑制剂治疗。这种新的不良事件谱要求治疗的肿瘤科医生与各种器官专科医生以及内科医生之间进行快速有效的互动,以优化各种免疫相关不良事件的管理。
与检查点抑制剂相关的垂体炎(抗CTLA-4治疗前及症状发作后的MR矢状图)
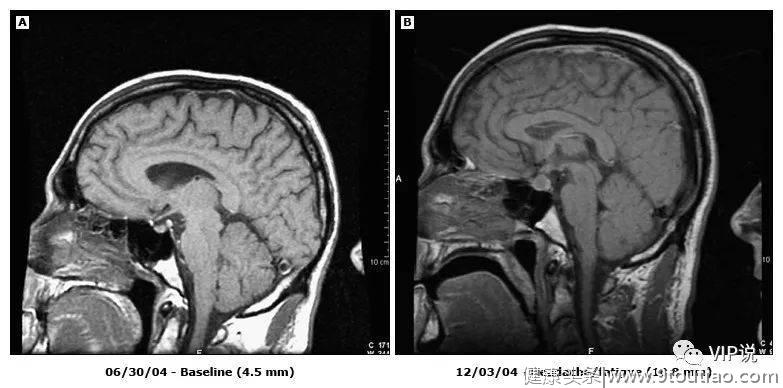
3 治愈癌症的希望,但目前是少数患者
ICI的成功之处中最令人印象深刻一块是:在治疗中断后存在长期缓解的情况,这为某些患者增加了治愈希望。尤其在黑色素瘤患者中,有相关数据证实,患者可以实现完全缓解,也就是说所有可见转移灶都完全消失,这些接受PD-1联合或不联合抗CTLA-4治疗的黑色素瘤患者大约占20%。
现在已经普遍接受的是,对于此类患者,至少经过6个月的治疗可考虑停止治疗,因为据5年随访统计,其复发风险小于10%。而在ICI时代之前,如此长时间的完全缓解是完全不可想象的。但是,并非所有类型的癌症都能像黑色素瘤那样响应,因此关于停止治疗的可能性数据对于其他癌症而言尚不成熟。
同样在黑色素瘤这个导致ICI发展的领域,证实1年的抗pd1辅助治疗可降低手术切除局部淋巴结转移后的复发风险(III期)。在其他类型的癌症中,如肺癌,ICI目前作为辅助疗法被评估。对患者和医生而言,一项重大变化是基于以下事实:不良事件对转移性癌症患者或接受辅助治疗以降低复发风险的患者的影响并不相似。
在后一种情况下,必须谨慎评估引起严重或永久性副反应的可能性。例如,在转移性疾病的背景下,接受抗PD1治疗的患者中高达10%的甲减的风险被认为是可以接受的,而在辅助治疗的情况下,必须一直接受激素替代治疗直至生命终结的10%的风险必须与预期的治疗收益相平衡。
患者对癌症免疫疗法的态度通常是积极的,他们对于通过自己的免疫系统来对抗癌症的想法是重视的。由于这种对治疗策略的认可,患者在治疗开始阶段会更积极,并且可以促进患者与医生之间的交流。
一种反作用是免疫疗法在某种程度上是其自身成功的受害者。这种治疗策略在患者和公众中的吸引力,通过简化和精致的媒体报道得到了增强,这使得人们存在过高的期望值,因此当ICI治疗无法达到预期是,患者会深感失望,毕竟这些患者目前仍然占多数。
4 结论
最终,免疫疗法花了很长时间才能才在热门抗癌药物中占有一席之地。过去十年来,ICI终于以前所未有的发展开发并被获批用于多种癌症类型。尽管迈出了一大步,ICI仍未从根本上解决癌症的治疗问题。使用免疫检查点免疫疗法,已经打开了一扇门,但案例还未结束。
我们希望在未来的十年中,能够找到预测ICI疗效和毒性的生物标志物,并结合药效学参数来优化ICI方案和新的联合手段。
参考文献
- Robert C. A decade of immune-checkpointinhibitors in cancer therapy. Nat Commun. 2020 Jul 30;11(1):3801.
- 本文来自VIP说,作者绿竹猗猗。