肺癌5年生存率增加420%!价格全球最低!PD-1/PD-L1抑制剂中国上市信息汇总
作为免疫治疗中最重要的治疗方式之一,PD-1/PD -L1抑制剂一直是人们研究的重中之重,其在临床治疗中也发挥了巨大的作用。
通过阻断癌细胞抑制免疫系统功能的PD-1/PD-L1 抑制剂通路,可以有效的帮助免疫细胞恢复正常的杀伤作用,从而消灭癌症。在此前一项关于PD-1抑制剂的长效随访观察数据显示,和常规的疗法相比,在标准剂量下接受治疗的患者5年生存率增加了420%!
今天,就让我们一天来盘点下已经获批的免疫检查点抑制剂疗法。截止到2020年12月底,全球一共上市了10款PD-1/PD-L1抑制剂疗法,美国共计有6款获批,在国内共计有4款国产药物以及4款美国已经获批的药物。
而伴随着新一轮医保谈判的结果,4款国产PD-1抑制剂全部纳入医保,随之而来的就是价格的大幅度下降,除了此前已经进入医保的信迪利单抗(价格为2843元/10ml)之外,根据此前路透社的报道,剩下的3款国产PD-1都给出了此次的医保谈判价格:
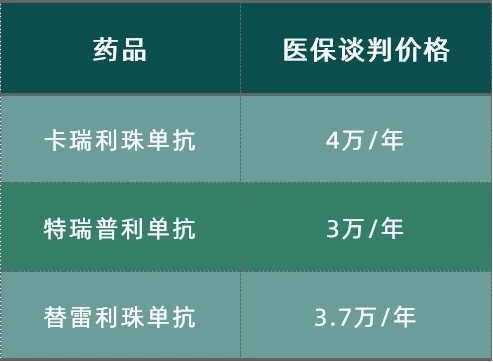
价格来源:路透社
伴随着全国集采的进行,可以说所有的PD-1抑制剂都迎来了巨幅的降价,相信随着最终价格的落地,免疫治疗将迎来全面开花的时代。
话不多说,就让我们一起来详细了解下中国上市的PD-1/PD-L1的信息。
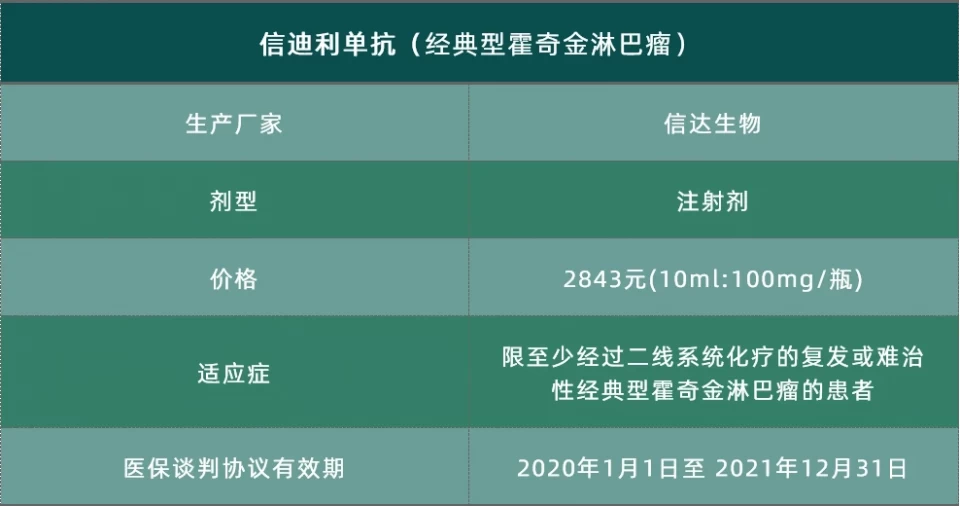
信迪利单抗——经典型霍奇金淋巴瘤
2018年12月27日,达伯舒(重组全人源抗PD-1单克隆抗体,国际商标:Tyvyt,化学通用名:信迪利单抗注射液)正式获得国家药品监督管理局的批准,用于至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤的治疗。
2019年11月28日,达伯舒(信迪利单抗注射液)被列入新版《国家基本医疗保险、工伤保险和生育保险药品目录(2019年版)》乙类范围。
自2018年开始,信迪利单抗也开始进行多种肿瘤的治疗研究:
非小细胞肺癌;
晚期恶性神经内分泌肿瘤;
鳞状非小细胞肺癌;
食管鳞癌;
胃癌或胃食管交界处细胞癌
晚期肝细胞癌;
复发/难治性结外 NK/T细胞淋巴瘤;
非鳞非小细胞肺癌等。
2020年8月12日,国家药品监督管理局(NMPA)已经正式受理双方共同开发的创新PD-1抑制剂达伯舒(信迪利单抗注射液)用于鳞状非小细胞肺癌(NSCLC)一线治疗的新适应症申请(sNDA)。在此之前,NMPA已于2020年4月23日正式受理达伯舒(信迪利单抗注射液)用于非鳞状NSCLC一线治疗的新适应症申请。
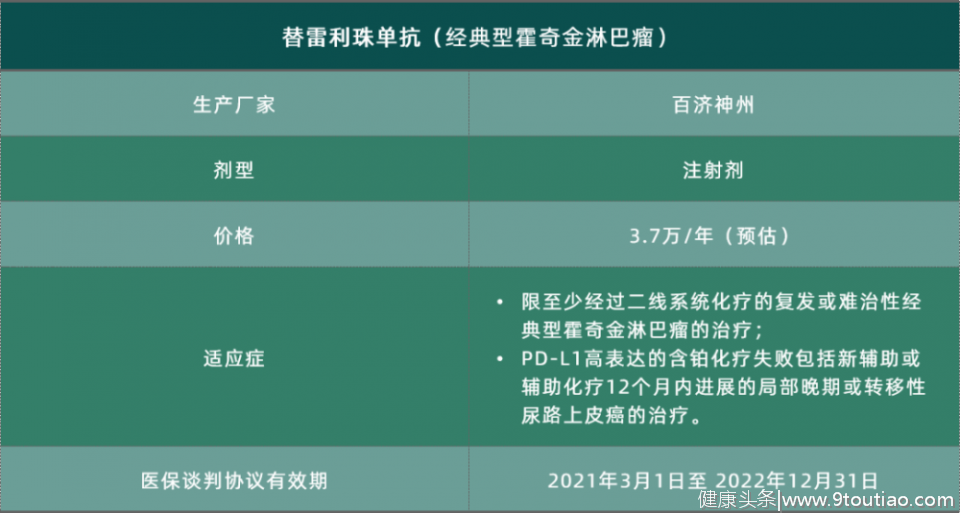
替雷利珠单抗——淋巴瘤、尿路上皮瘤
2019年,12月27日,国家药品监督管理局(NMPA)批准百济神州抗PD-1抗体药物百泽安(通用名:替雷利珠单抗注射液)用于治疗至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤(R/R cHL)患者。
2020年4月10日,百济神州替雷利珠单抗注射液新适应症获国家药监局批准,用于治疗局部晚期或转移性尿路上皮癌患者。
此外,替雷利珠单抗注射液也进行多种肿瘤的治疗研究:
肺癌;
胃癌;
食道癌;
胶质母细胞瘤;
乳腺癌;
卵巢癌;
肝癌等。
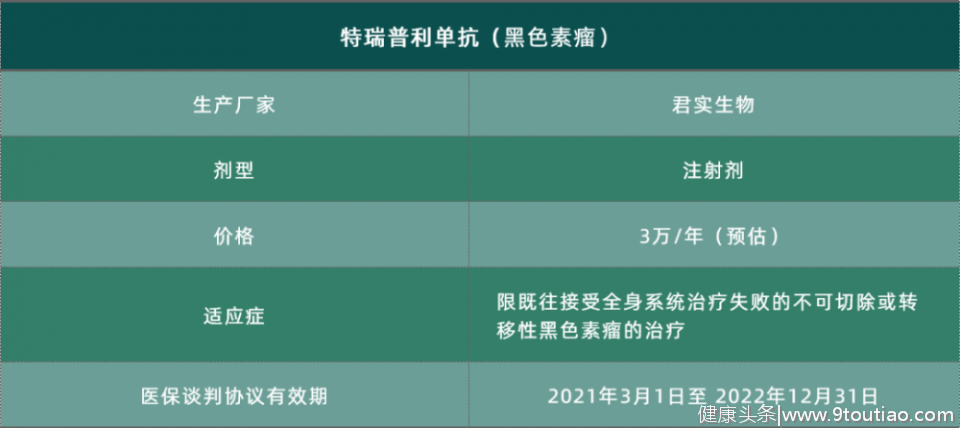
特瑞普利单抗——黑色素瘤
2018年12月17日,君实生物的特瑞普利单抗注射液获国家药品监督管理局(NMPA)批准上市,用于既往接受全身系统治疗失败的不可切除或转移性黑色素瘤的治疗,成为我国首个自主研发的肿瘤免疫治疗药物PD-1单抗。
2020年3月27日,特瑞普利单抗(商品名:拓益,产品代号:JS001)联合阿昔替尼治疗黏膜黑色素瘤于近日获得美国食品药品监督管理局(FDA)孤儿药资格认定。
2020年4月29日,国家药品监督管理局(NMPA)受理特瑞普利单抗(商品名:拓益)用于治疗既往接受过二线及以上系统治疗失败的复发/转移性鼻咽癌(NPC)患者的新适应症上市申请。
2020年5月7日,国家药品监督管理局(NMPA)受理特瑞普利单抗(商品名:拓益)用于治疗既往接受过治疗的局部进展或转移性尿路上皮癌(UC)患者的新适应症上市申请。
2020年9月10日,特瑞普利单抗(拓益)治疗鼻咽癌已于近日获得美国食品药品监督管理局(FDA)突破性疗法认定(Breakthrough Therapy Designation),也是首个获得FDA突破性疗法认定的国产抗PD-1单抗。
2020年9月17日,特瑞普利单抗(拓益)用于治疗软组织肉瘤获得美国食品药品监督管理局(FDA)授予的孤儿药资格认定(Orphan-drug Designation)。
除此之外,特瑞普利单抗还在进行的癌种治疗包括:
非小细胞肺癌;
小细胞肺癌;
三阴性乳腺癌;
食管癌;
肝细胞癌等。
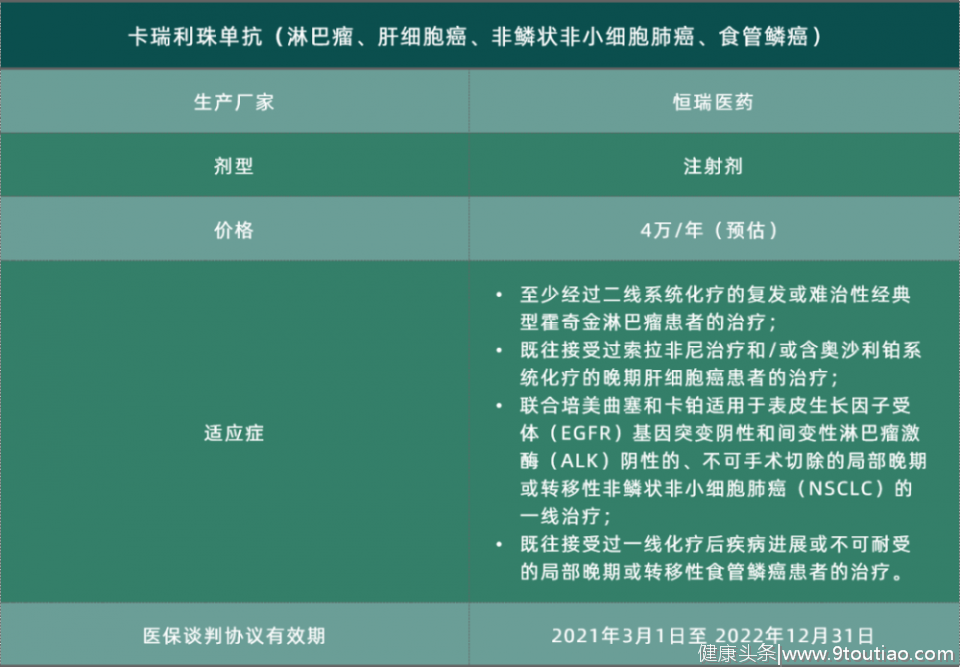
卡瑞利珠单抗——淋巴瘤、肝细胞癌
非鳞状非小细胞肺癌、食管鳞癌
2019年5月,恒瑞医药艾瑞卡(卡瑞利珠单抗)获批用于复发/难治性霍奇金淋巴瘤的三线治疗。
2020年3月,卡瑞利珠单抗获批用于接受过索拉非尼治疗和/或含奥沙利铂系统化疗的晚期肝细胞癌患者。
2020年6月,卡瑞利珠单抗获批联合化疗药培美曲塞和卡铂,一线治疗晚期或转移性非鳞非小细胞肺癌。
2020年6月,卡瑞利珠单抗获批单药治疗一线化疗失败的晚期或转移性食管鳞状细胞癌。
2020年8月13日,恒瑞医药艾瑞卡(卡瑞利珠单抗)联合顺铂和吉西他滨一线治疗局部复发或远处转移鼻咽癌研究;
2020年9月15日,卡瑞利珠单抗联合苹果酸法米替尼胶囊或安慰剂与培美曲塞和卡铂一线治疗晚期或转移性非鳞状非小细胞肺癌患者研究;
2020年10月23日,卡瑞利珠单抗联合阿帕替尼被批准用于肝细胞癌(HCC)根治性手术或消融后伴高复发风险人群辅助治疗的随机对照、开放、多中心III期临床研究;
2020年11月12日,卡瑞利珠单抗联合顺铂和吉西他滨用于局部复发或转移性鼻咽癌患者的一线治疗注册申请获国家药品监督管理局受理,并被国家药品监督管理局药品审评中心纳入拟优先审评品种公示名单;
2020年11月25日,卡瑞利珠单抗与苹果酸法米替尼胶囊联合疗法被国家药品监督管理局药品审评中心纳入拟突破性治疗品种公示名单,用于治疗经过一线级以上治疗失败的复发转移性宫颈癌患者;
2020年12月16日,卡瑞利珠单抗(艾瑞卡)联合紫杉醇和顺铂用于晚期食管癌一线治疗的一项随机、双盲、安慰剂对照、多中心III期临床研究(ESCORT-1st)主要研究终点结果达到方案预设的优效标准;
2020年12月16日,卡瑞利珠单抗(艾瑞卡)联合化疗用于晚期或转移性鳞状非小细胞肺癌患者一线治疗的III期临床研究(SHR-1210-III-307)的主要研究终点结果达到方案预设的优效标准,研究结果表明,卡瑞利珠单抗联合化疗用于晚期或转移性鳞状非小细胞肺癌患者一线治疗,可显著延长患者的无进展生存期;
2020年12月19日,全球顶尖学术期刊《柳叶刀-呼吸医学》(《THE LANCET Respiratory Medicine》)全文在线发表“卡瑞利珠单抗联合卡铂和培美曲塞对比单纯化疗一线治疗晚期非鳞非小细胞肺癌的随机、开放、多中心、III期临床试验(CameL研究)”的研究成果。该研究的中位总生存期长达27.9个月,这一数据是截至目前全球同类肺癌免疫治疗临床研究中最长的生存获益数据,成功突破了2年大关。
目前来说,卡瑞利珠单抗是目前国产PD-1抑制剂中获批最多的一个,同时也是本次医保目录内适应症最多的一个。
国内已上市非国产PD-1/PD-L1抑制剂
截止到2020年底,国内获批上市的非国产的PD-1/PD -L1抑制剂一共有四款,包括2款PD-1抑制剂和2款PD-L1抑制剂。
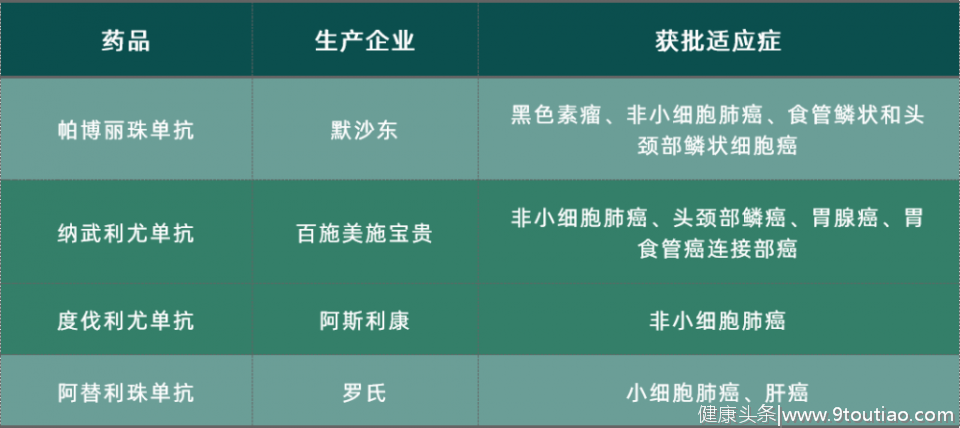
虽然本次医保谈判非国产PD-1抑制剂都没有进入目录,但是随着国产药物的大面积降价,也给非国产PD-1/PD -L1抑制剂带来了极大的压力。
伴随着医保谈判的结束,K药也宣布了自己新一轮的赠药政策:
从2021年1月1日起,患者只需要自费4个疗程花费14万,就可以获得K药全程的援助——也就是说用药满2年14万封顶,此后可获得增药,也就是单年7万元人民币即可。
伴随着K药宣布自己的赠药政策,O药也随机推出了自己的赠药政策。相信随着医保政策的继续推进,PD-1/PD -L1 抑制剂的价格将会走进更多癌症家庭。
随着免疫治疗的发展,除了PD-1/PD -L1 抑制剂之外,这一年CAR-T细胞疗法也迎来了蓬勃发展的1年。在下一篇内容中我们将为大家带来年度CAR-T疗法盘点。