釜底抽薪,姜学军团队证实铁死亡是治疗癌症的有力方式
撰文|王聪
铁死亡(Ferroptosis)是一种铁离子催化的坏死性细胞死亡。其特征是当细胞内还原系统失活后细胞膜或细胞器膜上含不饱和脂肪酸长链的磷脂分子被过氧化破坏,造成细胞膜破裂。这种细胞死亡形式于2012年命名为铁死亡。
铁死亡受到细胞内信号通路的严密调控,铁死亡主要由谷胱甘肽过氧化物酶4(GPX4)调控,一旦GXP4异常,就会导致细胞抗氧化能力降低、活性氧堆积、最终引起细胞铁死亡。
铁死亡与帕金森病、胰腺癌、糖尿病并发症、肾功能衰竭、心脑血管疾病等多种疾病相关,并发现可以通过激活或抑制铁死亡来干预疾病的发展,因此铁死亡成为近年来的研究热点。
众所周知,癌细胞生长旺盛、分裂繁殖能力更强,因此对代谢的需求也更强,但这一特点也为消灭它们提供了线索。使癌细胞能够应对氧化应激的基因突变,使它们更耐铁死亡,如果没有这些突变,癌细胞对铁死亡可能非常敏感。
癌细胞繁殖速度快,这大大增加了对代谢的需求,PI3K-AKT-mTOR通路调控代谢,而该通路也是在癌症中最常见的突变之一,同时,PI3K-AKT-mTOR通路突变的癌症也是最难治疗的癌症类型之一。
近日,美国纪念斯隆凯特琳癌症中心姜学军教授团队在《美国科学院院刊》(PNAS)发表了题为:Oncogenic activation of PI3K-AKT-mTOR signaling suppresses ferroptosis via SREBP-mediated lipogenesis 的研究论文【1】。
研究团队发现,癌细胞经常表现出的代谢改变,使它们易受到铁死亡(Ferroptosis)这种特殊细胞死亡类型的影响,研究团队发现组合使用阻断PI3K-AKT-mTOR通路药物和诱导铁死亡药物,能够显著破坏并清除肿瘤。

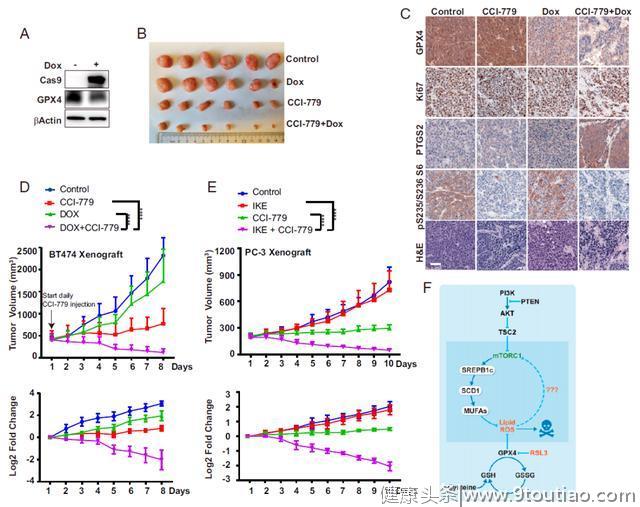
研究团队发现,在体外细胞实验中,具有PI3K-AKT-mTOR通路突变的肿瘤细胞显示出对诱导细胞铁死亡药物的强抗药性。
接下来,研究团队将阻断PI3K-AKT-mTOR通路的药物和诱导细胞铁死亡的药物组合使用,则这些癌细胞就会死亡。
然后,研究团队在包含PI3K-AKT-mTOR通路突变的乳腺癌和前列腺癌的小鼠模型中进行验证,实验结果表明,这两种药物组合使用能够几乎完全破坏并清除小鼠体内的肿瘤。
面对这一实验结果,该研究的通讯作者姜学军教授表示,这是自己实验室中前所未见的最显著的肿瘤消退。
研究团队进一步表明,突变的PI3K-AKT-mTOR通路,能够增加参与细胞膜脂质合成的蛋白的活性,从而增加细胞膜脂质,保护细胞免受铁死亡。而阻断PI3K-AKT-mTOR通路,就可以釜底抽薪,阻止脂质过多合成,并使细胞对铁死亡敏感。
2019年7月24日,姜学军团队等在 Nature 杂志发表论文,发现Hippo通路中的某些基因突变会使得细胞对铁死亡更加敏感,为通过铁死亡进行癌症治疗提供了新的研究方向。

PNAS的这项研究,是对上述Nature论文的补充和发展,许多癌症中的基因突变,与细胞对铁死亡的敏感性有关,因此,可以利用这些突变出发铁死亡,从而杀死癌细胞,这有望成为一种新的、令人兴奋的癌症治疗方法。

论文第一作者 Yi Junmei(左)及通讯作者姜学军(右)
据悉,姜学军教授团队已经申请了与该研究相关的专利,下一步将对来自纪念斯隆-凯特琳癌症中心接受治疗的癌症患者的肿瘤样本进行药物组合测试。
论文链接:
1、https://www.pnas.org/content/117/49/31189
2、https://www.nature.com/articles/s41586-019-1426-6