禁食能治疗癌症吗?还真有可能!

文丨癌度医学部
民以食为天,但饮食大有学问,膳食的质和量决定了你个人的健康, 你儿女和你孙儿女的健康。
现在医学研究新发现,禁食(fasting)或禁食模拟饮食法(fasting mimicking diet, FMD)竟然可以提升癌症放/化疗效果,减轻副作用。
科学家说的“禁食”疗法类似某些宗教奉行的“斋戒”习俗,信徒每天日出到日落期间禁止饮食,据说是为了净化身体。从生物医学角度来看,禁食本质就是卡路里限制或者限制特定食物成分配比,用大白话说就是短期内不吃或少吃。
禁食怎么就和放/化疗治疗扯到一块了呢?禁食怎么就能让癌症化疗事半功倍呢?
意大利FITC分子癌症研究所的Irene Caffa和她同事做了这样一个实验,将几种不同的实体瘤细胞株,包括非小细胞肺癌细胞HCC827和H3122、乳腺癌细胞BT474和SKBR3、肠癌细胞HCT116“饥饿培养“24小时后, 加入相应的化疗药物,3天后检测细胞存活率。
结果发现, 饥饿+化疗联合应用能将某些癌细胞杀伤率提高1~4倍! 在小鼠癌症模型中同样有效。
实验所用的药物特罗凯(erlotinib)、易瑞沙(gefitinib)、拉帕替尼(lapatinib)和格列卫(imatinib)等是靶向药,临床上广泛用于HER2或EGFR突变的癌症治疗。Changhan Lee和其同事在17种不同种类的癌细胞和7种小鼠的不同癌症模型亦证明禁食和化疗联用功效显著增加,其中15种肿瘤的化疗效果,明显高于单独使用化疗组,肿瘤体积缩小,体重增加。说明禁食后的癌细胞而不是正常细胞显然更容易被化疗所杀死。图1就概括说明了禁食+放/化疗的优势所在。
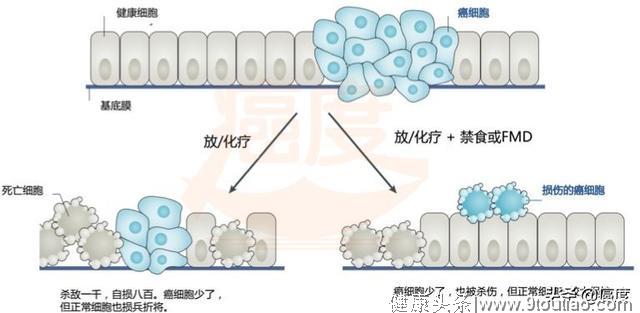
图1. 示意图说明禁食在放/化疗中的好处。正常细胞损伤程度减低,增加化疗对癌细胞的杀伤力
(该图改编自参考文献7)
说到癌症治疗,临床医生基本采用化疗、放疗、手术和免疫治疗这几类手段或其组合,无论何种治疗策略,常见的头疼问题是疗效差强人意或/和伤及无辜细胞的毒副作用。
既然禁食对放化疗的增强作用已经在很多细胞或小鼠癌症模型中得到确认,那么,“禁食+ 放化疗“方案在临床癌症治疗中究竟效果如何呢?由于该癌症治疗策略新颖,到目前为止,只有4篇正式公开发表的结果,研究结论总结在如下表格1。
表1. “禁食 + 放化疗“方案在临床癌症治疗先导性研究结果
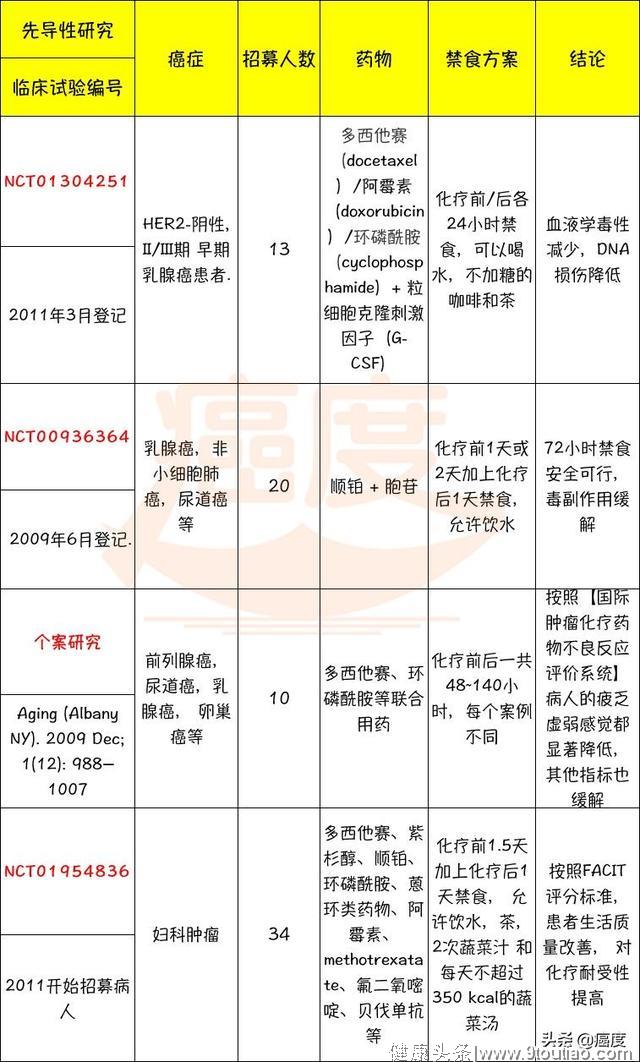
由此看来,禁食让癌细胞对放/化疗更敏感,提高正常细胞如造血干细胞,免疫细胞抵抗放/化疗毒副作用的能力,病人的生活质量改善明显。
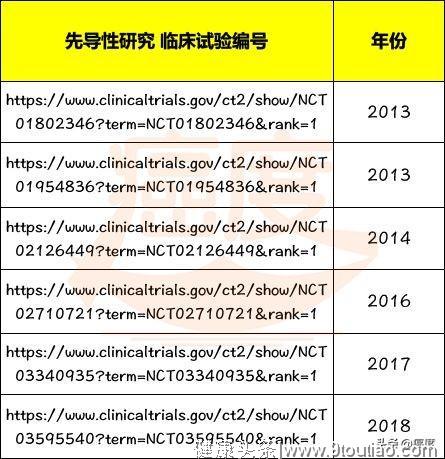
另外有6个关于禁食和癌症的临床试验正在美国和欧洲的医院进行当中,招募的病人数扩大至300人,最快今年将报道部分结果(表2)
美国南加州大学的Longo VD教授是禁食与癌症治疗领域的先锋,2018年11月他受邀在Nature Reviews,Cancer子刊(影响因子43)上发表了综述文章,阐述了禁食增强放/化疗功效,提升患者生存质量的细胞分子生物学机理:
1)从整体上看,禁食或FMD导致血液中的葡萄糖、胰岛素样生长因子1(IGF1)、胰岛素、瘦素水平降低;脂联素adiponectin和酮体的水平升高;能量代谢通路IGF1R–AKT–mTOR–S6K 和cAMP–PKA被抑制;
2)饥饿诱导正常细胞和癌细胞压力抗性差别。饥饿刺激下,正常细胞下调细胞增殖速度迫使细胞进入“维持模式”从而更能“容忍”放/化疗的伤害;
3)癌细胞增殖无度,营养索求无度,氧化应激能力缺失,对放/化疗敏感性增加;
4)禁食刺激淋巴细胞前体细胞扩增,促进机体对抗癌细胞的免疫反应。
简而言之:禁食使疯狂扩张的癌细胞脆弱,放/化疗再临门致命一击,癌细胞崩溃。
特别需要注意的是,这一疗法也与早先的阻止癌组织的血管生成从而“饿死癌细胞”的理念有着根本的不同,本文介绍的禁食和放/化疗的联合应用是新颖的临床癌症治疗策略,其出其不意的辅助疗效已经引起广泛注意,虽然迄今正式公开发表的临床研究只有4例,更多的临床和基础研究工作正在开展,希望给患者带来更多的好消息。
该治疗方案实施过程中最为关切的问题是禁食或FMD可能导致的患者营养不良和可适用的癌症范围,癌症患者切记不可擅自采用禁食措施,请务必听从医生的指导。
其实, 短期禁食或卡路里限制的益处早就有系统研究报道,小到酵母,线虫、果蝇、小鼠,大到人类,每日减少20-40%的卡路里摄入已证实能提高机体抗氧化应激压力,延长寿命。
在癌症高发的现代社会,禁食还能帮助癌症治疗, 老话说“病从口中入”不无道理, 无论从什么角度看,是时候好好管住自己的嘴了。
——————
参考文献
[1] J.E. Cropley, S.A. Eaton, A. Aiken, P.E. Young, E. Giannoulatou, J.W.K. Ho, M.E. Buckland, S.P. Keam, G. Hutvagner, D.T. Humphreys, K.G. Langley, D.C. Henstridge, D.I.K. Martin, M.A. Febbraio, and C.M. Suter, Male-lineage transmission of an acquired metabolic phenotype induced by grand-paternal obesity. Mol Metab 5 (2016) 699-708.
[2] J. Day, S. Savani, B.D. Krempley, M. Nguyen, and J.B. Kitlinska, Influence of paternal preconception exposures on their offspring: through epigenetics to phenotype. Am J Stem Cells 5 (2016) 11-8.
[3] S. Di Biase, C. Lee, S. Brandhorst, B. Manes, R. Buono, C.W. Cheng, M. Cacciottolo, A. Martin-Montalvo, R. de Cabo, M. Wei, T.E. Morgan, and V.D. Longo, Fasting-Mimicking Diet Reduces HO-1 to Promote T Cell-Mediated Tumor Cytotoxicity. Cancer Cell 30 (2016) 136-146.
[4] S.P. Bauersfeld, C.S. Kessler, M. Wischnewsky, A. Jaensch, N. Steckhan, R. Stange, B. Kunz, B. Bruckner, J. Sehouli, and A. Michalsen, The effects of short-term fasting on quality of life and tolerance to chemotherapy in patients with breast and ovarian cancer: a randomized cross-over pilot study. BMC Cancer 18 (2018) 476.
[5] I. Caffa, V.D. Longo, and A. Nencioni, Fasting plus tyrosine kinase inhibitors in cancer. Aging (Albany NY) 7 (2015) 1026-7.
[6] C. Lee, L. Raffaghello, S. Brandhorst, F.M. Safdie, G. Bianchi, A. Martin-Montalvo, V. Pistoia, M. Wei, S. Hwang, A. Merlino, L. Emionite, R. de Cabo, and V.D. Longo, Fasting cycles retard growth of tumors and sensitize a range of cancer cell types to chemotherapy. Sci Transl Med 4 (2012) 124ra27.
[7] A. Nencioni, I. Caffa, S. Cortellino, and V.D. Longo, Fasting and cancer: molecular mechanisms and clinical application. Nat Rev Cancer 18 (2018) 707-719.
[8] R.S. Sohal, and R. Weindruch, Oxidative stress, caloric restriction, and aging. Science 273 (1996) 59-63.
[9] L. Bordone, and L. Guarente, Calorie restriction, SIRT1 and metabolism: understanding longevity. Nat Rev Mol Cell Biol 6 (2005) 298-305.
癌度为患者搜集到了参加临床试验的渠道,免费试用PD-1等靶向药物。
癌症患者和家属可以点击链接报名:癌度临床入组报名信息表