“抗癌神药”Keytruda在中国上市,一大波PD-1、PD-L1单抗在路上!
导读
继6月中旬首个PD-1抑制剂Opdivo在中国获批上市后,默沙东旗下PD-1单抗产品Keytruda也接踵“闪电”获批在中国上市。何时能用?效果如何?价格怎么样?无疑是Keytruda获批后,患者当下最为关心的问题。可以预见2018年下半年还会有更多PD-1及PD-L1单抗产品在中国市场崭露头角。
全文阅读大约需要5分钟,如果本文对您有任何启发,欢迎点击文末评论。
△图片来源:视觉中国
7月26日清晨,国家药品监督管理局更新消息,默沙东旗下PD-1单抗产品Keytruda(下称:帕博利珠单抗)正式获得批准在中国上市。自2月11日提交上市申请,到7月26日正式获批上市,帕博利珠单抗注射液5个多月时间快速批准上市,创下了目前为止中国进口抗肿瘤生物制剂最快审批纪录。
帕博利珠单抗注射液,英文商品名为Keytruda,中文商品名为齐内达(派姆单抗),学名为帕博利珠单抗(Pembrolizumab),是一种PD-1抑制剂药物,PD-1是一种重要的免疫抑制分子,癌细胞经常利用它来逃脱免疫细胞对自己的杀伤。而帕博利珠单抗作用机制则是打破癌细胞对PD-1的利用,抑制PD-1,激活免疫细胞,从而达到控制癌细胞的效果。
帕博利珠单抗此前已经在国外获批用于多种癌症治疗,而此次在中国获批的适应症则是获批最早、最为成熟的晚期黑色素瘤治疗,主要用于治疗一线治疗(患者初次化疗或手术后的辅助化疗)已经失败,黑色素瘤不可切除或呈现转移性的患者。
帕博利珠单抗此次能够“闪电”上市,相当程度得益于进入到国家药监局的优先审批通道。值得注意的是,不止是默沙东旗下的帕博利珠单抗及百时美施贵宝旗下的Opdivo(下称:纳武利尤单抗),君实生物、恒瑞医药及信达生物旗下三款PD-1单抗产品也进入到了优先审评通道,并且这三款产品在年初便已经获得了CDE药品审评中心受理上市申请,按照目前的审批进度,这三款产品也很有可能在2018年下半年有所突破。
◆◆ ◆
5个多月“闪电”获批,PD-1、PD-L1蓄势爆发
不止帕博利珠单抗,早在1个多月前另一款PD-1抑制剂纳武利尤单抗也获批在中国上市,纳武利尤单抗获得审评审批用了7个月时间。这两款PD-1抑制剂快速获批的关键在于药监局加速审评审批政策。
默沙东中国在接受健康点记者采访时表示,帕博利珠单抗注射液能在短短5个多月完成审评审批,中国药监管理部门给予优先审批资格并首次通过同步临床核查加速审批流程在其中“功不可没”。而这些优先政策并非仅惠及帕博利珠单抗,而是在PD-1、PD-L1领域“雨露均沾”。
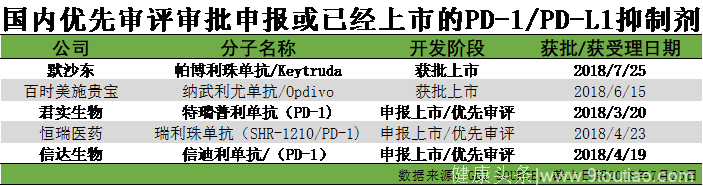
如上图所示,除已经获批上市的帕博利珠单抗及纳武利尤单抗之外,君实生物、恒瑞医药以及信达生物的PD-1单抗产品上市申请都在优先审评行列中,这些产品快速落地到市场也有很大的可能性。
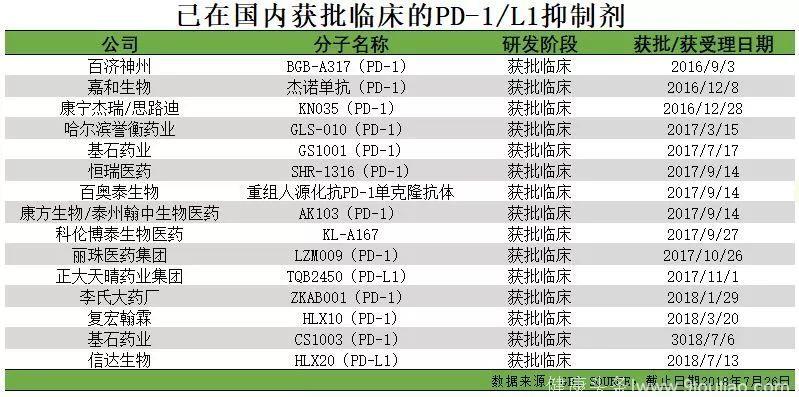
除接近上市阶段的产品之外,还有相当数量的国内药企的PD-1/PD-L1抑制剂产品处于临床试验阶段。如上图所示,已在国内相当数量的PD-1/PD-L1抑制剂在2017年、2018年集中获批临床,PD-1/PD-L1抑制剂未来将会成为非常热门的领域。
◆◆ ◆
患者何时用得到Keytruda?
帕博利珠单抗此次获批主要治疗晚期黑色素瘤。黑色素瘤是一种来源于黑色素细胞的恶性肿瘤,是最致命的皮肤癌症之一,一旦发生转移,患者的5年生存率不到5%。由于转移率高、治疗难度大、临床预后差,黑色素瘤常常被称为"癌中之王"。
在中国,2015年有大约8000例黑色素瘤新发病例和大约3200例黑色素瘤死亡病例。其中IV期(晚期)患者占12.8%,3倍于美国(IV期仅占4%)。在西方国家黑色素瘤多为皮肤型,而在中国,最常见的黑色素瘤亚型为肢端型(41.8%)和粘膜型(22.6%)黑色素瘤,由于其具有独特的遗传和临床特征,恶性程度较皮肤型黑色素瘤更高,临床预后更差。由此可见,黑色素瘤在国内的治疗形势无疑十分严峻。
在中国,晚期黑色素瘤的治疗仍以化疗(达卡巴嗪/替莫唑胺)为主。然而化疗方案在晚期黑色素瘤患者人群中的抗肿瘤活性非常有限。一项在中国受试者中开展的2期、随机、双盲、多中心研究显示,达卡巴嗪作为一线治疗,其客观缓解率仅为3.7%,中位总生存期为8个月。根据北京肿瘤医院的一项回顾性研究,局部晚期(不可切除的IIIB/C期)或转移性(IV期)黑色素瘤患者在二线治疗中,其客观缓解率仅为3.5%,中位总生存时间为7.5个月。
去年在中国获批的靶向药物维莫非尼(BRAF抑制剂)尽管在BRAF突变型晚期黑色素瘤中具有较高的缓解率,但几乎所有经治患者都会产生耐药性,大约50%的患者在6个月内发生疾病进展。
而帕博利珠单抗注射液在晚期黑色素瘤领域的治疗效果则十分突出。在一项包含173名病人的临床研究中,接受其他治疗后病情进展的晚期黑色素瘤患者使用帕博利珠单抗治疗,剂量为每公斤体重2毫克或10毫克,24%的病人病灶显著缩小,病情控制时间在1.4个月至8.5个月。
而2018 ASCO年会披露的KEYNOTE-001研究5年随访数据也表明,所有晚期黑色素瘤病人在使用帕博利珠单抗治疗后,总生存时间超过5年的比例是34%。首次治疗就使用帕博利珠单抗注射液治疗的晚期黑色素瘤病人的总生存时间超过5年的比例是41%。
中国病人与外国病人之间或许存在一定差异,但帕博利珠单抗在中国的临床效果保持了相当的稳定性。根据在中国进行的KEYNOTE151的中期研究结果,一线治疗失败的晚期黑色素瘤患者接受帕博利珠单抗作为二线治疗的客观缓解率达到16.7%,中位生存时间达到12.1个月。相当一部分患者疗效持续,接受治疗时间已接近两年。
除去效果,价格是患者关心的另一个核心问题。目前,香港帕博利珠单抗注射液(100mg)价格为42000港币/支,而默沙东中国在接受健康点采访时表示,药品定价与多种因素有关,包含大量研发、高品质生产和高标准管理的投入,未满足医疗需求的程度、药品给患者带来的临床获益、商业和金融市场状况等,帕博利珠单抗未来的定价将综合多方考虑因素,积极探索多种模式,实现患者、药物支付方及药物研发方的共赢。
虽然帕博利珠单抗已经获批在中国上市,但是患者真正能够购买使用还需等待一段时间。默沙东中国在采访中虽未预估患者最快多久能够用上帕博利珠单抗进行治疗。但对标先于帕博利珠单抗获批上市的纳武利尤单抗,其铺货速度应该不会太慢。
此前,健康点曾独家报道,纳武利尤单抗获批上市后不到1个月,第一批纳武利尤单抗注射液药物便已运抵上海保税区,在完成所有海关报关、检验等法定手续后的“一个月内”,全国患者就能用上纳武利尤单抗。
◆◆ ◆
9个瘤种12个以上适应症
帕博利珠单抗注射液此次获批的适应症虽然仅是晚期黑色素瘤的治疗,但它在癌症治疗领域的想像空间并不仅此。
从全球范围获批适应症数量而言,帕博利珠单抗注射液是目前用于治疗晚期瘤种最广泛的免疫药物。它已在80多个国家获批使用,覆盖了9个瘤种的12个以上适应症,包括黑色素瘤,非小细胞肺癌,头颈癌,霍奇金淋巴瘤,膀胱癌,宫颈癌,胃癌,B细胞淋巴瘤等。
而默沙东中国方面则表示,默沙东正继续积极与政府、医疗机构、专家和相关医学专业人士展开合作,继续扩展帕博利珠单抗在中国的其他适应症,除黑色素瘤外,帕博利珠单抗已在中国启动非小细胞肺癌,食管癌,肝癌等多个临床注册试验。而目前,这些临床试验正在顺利进展中。
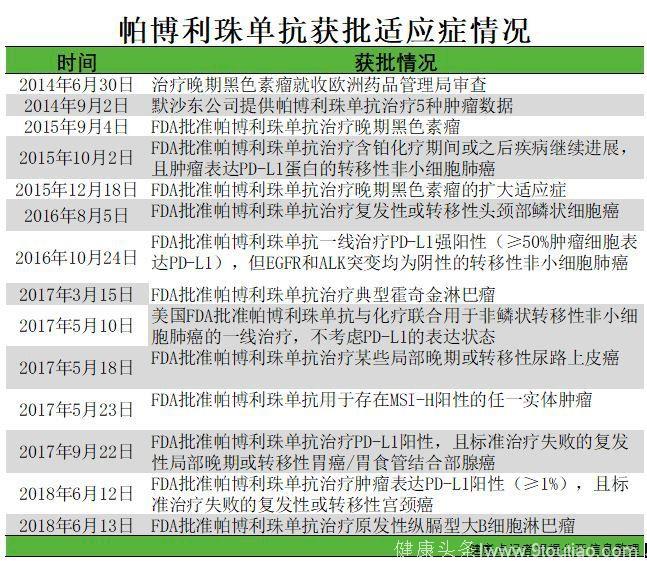
如上图所示,帕博利珠单抗注射液在不同癌种多个适应症的治疗上展现出突出的适应能力。特别值得一提的是,帕博利珠单抗注射液在2017年革命性地被FDA批准上市用于所有存在DNA错配修复缺陷的实体瘤的PD-1抑制剂,这意味着不管肿瘤的原发病灶是哪里,只要是存在高微卫星不稳定性(MSI-H)或DNA错配修复缺陷(dMMR),都可以使用帕博利珠单抗治疗,帕博利珠单抗也因此成为了“广谱抗癌药”。
而近期,帕博利珠单抗在临床上的表现也十分强劲。2018年4月公布的 Keynote-189数据显示帕博利珠单抗联合化疗一线治疗非鳞状非小细胞肺癌(无论PD-L1表达情况如何)和标准化疗相比减少超过50%死亡风险。2018年6月美国临床肿瘤学年会公布的Keynote-407研究则显示帕博利珠单抗联合化疗治疗鳞状非小细胞肺癌同样和标准化疗相比显著减少死亡风险。
联系作者微信:Songwazi9591;
卜艳|责编
我们坚持并尊重原创版权,未经授权请勿转载,授权请联络健康点管理员Mandy;