[文献导读]H3K27me3表达缺失的一组脑膜瘤复发风险更高-Acta Neuropathologica杂志 |快乐神经病理专栏
快乐神经病理 专栏
第5期

2018年4月7日发表在Acta Neuropathologica的一篇研究显示,组蛋白H3K27甲基化水平与脑膜瘤的复发风险相关,伴有H3K27me3表达完全缺失的WHOⅡ级脑膜瘤具有侵袭性表现。
研究背景
甲基化修饰是表观遗传学研究的重要组成部分,甲基化修饰可发生在DNA,也可发生于组蛋白。近来,DNA甲基化水平研究显示脑膜瘤可根据甲基化表观遗传模式分为几个不同的临床亚组。如Adriana Olar等人采用Illumina Human Methylation450Bead Chip,通过分析DNA甲基化谱,将脑膜瘤分为预后较差(MM-UNFAV)与预后较好(MM-FAV)两个亚组。随后,Felix Sahm等人进行了一项基于多中心的回顾性研究,通过分析全基因组DNA甲基化模式,将脑膜瘤分为A组和B组。两组又进一步分为6个不同的小亚组。其中相对良性的A组分为良性1-3组和中间A组,相对恶性的B组分为中间B组和恶性B组。
脑膜瘤是最常见的原发性颅内肿瘤和脊柱肿瘤。WHO分为Ⅰ-Ⅲ级,现已对WHOⅠ级与Ⅲ级脑膜瘤制定了明确的指导方针,分别推荐观察与辅助放射治疗。而WHOⅡ级的脑膜瘤是一组具有组织异质性的肿瘤,对其生物学行为的预测更具有挑战性,因此治疗方案往往取决于机构间的多学科共识,而不是形式化的指导方针。
研究初衷
除了DNA甲基化外,组蛋白甲基化修饰也可影响蛋白表达和细胞分化,其中组蛋白H3的赖氨酸27三甲基化修饰(H3K27me3)在肿瘤的发生发展具有重要作用。目前,通过免疫组化检测H3K27me3表达水平可对其他多种实体瘤进行诊断。因此想在脑膜瘤中测试一下H3K27me3染色模式是否与脑膜瘤不同亚组相关。
研究过程
共搜集了来自232例脑膜瘤患者的肿瘤标本,由于WHOⅡ级脑膜瘤的特殊性,该研究着重搜集了该组织学分级的脑膜瘤病例(Ⅰ级:49,Ⅱ级:155,Ⅲ级28)。对这232病例进行组化染色(抗体信息:clone, C36B11, CellSignaling, Danvers, MA, USA)。
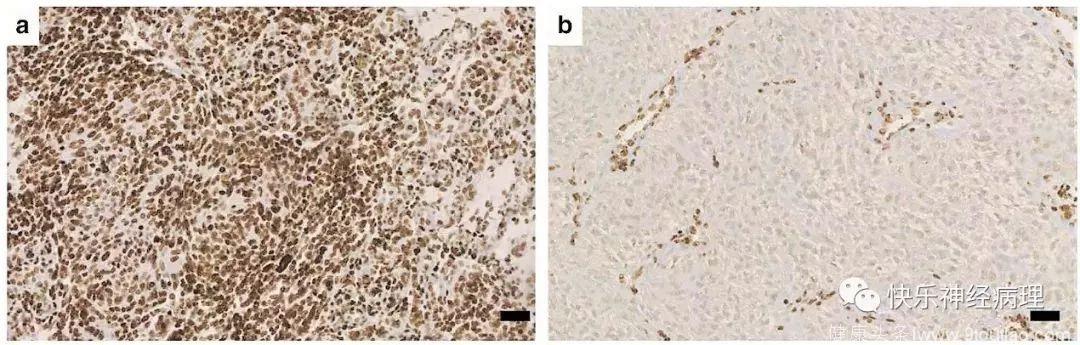
结果显示共有25例H3K27me3组化染色仅限于血管,所有肿瘤细胞均为阴性,定义为H3K27me3缺失(下图b)。其余病例均存在H3K27me3表达,定义为H3K27me3保留(下图a)。随后,对H3K27me3缺失的一部分病例进行了质谱分析,证实H3K27me3表达缺失确实是由于甲基化水平降低所致。
生存分析显示,H3K27me3缺失的病例预后较差,进展速度较快(下图a)。当预后风险与肿瘤的组织学分级相结合时,H3K27me3表达状态与预后相关性更大。进一步分析显示,H3K27me3表达状态对于预后风险的提示仅局限于WHOⅠ/Ⅱ级的脑膜瘤患者(下图b),对于WHOⅢ级的脑膜瘤患者未表现出显著的预后影响。
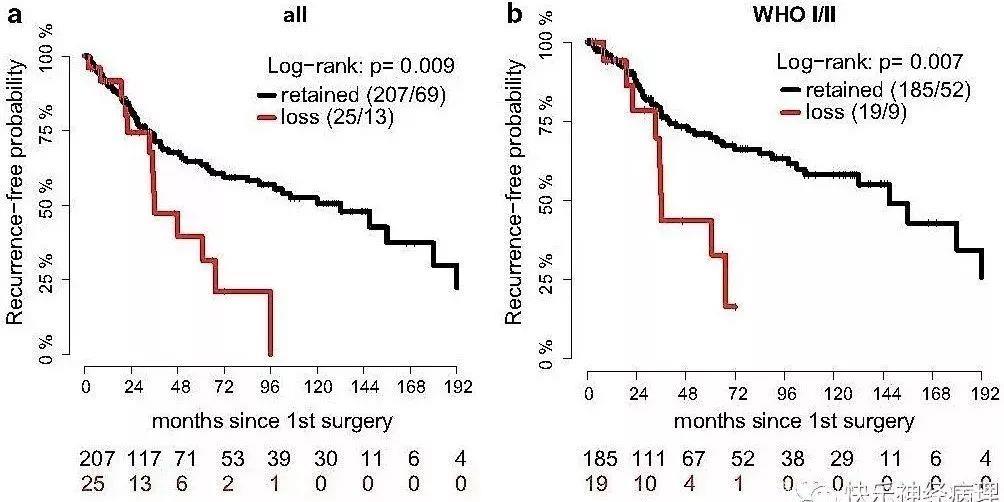
在单变量分析中,H3K27me3染色,WHO分级和手术切除程度都与WHOⅠ级和Ⅱ级脑膜瘤的预后直接相关。而在结合了WHO分级和切除程度的多变量分析中,H3K27me3染色模式依旧与预后相关。
其它相关工作
本研究获取了98例肿瘤的突变数据,这些病例中最常见的突变基因包括AKT1, KLF4/TRAF7, NF2等,而无H3K27三甲基化的病例更多见的是NF2和SUFU两个突变基因。本研究还获取了87例肿瘤的DNA甲基化状态,与H3K27me3染色模式的一致性进行了分析。由于染色完全缺失的病例数量过少,不足以进行前面介绍的DNA甲基化6亚组分析,因此只分析了与DNA甲基化A, B两个大亚组的相关性。结果显示,H3K27me3完全缺失的病例与DNA甲基化模式中的B组(包含MC中间亚组和MC恶性亚组)高度相关。
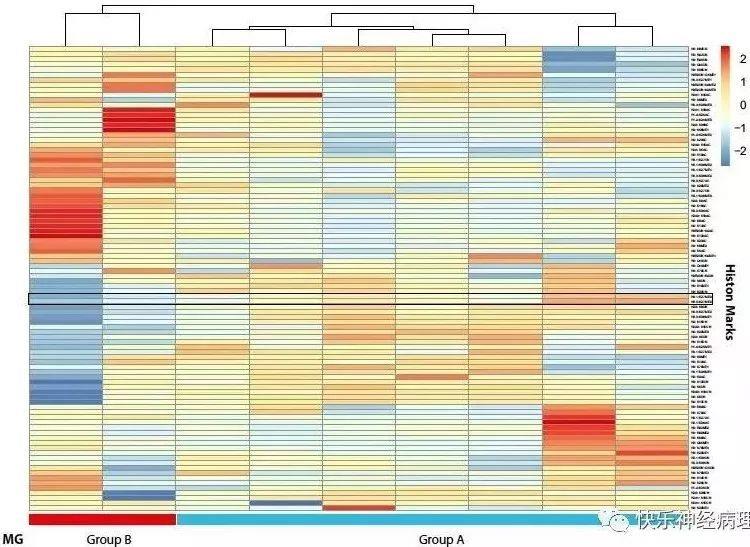
采用质谱技术,对2例H3K27me3缺失和7例H3K27me3阳性病例冰冻组织中的80个组蛋白修饰位点进行了检测,自动聚类分析结果显示组蛋白修饰分组模式与DNA甲基化分析结果相一致。即DNA甲基化B组中的病例显示H3K27me(H3.1和H3.3)三甲基化水平较低(下图黑框内)。
研究意义
本研究结果表明,除了DNA甲基化之外,组蛋白表观遗传修饰也与脑膜瘤的侵袭性相关。此外,H3K27me3免疫组化可能在脑膜瘤的诊断中起到辅助作用,尤其是组织形态为WHOⅡ级或者是组织形态处于WHO Ⅰ级和Ⅱ级之间的病例。
参考资料:
Katz LM, Hielscher T, Liechty B et al (2018) Loss ofhistone H3K27me3 identifies a subset of meningiomas with increased risk ofrecurrence. Acta Neuropathol. 2018 Apr 7.
Sahm F, Schrimpf D, Stichel D et al (2017) DNAmethylationbased classification and grading system for meningioma: amulticentre, retrospective analysis. Lancet Oncol 18:682–694.
Olar A, Wani KM, Wilson CD et al (2017) Globalepigenetic profiling identifies methylation subgroups associated withrecurrencefree survival in meningioma. Acta Neuropathol 133:431–444.
快乐神经病理专栏
版权说明
“快乐神经病理”授权“神外前沿”不定期转载其所刊发的文章,欲获得更多精彩文章,请扫描下面的二维码,关注“快乐神经病理”