[指南编译]2018NCCN中枢神经系统指南之胚胎源性肿瘤-张创辉 | 点评专家朴月善 | 北儿神外周刊第8期
北儿神外周刊
第8期

神外前沿讯,2018年3月,美国国家综合癌症网络(NCCN)发布了中枢神经系统肿瘤指南2018年第1版。详见[指南]NCCN最新发布中枢神经系统肿瘤指南2018年第1版;
《NCCN肿瘤学临床实践指南》由美国国家综合癌症网络组织(NCCN)出版,现已成为国际公认的肿瘤界临床实践规范标准。其中髓母细胞瘤和幕上PNET有所更新,更新内容如下:
2018NCCN之髓母细胞瘤和幕上PNET
1、概述
颅内的PNET(原始神经外胚层肿瘤)是一种胚胎性肿瘤,表现出不同程度的分化性。他们根据部位被分为幕下(髓母细胞瘤)和幕上(脑神经母细胞瘤,松果体母细胞瘤,嗅神经母细胞瘤)。
WHO分级系统又进一步将这些肿瘤分成不同的组织类型5。CNS(中枢神经系统)的PNET在小儿少见,在成人非常罕见,全美脑肿瘤注册(CBTRUS)研究报道其总的发病率是0.26/10万/年137。总体上讲,它仅仅占到所有脑肿瘤的1.8%,尽管它是儿童恶性脑肿瘤中最常见的类型。
大约有一半的患者可能出现颅内压升高的表现。头痛、共济失调、恶心也是最常见的症状138。由于侵袭性很高,生长速度很快,因此所有的PNET都被定义为WHO Ⅳ级。他们具有通过脑脊液播散的趋势,大的回顾性研究显示成人患者的10年生存率仅为48%到55%,5年以后复发率非常高,最常发生在后颅窝139,140。
2、治疗综述
手术
在成年人中关于手术治疗的证据很少,并且没有随机对照实验的支持,但是多数意见还是支持手术做为该疾病的初始治疗,目的是明确病理、改善症状和最大限度的控制局部病灶。有一半的病人可以实现肿瘤的全切138,141,142,并且与较好的临床预后相关。此外,脑室腹腔分流手术还可以用来治疗脑积水。
放射治疗
手术后的辅助放疗是目前的标准治疗,尽管多数的经验都是基于儿童患者的。对于全脑脊髓放疗的常规剂量是30到36Gy,在颅内原发部位可以增加到总量54到55.8Gy141,143。对于中等风险患者,为了减少放疗副作用,低剂量的全脑脊髓放疗(23.4Gy)联合化疗,是一个可以考虑的选择,当然,后颅窝局部放疗的剂量仍旧要维持在54到55.8Gy139,144,145,尽管有一项随机对照研究显示减少脑脊髓放疗的剂量可能会增加肿瘤复发的风险146。当然如果可能的话,也可以使用质子刀来实施脑脊髓放疗,来减少放疗的神经毒性147。有一项小样本的12例患者的研究发现,SRS(立体定向放射外科手术)可能对残余疾病或复发的疾病安全有效148。
系统治疗
放疗后使用化疗来降低放疗剂量,目前对于儿童来说是越来越普遍的选择144,145,但是对于成人如何实施最佳的化疗仍旧是不清楚的138-140,149,150。一项Ⅲ期临床实验纳入了400名3到21岁之间的患者,接受术后放疗联合以顺铂为基础的化疗方案,结果发现5年生存率可以达到86%151。
有多种方案可以用来治疗复发的病例,多数方案都包括依托泊苷152-154。替莫唑胺同样可以用于治疗复发的病例155。如果之前对低剂量有较好的治疗反应,也可以考虑选择高剂量化疗联合自体干细胞移植154,156。
3、NCCN推荐
首要治疗
MRI是评估和诊断PNET的金标准。典型的肿瘤表现为增强,有异质性。四脑室底的浸润经常被发现,这一现象的出现被认为是预后不佳的因素139,140,150。推荐治疗开始前应该开展多学科的讨论。
无论什么情况,都要尽可能实现最大范围的安全切除,一定要在术后48到72小时内复查MRI,但是脊髓的MRI复查应该在术后2到3周时进行。
由于PNET容易发生脑脊液播散定植,因此在完成脊髓MRI检查后还应该进行腰穿来进行脑脊液的采样分析。髓母细胞瘤可以通过影像和手术资料进行Chang氏分期157,158。
辅助治疗
为了设计辅助治疗方案,应该根据复发的风险对患者进行分级(Brandes等综述159)。NCCN专家组推荐的高风险因素包括:大细胞或间变髓母细胞瘤,幕上PNET,无法切除的肿瘤或术后肿瘤残余大于1.5cm²。
这部分患者应该在接受神经轴的放疗后实施化疗。在放疗之前应该收集干细胞,可以考虑在将来出现肿瘤进展复发时进行自体干细胞移植。对于中等风险的患者,可以在术后单独使用脑脊髓放疗,或脑脊髓放疗同步及序贯化疗。
复发和进展
没有一个有力的证据支持PNET最佳的随访方案。多数指南建议在术后前2年内每3个月复查一次,在后面三年每年复查2次,随后每年复查1次。如果MRI随访发现复发,应该立即行脑脊液检查。如果患者既往有脊髓病变病史,应该考虑同时行脊髓影像检查。骨扫描、CT扫描、以及骨髓活检也可以考虑。
对于复发的脑肿瘤还是应该尝试最大范围安全切除,对部分患者可以考虑个给予高剂量化疗联合自体干细胞移植。疾病进展时的其他治疗包括化疗、放疗(包括SRS)和放化疗联合。转移的患者可以采用化疗或支持治疗如姑息性放疗。
相关表格



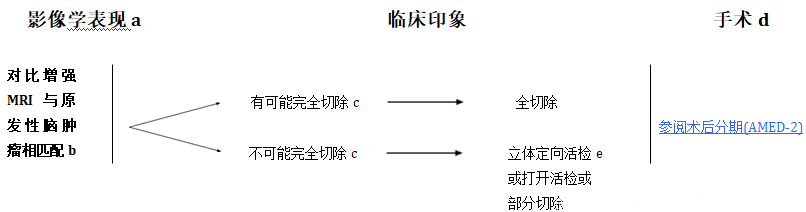
a 参阅脑和脊髓肿瘤成像指南 (BRAIN-A)。
b 考虑到治疗计划中进行多学科评估,在术前一旦有病理学的情况下(参阅脑和脊柱肿瘤管理的原理[BRAIN-E])。
c 如果有需要,放置脑室腹腔分流(VP)治疗脑积水是可以接受的。
d 参阅脑肿瘤手术指南(BRAIN-B)。
e 强烈建议将患者转诊至脑肿瘤中心进行评估,以便进行更彻底的手术切除。


a 参阅脑和脊髓肿瘤成像原理(BRAIN-A)。
f 手术后24-72小时内行术后脑部MRI检查。
g 脊髓MRI检查应该在手术后至少延迟2-3周后进行以避免手术后的伪影。
h 脊髓MRI后应做腰椎穿刺。术后腰椎穿刺行CSF检验应在手术后至少延迟2周以避免可能的假阳性细胞学检查。
i 骨扫描;胸部,腹部和骨盆增强CT扫描或全身PET / CT扫描;只有在有临床指征时才进行骨髓活检。
j 推荐用于鉴定临床相关亚型的分子分型以此来鼓励临床试验参与进来。参阅病理学指南(BRAIN-F)。
k 请参阅修改的Chang系统髓母细胞瘤分期。(Chang CH, Housepain EM, Herbert, C. Radiology 1969;93:1351 and Cohen ME, Duffner PK (Eds). Brain Tumors in children, 2nd ed, McGraw-Hill, New York, 1994, p. 187.)
l 如果只有活检是可以进行的,可以考虑先预放射化疗,随后再尝试针对脑肿瘤治疗的中心切除活检。
m 参阅“脑和脊髓肿瘤放射治疗规范”(BRAIN-C)。
n 在成人患者放疗期间不用长春新碱或长春新碱剂量有所改变,因为他们也不能接受这种方案。支持长春新碱使用的数据仅在儿科试验中发现。患者需定期检查以密切监测患者的神经毒性。(Packer RJ, Gajjar A, Vezina G, et al. Phase III study of craniospinal radiation therapy followed by adjuvant chemotherapy for newly diagnosed average-risk medulloblastoma. J Clin Oncol 2006;24:4202- 4208.)
o 参阅脑和脊髓肿瘤系统治疗指南(BRAIN-D)。
p 推荐一种以顺铂为基础的化疗方案,例如脚注“n”中引用的儿童肿瘤组研究中使用的任一治疗组。
q 考虑在颅脑脊髓放射之前收集干细胞。

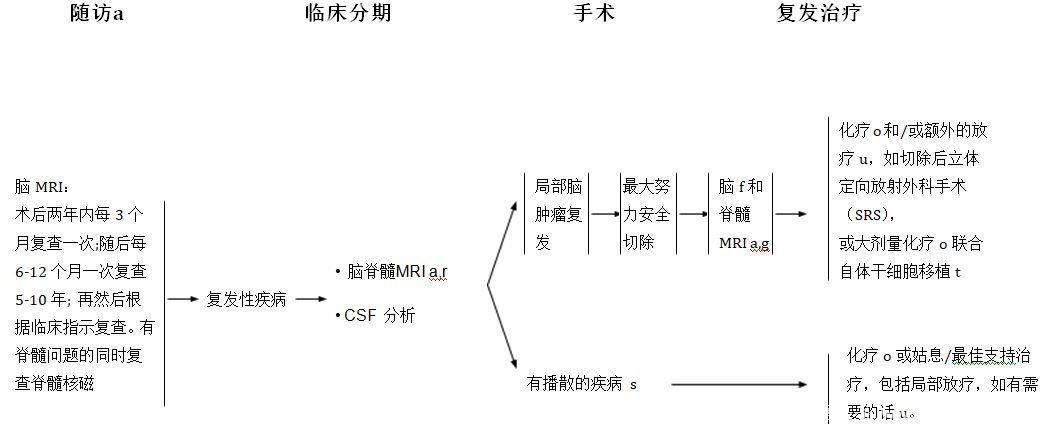
a 参阅脑和脊髓肿瘤成像原理(BRAIN-A)。
f 手术后24-72小时内行术后脑部MRI检查。
g 脊髓MRI检查应该在手术后至少延迟2-3周后进行以避免手术后的伪影。
o 参阅脑和脊髓肿瘤系统治疗指南(BRAIN-D)。
r 依据临床指导,进行骨扫描; 胸部,腹部和骨盆的增强CT扫描; 和/或骨髓活检。
s 在能够缓解症状的情况下进行切除。
t 只有当患者手术后没有疾病证据或常规剂量再诱导化疗。
u 参阅脑和脊髓肿瘤放疗指南 (BRAIN-C)。
所有建议均属于2A类,除非另有说明。
临床试验:NCCN认为任何癌症患者的最佳治疗都是在临床试验中进行。 特别鼓励参与临床试验。
参考文献:向上滑动阅览
5. Louis DN, Ohgaki H, Wiestler OD, et al. The 2007 WHO classification of tumours of the central nervous system. Acta Neuropathol 2007;114:97-109. Available at: http://www.ncbi.nlm.nih.gov/pubmed/17618441.
137. Surawicz TS, McCarthy BJ, Kupelian V, et al. Deive epidemiology of primary brain and CNS tumors: results from the Central Brain Tumor Registry of the United States, 1990-1994. Neuro Oncol 1999;1:14-25. Available at: http://www.ncbi.nlm.nih.gov/pubmed/11554386.
138. Kunschner LJ, Kuttesch J, Hess K, Yung WK. Survival and recurrence factors in adult medulloblastoma: the M.D. Anderson Cancer Center experience from 1978 to 1998. Neuro Oncol 2001;3:167-173. Available at: http://www.ncbi.nlm.nih.gov/pubmed/11465397.
139. Padovani L, Sunyach MP, Perol D, et al. Common strategy for adult and pediatric medulloblastoma: a multicenter series of 253 adults. Int J Radiat Oncol Biol Phys 2007;68:433-440. Available at: http://www.ncbi.nlm.nih.gov/pubmed/17498567.
140. Carrie C, Lasset C, Alapetite C, et al. Multivariate analysis of prognostic factors in adult patients with medulloblastoma. Retrospective study of 156 patients. Cancer 1994;74:2352-2360. Available at: http://www.ncbi.nlm.nih.gov/pubmed/7922986.
141. Chan AW, Tarbell NJ, Black PM, et al. Adult medulloblastoma: prognostic factors and patterns of relapse. Neurosurgery 2000;47:623- 631; discussion 631-622. Available at: http://www.ncbi.nlm.nih.gov/pubmed/10981749.
142. Frost PJ, Laperriere NJ, Wong CS, et al. Medulloblastoma in adults. Int J Radiat Oncol Biol Phys 1995;32:951-957. Available at: http://www.ncbi.nlm.nih.gov/pubmed/7607969.
143. Chargari C, Feuvret L, Levy A, et al. Reappraisal of clinical outcome in adult medulloblastomas with emphasis on patterns of relapse. Br J Neurosurg 2010;24:460-467. Available at: http://www.ncbi.nlm.nih.gov/pubmed/20726753.
144. Douglas JG, Barker JL, Ellenbogen RG, Geyer JR. Concurrent chemotherapy and reduced-dose cranial spinal irradiation followed by conformal posterior fossa tumor bed boost for average-risk medulloblastoma: efficacy and patterns of failure. Int J Radiat Oncol Biol Phys 2004;58:1161-1164. Available at: http://www.ncbi.nlm.nih.gov/pubmed/15001259.
145. Merchant TE, Kun LE, Krasin MJ, et al. Multi-institution prospective trial of reduced-dose craniospinal irradiation (23.4 Gy) followed by conformal posterior fossa (36 Gy) and primary site irradiation (55.8 Gy) and dose-intensive chemotherapy for average-risk medulloblastoma. Int J Radiat Oncol Biol Phys 2008;70:782-787. Available at: http://www.ncbi.nlm.nih.gov/pubmed/17892918.
146. Deutsch M, Thomas PR, Krischer J, et al. Results of a prospective randomized trial comparing standard dose neuraxis irradiation (3,600 cGy/20) with reduced neuraxis irradiation (2,340 cGy/13) in patients with low-stage medulloblastoma. A Combined Children's Cancer Group- Pediatric Oncology Group Study. Pediatr Neurosurg 1996;24:167-176; discussion 176-167. Available at: http://www.ncbi.nlm.nih.gov/pubmed/8873158.
147. Brown AP, Barney CL, Grosshans DR, et al. Proton beam craniospinal irradiation reduces acute toxicity for adults with medulloblastoma. Int J Radiat Oncol Biol Phys 2013;86:277-284. Available at: http://www.ncbi.nlm.nih.gov/pubmed/23433794.
148. Germanwala AV, Mai JC, Tomycz ND, et al. Boost Gamma Knife surgery during multimodality management of adult medulloblastoma. J Neurosurg 2008;108:204-209. Available at: http://www.ncbi.nlm.nih.gov/pubmed/18240913.
149. Riffaud L, Saikali S, Leray E, et al. Survival and prognostic factors in a series of adults with medulloblastomas. J Neurosurg 2009;111:478- 487. Available at: http://www.ncbi.nlm.nih.gov/pubmed/19231932.
150. Herrlinger U, Steinbrecher A, Rieger J, et al. Adult medulloblastoma: prognostic factors and response to therapy at diagnosis and at relapse. J Neurol 2005;252:291-299. Available at: http://www.ncbi.nlm.nih.gov/pubmed/16189725.
151. Packer RJ, Gajjar A, Vezina G, et al. Phase III study of craniospinal radiation therapy followed by adjuvant chemotherapy for newly diagnosed average-risk medulloblastoma. J Clin Oncol 2006;24:4202-4208. Available at: https://www.ncbi.nlm.nih.gov/pubmed/16943538.
152. Ashley DM, Meier L, Kerby T, et al. Response of recurrent medulloblastoma to low-dose oral etoposide. J Clin Oncol 1996;14:1922-1927. Available at: http://www.ncbi.nlm.nih.gov/pubmed/8656261.
153. Chamberlain MC, Kormanik PA. Chronic oral VP-16 for recurrent medulloblastoma. Pediatr Neurol 1997;17:230-234. Available at: https://www.ncbi.nlm.nih.gov/pubmed/9390699.
154. Dunkel IJ, Gardner SL, Garvin JH, Jr., et al. High-dose carboplatin, thiotepa, and etoposide with autologous stem cell rescue for patients with previously irradiated recurrent medulloblastoma. Neuro Oncol 2010;12:297-303. Available at: http://www.ncbi.nlm.nih.gov/pubmed/20167818.
155. Nicholson HS, Kretschmar CS, Krailo M, et al. Phase 2 study of temozolomide in children and adolescents with recurrent central nervous system tumors: a report from the Children's Oncology Group. Cancer 2007;110:1542-1550. Available at: http://www.ncbi.nlm.nih.gov/pubmed/17705175.
156. Gill P, Litzow M, Buckner J, et al. High-dose chemotherapy with autologous stem cell transplantation in adults with recurrent embryonal tumors of the central nervous system. Cancer 2008;112:1805-1811. Available at: http://www.ncbi.nlm.nih.gov/pubmed/18300237.
157. Cohen ME, Duffner P, eds. Brain tumors in children (ed 2). New York: McGraw-Hill; 1994.
158. Chang CH, Housepian EM, Herbert C, Jr. An operative staging system and a megavoltage radiotherapeutic technic for cerebellar medulloblastomas. Radiology 1969;93:1351-1359. Available at: http://www.ncbi.nlm.nih.gov/pubmed/4983156.
159. Brandes AA, Franceschi E, Tosoni A, et al. Adult neuroectodermal tumors of posterior fossa (medulloblastoma) and of supratentorial sites (stPNET). Crit Rev Oncol Hematol 2009;71:165-179. Available at: http://www.ncbi.nlm.nih.gov/pubmed/19303318.
附录
2016WHO相关内容
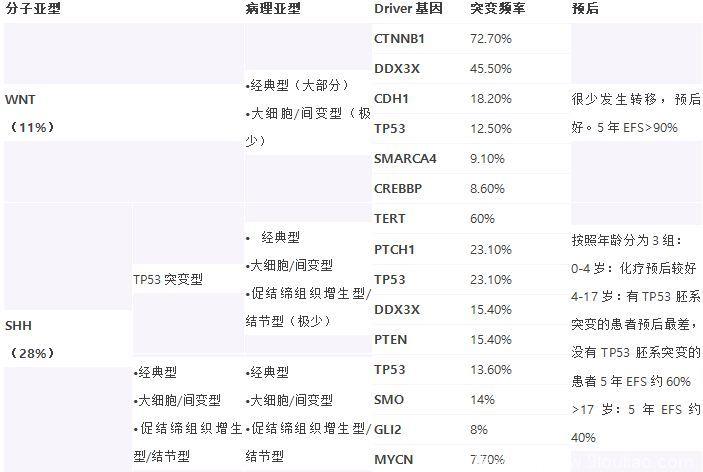
2016版世界卫生组织(WHO)中枢神经系统(CNS)肿瘤分类1是在2007版2的基础上,充分考虑并吸收了近年来CNS肿瘤的研究成果,对髓母细胞瘤和PNET(原始神经外胚层肿瘤)进行病理学调整。
★结合遗传学明确的实体,对髓母细胞瘤进行重大调整,在组织学分型的基础上增加了分子分型。
★结合遗传学明确的实体,删除了“原始神经外胚层肿瘤(PNET)”这一术语,改为中枢神经系统胚胎性肿瘤。上文NCCN指南中参考的是2007版世界卫生组织(WHO)中枢神经系统(CNS)肿瘤分类,因此在此说明。
2016 CNS WHO: 组合型报告
组织学亚型:
经典型
促纤维增生型/结节型
弥漫结节型
大细胞/间变型
分子亚型:
WNT型
SHH型
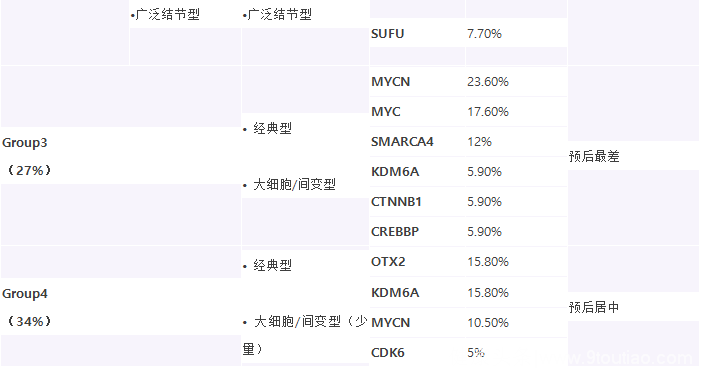
Grmp3型
Grmp4型
[参考文献]
1.Louis DN, Perry A, Reifenberger G, von Deimling A, Figarella-Branger D, Cavenee WK, Ohgaki H, Wiestler OD, Kleihues P, Ellison DW.The 2016 World Health Organization Classification of Tumors of the Central Nervous System: a summary.Acta Neuropathol. 2016 Jun;131(6):803-20
2.Louis DN, Ohgaki H, Wiestler OD, et al. The 2007 WHO classification of tumours of the central nervous system. Acta Neuropathol 2007;114:97-109.
朴月善教授 点评

2016WHO中枢神经系统(CNS)肿瘤分类修订版中有关胚胎性肿瘤分型的变化涵盖了从组织学到分子遗传学的诸多方面,我们病理医生在日常诊断工作中面临巨大的挑战,但同时也是学习的契机。
特别是髓母细胞瘤(MB)引入了分子亚分型及调整了组织学分型。MB的分子分型包括WNT活化型,SHH活化-TP53野生型,SHH活化-TP53突变型,非WNT /非SHH活化型(分为第3组和第4组)。分子分型对临床预后具有指导意义,遗憾的是截至目前我们的免疫组化染色方法尚不能有效地帮助分型,确切分型仍需要进行分子检测。MB的组织分型的变动是将间变性和大细胞型两个亚型合并为大细胞 /间变性MB。
新增加了伴有多层菊形团的胚胎性肿瘤C19MC变异型( ETMR)和具有横纹肌样特征的 CNS 胚胎性肿瘤。ETMR主要包括以往分类中的富含神经毡和真菊形团的胚胎性肿瘤、室管膜母细胞瘤以及髓上皮瘤。利用LIN28抗体进行免疫组织化学染色是诊断ETMR较为有效的手段。
另外,废弃了CNS原始神经外胚层肿瘤(PNET)这一分型, 将原先作为其亚型的髓上皮瘤 (C19MC正常者)、CNS神经母细胞瘤和 CNS神经节细胞神经母细胞瘤单独列为 CNS胚胎性肿瘤的亚型。将不具备以上特征的 PNET重新命名为“CNS胚胎性肿瘤, NOS”。
有关腰椎穿刺采集脑脊液证实肿瘤的脑脊液播散,那么如何提高检测的阳性率呢?我们的经验是多次采样送检(有时需要借助免疫细胞化学染色)以及临床-病理医生的充分沟通,以期为临床诊断和治疗提供充分证据。
[第80期专访]宣武医院朴月善: 客观理性看待胶质瘤分子病理检测 哪些情况下会误导医生和患者
联系我们
北儿神外周刊 往期报道
儿童视路胶质瘤手术 如何通过视觉纤维重建来保留患者视力 - 葛明 | 北儿神外周刊 第7期
[回顾]2017快速发展的中国小儿神外事业-120篇报道分类汇总 |葛明 漆松涛点评 | 北儿神外周刊第6期
[课件]小儿脑血管畸形的科普知识与临床案例-蔡英杰 | 北儿神外周刊第5期
[课件]埋在儿童中枢神经系统内的“不定时炸弹”皮毛窦 北京儿童医院两年29例病例分析 | 王苹-北儿神外周刊第4期
[课件]儿童颅缝早闭的手术治疗进展及内镜辅助下治疗-金炤延 | 王刚点评 | 北儿神外周刊第3期
[解读]2017年EANO室管膜肿瘤诊疗指南-王佳 渠沛然 | 点评专家王行富 张俊平 邱晓光 葛明|北儿神外周刊第2期
[开篇寄语/ 团队风采] 为了中国小儿神经外科更美好的明天 | 北儿神外周刊第1期
《北儿神外周刊》栏目由国家儿童医学中心-北京儿童医院神经外科与神外前沿新媒体共同采写制作,转载需注明出处并保障文章的完整性,联系邮箱[email protected];