专家视角|马胜林教授:浅谈PD-1/PD-L1抑制剂的作用机制
导读
目前PD-1抗体和PD-L1抗体的临床治疗已经取得了巨大的进展,医脉通特地邀请浙江省杭州市第一人民医院院长马胜林教授撰文,浅谈PD-1/PD-L1抑制剂的作用机制。
作者:马胜林 教授
杭州市第一人民医院院长
通过诱导、增强或抑制免疫应答来治疗疾病由来已久。在恶性肿瘤免疫治疗方面,传统的方法包括细菌/病毒感染后免疫增强反应、肿瘤疫苗[1, 2]等,之后的肿瘤过继细胞疗法,例如利用LAK细胞[3, 4]、肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte,TIL)[5]、CIK(cytokine induced killer)[6]、肿瘤特异性T细胞[7]等治疗癌症,均显示了一定的疗效。
近年来,免疫检查点 (Immuno-checkpoint)抑制剂,CAR-T(Chimeric Antigen Receptor–Modified T Cells)疗法等大放异彩,其中,抗PD-1/PD-L1抗体,能够阻断PD-1/PD-L1信号通路从而增强T细胞杀伤活性,在临床上取得了突出的疗效,被认为是最有前景的肿瘤治疗策略之一[8]。
PD-1(Programmed Cell Death 1)即细胞程序性死亡受体1,是一种Ⅰ型跨膜糖蛋白,属于Ig超家族成员。健康人体具有相对稳态的免疫系统,表达T细胞受体(T cell Receptor, TCR)的T细胞是参与特异性免疫应答的关键细胞,但是T细胞并不能直接识别抗原分子。
识别抗原进入机体后,经抗原提呈细胞(antigen-presenting cell,APC)加工并与MHC分子连接。T细胞表面的TCR分子在特异性识别APC所提呈的抗原肽的过程中,还必须同时识别与抗原肽形成复合物的MHC分子。
但是,此时T细胞并不会被活化,还需要T细胞表面众多免疫调节分子的参与,例如APC细胞表面的免疫共刺激因子CD80/86与T细胞表面的CD28结合,产生共刺激信号,激活T细胞并发挥免疫效应;而PD-1等分子则属于免疫共抑制受体,对健康人体免疫系统具有负向调节功能,防止T细胞的过度激活(图1)。

图1 T细胞激活机制
一般认为,参与机体免疫调节的分子包括以下三类:
(I)免疫共刺激受体,包括表达在T细胞表面的TNFR超家族成员CD28、OX40、GITR等,它们与APC表面分子的结合可以激活T细胞,例如CD28与CD80/CD86的结合;
(II)免疫共抑制受体,包括T细胞表面表达的CTLA-4、PD-1、KIR等。它们与APC表面分子的结合能够有效抑制 T 细胞增殖,例如受体PD-1与PD-L1/PD-L2的结合;
(III)可溶性免疫抑制因子,如TGFβ1、IL-6等[9](图2)。
早在1992年,Honjo课题组首次分离和鉴定了PD-1分子[10]。随后,研究者们又鉴定出了PD-L1 分子,并逐步揭示了PD-1/PD-L1在肿瘤发生免疫抑制过程中的关键作用,从而为抗PD-1/PD-L1 药物的研发提供了理论依据[11]。
正常生理情况下,PD-1在活化的T、B细胞、NK细胞、单核细胞和DC表面均有表达,与处于APC细胞表面的PD-L1(即B7-H1)、PD-L2(即B7-DC)等相互作用,抑制T细胞的过度活化,维持机体免疫稳态。
然而,在许多类型的肿瘤中,肿瘤细胞表面往往异常高表达的PD-L1分子,与肿瘤浸润T淋巴细胞表面的PD-1分子结合,从而抑制T细胞的正常活化,避免肿瘤细胞被T细胞杀伤,最终实现肿瘤的免疫逃逸。
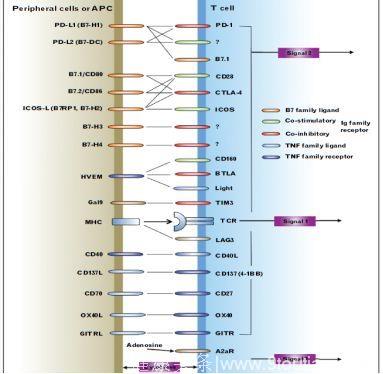
图2 T细胞免疫调节分子
co-stimulatory:免疫共刺激分子;co-inhibitory:免疫共抑制分子。
而抗PD-1或PD-L1抗体能够阻断肿瘤PD-L1和T细胞PD-1的结合,消除这一免疫抑制效应,使得T细胞重新被激活,识别并杀伤癌细胞[12-14]。在肿瘤部位,抗PD-1抗体还可以结合巨噬细胞表面的Fcγ受体,介导调节性T细胞的消耗,从而上调T细胞的比例,增强抗肿瘤能力[9](图3)。
与化疗和其它治疗性抗体不同之处在于,这类抗体能够直接作用于自身免疫系统,重新激活免疫细胞使其恢复杀伤肿瘤细胞的能力;此外,由于T细胞具有记忆能力,被激活的T细胞能够长期保持杀伤肿瘤细胞的能力,从而维持机体对肿瘤的免疫应答,给患者带来长期生存获益[15-17]。
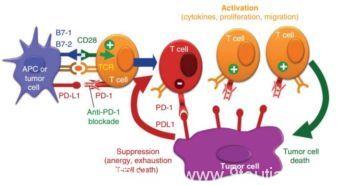
图3 肿瘤中PD-1抗体作用机制示意图
抗PD-1抗体可以阻断肿瘤细胞中的免疫抑制效应,重新活化T细胞并杀伤肿瘤。
目前已有多个用于肿瘤免疫治疗的抗PD-1或PD-L1抗体先后被FDA批准上市,其中有代表性的产品有:BMS开发的抗PD-1抗体Nivolumab(商品名Opdivo)、默沙东的抗PD-1抗体Pembrolizumab(商品名Keytruda)、以及罗氏公司的抗PD-L1抗体Atezolizumab(商品名Tecentriq)、辉瑞/德国默克的抗PD-L1抗体Avelumab(商品名Bavencio)和阿斯利康的抗PD-L1抗体Durvalumab (商品名Imfinzi)等,这些抗体中不乏被FDA认定为“突破性药物”的明星产品[18-19]。
Nivolumab治疗经治非小细胞肺癌(NSCLC)的Ⅰ期研究CA209-003提示,Nivolumab治疗晚期NSCLC 的5年生存率可达16%,而且75%的5年存活患者仍在应答[20]。Nivolumab治疗经治NSCLC的Ⅲ期研究CheckMate-017/057也显示,鳞癌、非鳞癌患者使用Nivolumab后,3年生存率可达16%和18%,分别有26%、23%的患者仍在持续缓解中[21,22]。
在Pembrolizumab的临床III期试验中,811名晚期黑色素瘤患者2年总体生存率为55%[23]。Pembrolizumab能够将晚期黑色素瘤患者的预期寿命提高1.14岁[24];Keynote-001研究也显示,Pembrolizumab用于晚期NSCLC患者,3年生存率达19%[25]。
Atezolizumab治疗后,肿瘤部位浸润性免疫细胞(IC)反应率显著改善。近一年后45例应答者中有38例(84%)存在持续反应[26],预示了良好的长期疗效。
Avelumab是Merkel细胞癌(Merkel cell cancer,MCC)的孤儿药。化疗复发的MCC病人对抗体的客观应答率为31.8%。一年后,28例患者中23例依然存在药物持续反应[27]。
晚期泌尿上皮癌患者对Durvalumab的客观回应率为17.8%(34人),其中7例完全应答。中位无进展生存期和总生存期分别为1.5个月和18.2个月[28]。
值得一提的是,抗PD-1/PD-L1抗体的疗效与患者PD-L1表达水平密切相关,例如在PD-L1阳性的黑色素瘤和NSCLC患者中,Nivolumab总应答率为34.1%,而PD-L1阴性患者仅为19.9%[29],在膀胱癌中的数据也提示了相似的结论[30]。
同时,单抗的疗效似乎还与其它分子,如EGFR基因状态等有关;此外,单抗治疗的疗效似乎不如组合疗法,特别是多个抗体联合的鸡尾酒疗法更具前景[23],因此目前大量的PD1/PD-L1抗体相关临床试验都是基于组合疗法的设计。
2015年10月,FDA批准了Nivolumab联合Ipilimumab一线治疗不可手术或转移性黑色素瘤。临床试验数据显示,95名抗体联合治疗的患者2年生存率为63.8%,而Ipilimumab治疗组则为53.6%;Pembrolizumab合并Ipilimumab治疗,高达61%的患者对治疗有应答,1年无进展生存期约为69%,1年总生存率为89%[31]。不过,抗体联用毒副作用发生率也相应提高,需要临床严密监察[32]。

马胜林 教授
主任医师 教授 博士生导师
杭州市第一人民医院集团管委会主任
杭州市第一人民医院院长
浙江中医药大学第四临床医学院院长
浙江省医学科学院肺癌研究所所长
中国抗癌协会放疗专业委员会副主任委员
中国抗癌协会抗癌药物
专业委员会候任主委
中国抗癌协会肺癌专业委员会常务委员
CSCO脑转移肿瘤专家委员会副主任委员
中华医学会放疗分会肿瘤热疗学组组长
浙江省医学会肿瘤分会候任主委
浙江省抗癌协会放疗专业委员会主任委员
浙江省抗癌协会肺癌专业委员会候任主委
参考文献:
1. Andtbacka RH, Kaufman HL, Collichio F,et al.Talimogene Laherparepvec Improves Durable Response Rate in Patients With Advanced Melanoma.Clinical Oncology 2015, 33(25):2780-2788.
2. Higano CS, Schellhammer PF, Small EJ,et al.Integrated data from 2 randomized, double-blind, placebo-controlled, phase 3 trials of active cellular immunotherapy with sipuleucel-T in advanced prostate cancer. Cancer 2009, 115(16):3670-3679.
3. Mule JJ, Shu S, Schwarz SL,et al.Adoptive immunotherapy of established pulmonary metastases with LAK cells and recombinant interleukin-2. Science 1984, 225(4669):1487-1489.
4. Kimura H, Yamaguchi Y.A phase III randomized study of interleukin-2 lymphokine-activated killer cell immunotherapy combined with chemotherapy or radiotherapy after curative or noncurative resection of primary lung carcinoma. Cancer 1997, 80(1):42-49.
5. Rosenberg SA, Spiess P, Lafreniere R.A new approach to the adoptive immunotherapy of cancer with tumor-infiltrating lymphocytes. Science 1986, 233(4770):1318-1321.
6. Schmidt-Wolf IG, Negrin RS, Kiem HP,et al.Use of a SCID mouse/human lymphoma model to evaluate cytokine-induced killer cells with potent antitumor cell activity. J Exp Med. 1991 Jul 1;174(1):139-49.
7. Dudley ME, Wunderlich JR, Robbins PF,et al.Cancer regression and autoimmunity in patients after clonal repopulation with antitumor lymphocytes. Science 2002, 298(5594):850-854.
8. Weiner GJ.Building better monoclonal antibody-based therapeutics. Nature reviews Cancer 2015, 15(6):361-370.
9. Blank CU.The perspective of immunotherapy: new molecules and new mechanisms of action in immune modulation. Current opinion in oncology 2014, 26(2):204-214.
10. Ishida Y, Agata Y, Shibahara K,et al.Induced expression of PD-1, a novel member of the immunoglobulin gene superfamily, upon programmed cell death. EMBO J. 1992 Nov;11(11):3887-95.
11. Chapoval AI, Ni J, Lau JS,et al.B7-H3: a costimulatory molecule for T cell activation and IFN-gamma production. Nat Immunol. 2001 Mar;2(3):269-74.
12. Philips GK, Atkins M.Therapeutic uses of anti-PD-1 and anti-PD-L1 antibodies. Int Immunol. 2015 Jan;27(1):39-46.
13. Gunturi A, McDermott DF.Nivolumab for the treatment of cancer. Expert opinion on investigational drugs 2015, 24(2):253-260.
14. Topalian SL, Drake CG, Pardoll DM.Targeting the PD-1/B7-H1(PD-L1) pathway to activate anti-tumor immunity. Current opinion in immunology 2012, 24(2):207-212.
15. Gettinger SN, Horn L, Gandhi L, Spigel DR,et al: Overall Survival and Long-Term Safety of Nivolumab (Anti-Programmed Death 1 Antibody, BMS-936558, ONO-4538) in Patients With Previously Treated Advanced Non-Small-Cell Lung Cancer. J Clin Oncol. 2015 Jun 20;33(18):2004-12.
16. McDermott DF, Drake CG, Sznol M,et al: Survival, Durable Response, and Long-Term Safety in Patients With Previously Treated Advanced Renal Cell Carcinoma Receiving Nivolumab. J Clin Oncol. 2015 Jun 20;33(18):2013-20.
17. Topalian SL, Sznol M, McDermott DF,et al: Survival, durable tumor remission, and long-term safety in patients with advanced melanoma receiving nivolumab. J Clin Oncol. 2014 Apr 1;32(10):1020-30.
18. PD-1 inhibitor becomes "breakthrough therapy". Cancer discovery 2013, 3(7):OF14.
19. Kasamon YL, de Claro RA, Wang Y,et al.FDA Approval Summary: Nivolumab for the Treatment of Relapsed or Progressive Classical Hodgkin Lymphoma. The oncologist 2017, 22(5):585-591.
20. Brahmer J, et al. at AACR 2017, Abstract CT077.Surveillance, Epidemiology, and End Results Program (SEER) Stat Fact Sheets: Lung and Bronchus Cancer.
21. Presented By E. Felip Font at 2017 ESMO Annual Meeting.
22. Presented By E. Felip Font at 2017 ESMO Annual Meeting
23. Schachter J, Ribas A, Long GV,et al: Pembrolizumab versus ipilimumab for advanced melanoma: final overall survival results of a multicentre, randomised, open-label phase 3 study (KEYNOTE-006). Lancet 2017.
24. Wang J, Chmielowski B, Pellissier J,et al. Cost-Effectiveness of Pembrolizumab Versus Ipilimumab in Ipilimumab-Naive Patients with Advanced Melanoma in the United States J Manag Care Spec Pharm. 2017 Feb;23(2):184-194.
25. Leighl NB, et al. ASCO 2017, Poster 9011.
26. Rosenberg JE, Hoffman-Censits J, Powles T, et al.Atezolizumab in patients with locally advanced and metastatic urothelial carcinoma who have progressed following treatment with platinum-based chemotherapy: a single-arm, multicentre, phase 2 trial. Lancet 2016, 387(10031):1909-1920.
27. Kaufman HL, Russell J, Hamid O,et al.Avelumab in patients with chemotherapy-refractory metastatic Merkel cell carcinoma: a multicentre, single-group, open-label, phase 2 trial. Lancet Oncol. 2016 Oct;17(10):1374-1385.
28. Powles T, O'Donnell PH, Massard C,et al.Efficacy and Safety of Durvalumab in Locally Advanced or Metastatic Urothelial Carcinoma: Updated Results From a Phase 1/2 Open-label Study. JAMA oncology 2017, 3(9):e172411.
29. Carbognin L, Pilotto S, Milella M, et al.Differential Activity of Nivolumab, Pembrolizumab and MPDL3280A according to the Tumor Expression of Programmed Death-Ligand-1 (PD-L1): Sensitivity Analysis of Trials in Melanoma, Lung and Genitourinary Cancers. PloS one 2015, 10(6):e0130142.
30. Gwynn ME, DeRemer DL.The Emerging Role of PD-1/PD-L1-Targeting Immunotherapy in the Treatment of Metastatic Urothelial Carcinoma. The Annals of pharmacotherapy 2017:1060028017727546.
31. Long GV, Atkinson V, Cebon JS,et al.Standard-dose pembrolizumab in combination with reduced-dose ipilimumab for patients with advanced melanoma (KEYNOTE-029): an open-label, phase 1b trial. The Lancet Oncology 2017, 18(9):1202-1210.
32. Hodi FS, Chesney J, Pavlick AC, et al.Combined nivolumab and ipilimumab versus ipilimumab alone in patients with advanced melanoma: 2-year overall survival outcomes in a multicentre, randomised, controlled, phase 2 trial. The Lancet Oncology 2016, 17(11):1558-1568.