一文读懂丨ICPi在肿瘤免疫治疗中的应用
导读
单独或联合应用抗CTLA-4或PD-1抗体治疗使得各种癌症患者出现了空前的长期肿瘤反应速率,ICPi诱导免疫应答的主要前提是预先存在受限于特异性免疫检查点的抗肿瘤T细胞。尽管大多数出现肿瘤反应的患者保持了长期疾病控制,但是三分之一的患者仍会复发。目前,我们对获得性耐药机制尚知之甚少,但是相关证据表明,新一代组合治疗方案可能会攻克免疫检查点治疗的耐药机制。
2013年,Science杂志将免疫治疗定义为“本年度最大突破”,其主要依据有二:CAR-T治疗和阻断免疫调节性检查点的免疫调节疗法的出现。过去几十年来,分子生物学,病毒学,免疫学,细胞生物学和结构生物学的发展推动了肿瘤免疫治疗的临床进展。
CTLA-4作为必需免疫检查点及其临床活性
上世纪90年代,James Allison和Jeffrey Bluestone博士分别牵头的两组研究证实CTLA-4蛋白质可以有效抑制调节性T细胞应答。在静息T细胞中,CTLA-4是细胞内蛋白质;然而,与TCR结合后,通过CD28共刺激信号,CTLA-4转移至细胞表面,在此处与关键共刺激分子(CD80,CD86)结合,并介导抑制性信号进入T细胞,抑制T细胞增殖和活化。缺乏CTLA-4的小鼠模型提供了CTLA-4作为必需免疫检查点的额外支持,因为这些小鼠死于几乎所有器官的爆发性淋巴细胞浸润。Bluestone博士选择继续运用这些重要知识来控制自身免疫性疾病,但是Allison博士推测,如果该分子“制动器”被抗体暂时阻断,那么就可能使得T细胞库增殖并被激活至超过正常生理所允许的点。最初临床前理论验证研究表明,CTLA-4阻断性抗体可能导致同基因动物模型中已建立的肿瘤持续消退。
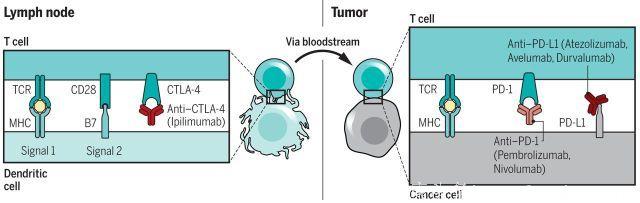
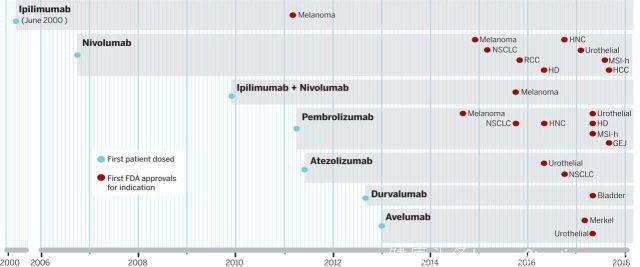
截至目前,已有六种阻断免疫检查点的抗体和两种免疫检查点阻断抗体组合药物获药品监管部门的批准。其中,2000年,ipilimumab和 tremelimumab被引入晚期癌症患者的临床试验,2001年ipilimumab获美国FDA批准用于晚期黑色素瘤治疗。Tremelimumab的临床试验仍在进行中,最近,其他CTLA-4阻断抗体也进入临床试验阶段。
PD-1作为必需免疫检查点
PD-1的名称来源于其作为诱导活化T细胞杂交瘤细胞死亡受体的描述。近年来的研究表明,PD-1是一种免疫检查点,其抑制功能由酪氨酸磷酸酶SHP-2介导。PD-1有两种配体PD-L1和PD-L2,PD-L1主要由暴露于促炎细胞因子的多数体细胞表达,PD-L2更严格地表达于抗原提呈细胞。肿瘤微环境中炎症诱导的PD-L1表达导致PD-1介导的T细胞耗竭,从而抑制抗肿瘤毒性T细胞应答。

随着时间的推移,肿瘤从原发性病灶转移至转移性病灶,抗肿瘤T细胞反复识别同源肿瘤抗原。TCR触发导致产生促炎细胞因子,如IFN-γ-反应性PD-L1表达最强的刺激物。T细胞长期暴露于同源抗原导致靶细胞反应性PD-L1表达,并且T细胞中持续的PD-1信号传导将诱导T细胞耗竭表观遗传模式。相关研究表明,PD-L1与T细胞表达的共刺激分子CD80结合,产生抑制信号。排斥导向分子b(RGMb)与PD-L2结合可能与肺耐受相关。
PD-1是预先存在的免疫应答负调节因子,PD-1阻断导致抗肿瘤T细胞优先被激活。相较于CTLA-4 缺陷小鼠,PD-1缺陷表型限制性小鼠强调了PD-1的限制作用。PD-1通路阻断对抗肿瘤T细胞具有更特异性的作用(可能是由于它们的慢性刺激状态以及相较于CTLA-4抑制剂更有限的毒性)。
PD-1和PD-L1阻断治疗的临床疗效
多种肿瘤患者潜在的生物学和持久应答率表明,PD-1通路阻断性治疗是肿瘤治疗史上最重要的进展之一。目前,FDA批准了5种抗PD-1/PD-L1抗体用于11种肿瘤适应症的治疗。首个证实PD-1阻断剂抗肿瘤活性的药物是nivolumab(既往称为MDX-1106/BMS936558)。2006年10月,I期单次输注剂量递增试验中,nivolumab首次用于患者,这是第一例PD-1抑制剂。每2周接受nivolumab治疗的16例初治患者中,6例出现客观肿瘤反应,包括黑色素瘤,肾细胞癌和NSCLC患者。2011年,抗PD-1抗体pembrolizumab进入临床试验。由于nivolumab带来的令人兴奋的临床数据,pembrolizumab临床研发侧重于转移性黑色素瘤和NSCLC患者的治疗。2014年FDA批准pembrolizumab和nivolumab用于治疗难治性黑色素瘤患者,2015年批准用于晚期NSCLC患者。
Atezolizumab是首个获批用于尿路上皮癌治疗的抗PD-L1抗体(2016年),随后2017年,avelumab获批用于Merkel细胞癌的治疗。这类药物是首个FDA基于特征而非肿瘤起源批准用于肿瘤治疗的药物,2017年pembrolizumab和nivolumab获批用于治疗任何来源的微卫星不稳定癌症。
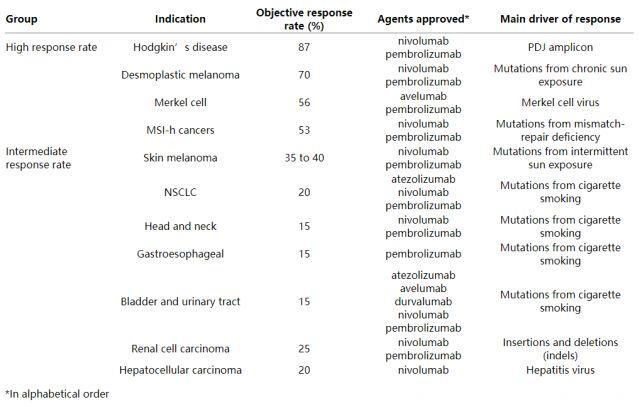
单药PD-1阻断治疗在霍奇金淋巴瘤,病毒诱导的皮肤Merkel细胞癌,错配/修复缺陷的高突变负荷微卫星不稳定性肿瘤以及结缔组织增生性黑素瘤中具有最高抗肿瘤活性。这些肿瘤患者的反应率为50~90%。第二组具有较高反应率的肿瘤为致癌物诱导的癌症,包括皮肤间歇性暴露引起的较常见黑色素瘤变体(前期反应率介于35%-40%)以及一系列吸烟致癌作用相关癌症,如NSCLC和头颈癌,胃食管癌,膀胱癌和尿路上皮癌(反应率介于15%-25%)。
一旦实现客观肿瘤反应,大多数患者仍然持续缓解。免疫治疗可能诱导持久的反应,然而,反应一段时间后,难治性和获得性耐药性成为检查点抑制剂免疫治疗面对的主要问题。
单药PD-1通路阻滞剂具有相对较小的毒性,大多数单药抗PD-1/PD-L1抗体治疗患者治疗相关死亡率较低。极少数患者(约~5%)由于毒性而停止治疗。15%-20%的患者最常见治疗相关不良事件为疲劳,腹泻,皮疹和瘙痒。较少患者出现严重毒性,包括内分泌疾病,如甲状腺疾病,垂体炎,肾上腺疾病和I型糖尿病。严重的内脏器官炎症毒性也很罕见,但是其可能影响其他器官,包括大脑(脑病),脑膜(脑膜炎),肺(肺炎),心脏(心肌炎),胃肠道(食管炎,结肠炎),肝脏(肝炎)和肾脏(肾炎)等。PD-1和CTLA-4阻断治疗临床相关毒性治疗的基石为免疫抑制疗法,高剂量皮质类固醇激素,有时可能包括肿瘤坏死因子拮抗剂和麦考酚酸酯。
CTLA-4和PD-1抑制剂联合治疗
2009年12月,首例患者接受ipilimumab(CTLA-4阻断剂)和nivolumab(PD-1阻断剂)联合治疗。这是基于这两种通路的共抑制作用设计的治疗方案,临床前研究发现了同基因小鼠模型中协同作用的证据。此外,CTLA-4和PD-1通路阻断可能起作用的不同免疫微环境提供了另外的机制原理。CTLA-4主要与影响引流淋巴结中的抑制性串扰相关。最近,Allison实验室运用CyTOF证实,CTLA-4和PD-1阻断剂引起T细胞亚群不同的表型特征。
Ipilimumab+nivolumab联合治疗初始I期试验在转移性黑色素瘤患者中进行,结果表明,筛选用于II期和III期试验的剂量水平客观反应率>50%。相较于单一治疗试验数据,这与更高频率的高度免疫相关毒性相关。Ipilimumab+nivolumab联合治疗II期和III期研究证实,缓解率接近60%,最新分析表明,最初随机接受联合治疗的患者3年生存期略高于最初接受nivolumab治疗的患者,但毒性频率较高。初步确定哪些患者需要联合用药的重点在于肿瘤PD-L1表达,这表明相较于单独使用nivolumab治疗,PD-L1不表达或少表达(表面染色的肿瘤细胞<1%)的肿瘤患者联合治疗后生存期改善。正在进行的试验正在研究一种及早评估反应的适应性给药方案,以减少联合用药剂量并降低毒性。
参考文献:
1. D. S. Shin, J. M. Zaretsky, H. Escuin-Ordinas, Primary resistance to PD-1 blockade mediated by JAK1/2 mutations. Cancer Discov. 7, 188–201 (2017).
2. A. Garcia-Diaz, D. S. Shin, B. H. Moreno, J. Saco, H. Escuin-Ordinas, G. A. Rodriguez, J. M. Zaretsky, Interferon receptor signaling pathways regulating PD-L1 and PD-L2 expression. Cell Reports 19, 1189–1201 (2017).
3. S. C. Wei, J. H. Levine, A. P. Cogdill, Y. Zhao, N. A. S. Anang, M. C. Andrews, P. Sharma, J. Wang, J. A. Wargo, D. Pe’er, J. P. Allison, Distinct cellular mechanisms underlie anti-CTLA-4 and anti-PD-1 checkpoint blockade. Cell 170, 1120–1133.e17 (2017).
1.靶向和免疫治疗新时代,肾癌从无到有的突破
2.速递丨靶向YAP介导的T细胞抑制或将改善BRAF突变型黑素瘤患者预后
3.顶级期刊《科学》封面及特刊聚焦肿瘤免疫治疗:大牛畅谈免疫治疗革命!