CAR-T全新升级,抗癌效果至少翻了3倍
就在今天,CAR-T领域迎来了一项超级重磅的进展。来自日本山口大学免疫学系的玉田耕治(Koji Tamada)教授成功开发出了新一代CAR-T。
同时,在多种实体瘤小鼠模型中,Tamada教授证实,全新CAR-T治疗实体瘤的效果是目前常规CAR-T的至少4倍,对于那些常规CAR-T几乎无效的实体瘤,新一代CAR-T也能实现肿瘤的完全消除。更重要地是,全新一代CAR-T还解决了常规CAR-T治疗后易复发的难题。表现为,即使在新一代CAR-T消除实体瘤100天之后,再次接种癌细胞,这些癌细胞也无法生长出肿瘤。这一发现发表在《自然生物技术》杂志上[1]。

Tamada教授
说到这里,大家肯定想知道,新一代CAR-T到底做了那些改变。
为此,我们需要简单了解CAR-T。CAR-T的目标,无非就是通过改造普通T细胞,让它具备更强地杀伤力,可以更精准有效地对抗肿瘤[2]。这就好比Tony Stark把自己改装成了钢铁侠,战斗力突然暴增,面对大BOSS一点儿也不虚。
但是,大家也都知道,钢铁侠在对战地球大BOSS的时候虽然可以得心应手,但是一旦碰到外星邪恶势力,就无能为力了。这时候,只有呼叫自己的队友,什么绿巨人,黑寡妇,美国队长,雷神等等,才能维护地球和平。而这就是新一代CAR-T最主要的改变,从单纯杀死癌细胞,转变为可以搭载免疫调节分子召集机体免疫细胞共同作战。
Tamada教授的课题组长期致力于CAR-T的改造和优化,力图将CAR-T运用到实体瘤上。
此前的研究表明,淋巴组织中的网状成纤维细胞可以分泌趋化因子IL7以及CCL19,其中CCL19可以募集外周T细胞及树突状细胞进入淋巴组织,而IL7在促进T细胞增殖同时可以维持T细胞稳定[3]。
这让Tamada教授看到了希望。所以,Tamada教授所开发的全新一代CAR-T其实就是在常规CAR-T基础上进行改造,使常规CAR-T可以表达IL7和CCL19两种趋化因子。因此,新一代CAR-T也被命名为7×19CAR-T。
显然,在Tamada教授看来,如果可以让CAR-T表达IL7和CCL19,那么进入实体瘤中的新一代CAR-T就可以模仿淋巴组织中的网状成纤维细胞,召集其他部位的免疫细胞进入肿瘤组织,共同对抗实体瘤。
当然,新一代CAR-T到底行不行,还是需要实验数据来说话。
在体外实验中,Tamada教授发现,表达IL7和CCR19的新一代CAR-T,增殖能力是普通CAR-T的两倍,而在井间迁移试验中募集免疫细胞的能力是普通CAR-T的至少5倍。同时,IL7受体抑制剂可以完全消除新一代CAR-T被增强的增殖能力,而CCL19受体抑制剂同样也可以完全消除新一代CAR-T的募集免疫细胞的能力。
这些实验表明,新一代CAR-T的增殖能力以及募集免疫细胞的能力的确是由IL7和CCR19赋予的。
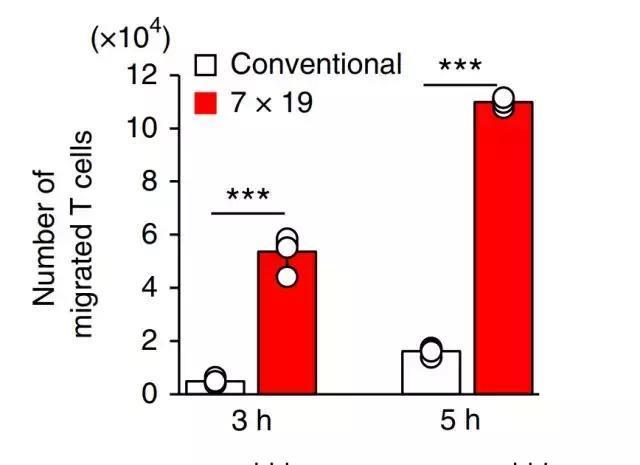
相比于常规CAR-T(白色),新一代CAR-T募集免疫细胞的能力显著增强(红色)
随后,Tamada教授便开始测试新一代CAR-T在体内的抗肿瘤活性。
首先是肥大细胞瘤小鼠模型。接受适量环磷酰胺预处理后的肥大细胞瘤小鼠分别接受常规CAR-T或新一代CAR-T治疗。结果Tamada教授发现,常规CAR-T只能稍微改善肥大细胞瘤小鼠的生存,而新一代CAR-T可以使所有实验小鼠的肿瘤完全消除,同时在140天的观察期内没有复发。
有趣的是,Tamada教授还证明了,单次注射1×10^6个新一代CAR-T细胞,引发的抗肿瘤效果比注射4×10^6个常规CAR-T细胞还要好。也就是说,新一代CAR-T细胞的抗实体瘤效果是常规CAR-T的至少4倍。

肥大细胞瘤小鼠存活率,红色代表接受新一代CAR-T,蓝色代表常规CAR-T
之后,Tamada教授还在肺腺癌小鼠以及胰腺癌小鼠模型中进行了实验。发现,虽然常规CAR-T对于肺腺癌基本无效,对于胰腺癌完全无效;但新一代CAR-T在肺腺癌小鼠体内同样实现了肿瘤组织的完全消除,并对胰腺癌小鼠体内的肿瘤实现了长期抑制,显著延长了小鼠的生存期。
同时,为了确定同时表达IL7和CCL19对于新一代CAR-T起效的必要性。Tamada教授分别建立了只表达IL7的CAR-T以及只表达CCR19的CAR-T,然后分别进行实验。结果发现,无论是7CAR-T还是19CAR-T,甚至二者1:1混合,都仅和普通CAR-T效果相当。这也意味着,IL7和CCR19的同时表达对于新一代CAR-T起效至关重要。
此外,通过活体小鼠成像以及组织活检,Tamada教授发现,新一代CAR-T而不是普通CAR-T,在注射后可以全部进入实体瘤内,并诱导大量的机体本身的T细胞以及树突状细胞进入实体瘤组织,共同发挥抗癌作用。
最后,Tamada教授还发现,接受新一代CAR-T治疗的小鼠,其机体内产生了大量的癌症记忆T细胞,可以有效预防癌症复发。表现为,即使在使用新一代CAR-T100天后,再次接种癌细胞,也无法在小鼠体内形成肿瘤。
总体而言,Tamada教授成功的开发了新一代CAR-T,可以有效对抗实体瘤。同时,这一研究也意味着,适当的结合CAR和免疫调节因子如IL17以及CCR19等等,可以有效增强CAR-T以及机体本身T细胞的抗实体瘤活性。
正如Tamada教授所说,“我们的研究表明,CAR-T细胞不仅可以直接发挥抗癌作用,也可以作为细胞载体,将免疫调节分子传递到肿瘤微环境,从而在体内触发、增强和维持抗肿瘤免疫反应。”目前,Tamada教授的团队正在和Noiruimyun Biotech公司洽谈临床合作[4]。
参考资料:
1.https://www.nature.com/articles/nbt.4086#auth-6
2.Rosenberg S A, Restifo N P. Adoptive cell transfer as personalized immunotherapy for human cancer[J]. Science, 2015, 348(6230): 62-68.
3.Link A, Vogt T K, Favre S, et al. Fibroblastic reticular cells in lymph nodes regulate the homeostasis of naive T cells[J]. Nature immunology, 2007, 8(11): 1255.
4.https://www.amed.go.jp/news/release_20180306-02.html