组织依赖性TME与免疫治疗丨研究“拐点”
导读
肿瘤免疫学最新进展使我们对肿瘤微环境(TME)在肿瘤发生、发展和转移中的作用有了更深层次的理解。肿瘤可发生于身体内的许多部位,恶性肿瘤细胞和非恶性细胞的协同进化促使肿瘤发生部位形成了TME。然而,不同解剖学部位的TME具有特异性差异,这些组织特异性TME调节肿瘤生长,决定转移进展,并影响治疗反应结果。因此,更深入了解组织特异性TME将有助于研发有效的抗肿瘤免疫疗法,并辅助预测临床结果。
肿瘤细胞存在于复杂肿瘤微环境中,并非孤立生长的。TME包含造血细胞(淋巴细胞和骨髓细胞)、间充质细胞(成纤维细胞,肌成纤维细胞,间充质干细胞,脂肪细胞和内皮细胞)以及细胞外基质(ECM)。TME的组成成分受肿瘤细胞控制,并参与肿瘤进展。肿瘤在各种组织中发生并转移。有明确证据表明,肿瘤生长的组织影响TME的构成。组织特异性TME调节肿瘤生长,决定转移进展,并影响治疗反应结果。
免疫抑制性TME及其对治疗反应的影响
逃避免疫应答是肿瘤的一种新兴标志。TME中包含有免疫抑制性细胞,如Treg,髓源性抑制细胞(MDS)C和肿瘤相关巨噬细胞(TAM)。这些细胞可以表达免疫调节因子,如IL-4,IL-10,IL-3和精氨酸酶1(Arg1),从而抑制或重设抗肿瘤免疫应答。研究表明,耗竭小鼠肿瘤模型中的免疫抑制性细胞可以减缓肿瘤生长和进展;此外,在人类肿瘤中,免疫抑制性细胞浸润与不良预后相关。
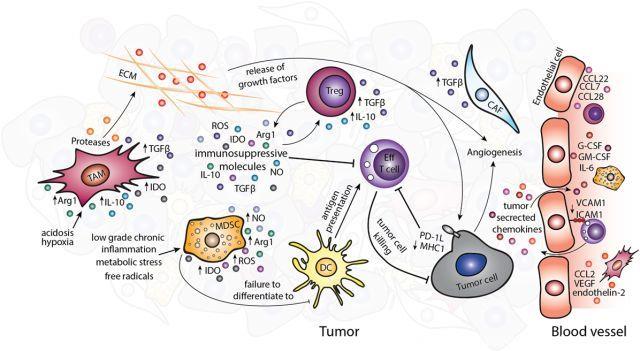
TME中的非免疫细胞也有助于增强肿瘤发生,并且可以直接影响抗肿瘤免疫应答。肿瘤相关成纤维细胞(CAF)可以分泌改变TME并支持肿瘤进展的原癌基因分子,如有丝分裂生长因子,促学管生成因子和TGF-β。混乱的肿瘤脉管系统(包含内皮细胞和周细胞)通常较正常血管渗透性差,因此不支持细胞毒性免疫细胞向肿瘤的有效运输。TME中促血管生成信号的表达,如基质衍生因子1,血小板反应蛋白和基质金属蛋白酶,可以进一步促进肿瘤脉管系统改变。肿瘤中,在组织稳态中起重要作用的非细胞ECM也会因ECM合成和分泌失衡而改变,改变的ECM导致组织结构改变,释放可溶性分子和生长因子。这些变化会影响免疫细胞的作用,进一步扩大TME。
靶向肿瘤并改变免疫TME的免疫治疗已经彻底改变了肿瘤治疗。近年来最受欢迎的免疫治疗主要有两种:免疫检查点抑制剂(ICI)和过继性细胞转移(ACT)。目前用于黑色素瘤治疗的ICI主要为CTLA-4抗体(ipilimumab)以及最新研发的PD-1轴抑制剂(如nivolumab,pembrolizumab)。单用nivolumab和ipilimumab治疗的转移性黑色素瘤患者的客观缓解率分别为43.7%和19%,nivolumab+ipilimumab联合治疗的缓解率更高(57.6%)。此外,ICI还在其他实体瘤中发挥疗效,如NSCLC何肾细胞癌。大量研究表明,难治性/晚期NSCLC患者的客观缓解率分别为14.5%和44.8%,转移性肾细胞癌患者的客观缓解率为20%-22%。然而,并非所有患者均能得到临床获益,这通常归因于TME介导的新生耐药性。
有助于免疫抑制性TME的各种细胞亚型与治疗疗效降低有关。MDSC细胞数较多与各种免疫治疗不良反应相关。效应T细胞/Treg的比率与抗CTLA-4检查点抑制剂治疗反应相关(较高的Treg与疗效降低相关)。应用抗CSF-1R抗体阻断TAM招募与ACT和检查点抑制剂协同作用表明,TAM在介导免疫治疗反应中发挥关键作用。总之,TME在调节靶向肿瘤和基质抗肿瘤治疗应答中发挥重要作用。
组织特异性TME
相关证据表明,肿瘤发生和转移具有组织特异性。起源于同一器官或组织的肿瘤细胞通常共享特定的驱动突变。在家族性肿瘤中,遗传性驱动基因突变会导致特定器官癌变,如BRCA1 和BRCA2型遗传性乳腺癌和卵巢癌。人们想当然的认为,组织特异性肿瘤发生的最简单原因为:突变基因仅在肿瘤常发生的组织中表达。然而,事实并非如此,许多驱动基因表达于不会因突变而形成肿瘤的各种组织中。组织特异性肿瘤发生可以通过多种因素解释:其一,组织微环境中可能存在各种细胞。例如,肝脏和胰腺内的肌成纤维样星形细胞是纤维化病变的驱动因素,并且可以促进肿瘤发展。其二,不同肿瘤生长于特定的器官,即种子和土壤假说或亲器官性。由于肿瘤分泌因子和肿瘤脱落胞外膜泡,转移部位的组织微环境发生改变,形成转移前生态位。因此,起源组织是恶性转化和转移性聚集的特异性调节物。
临床前和临床证据表明,肿瘤生长的组织是影响TME建立的一种因素。大量研究表明,位于不同解剖学部位,基因相同的肿瘤具有部位特异性转录子,蛋白和代谢谱。原位肿瘤RNA表达谱分析表明,已知胰腺癌相关基因表达升高,如MUC4和TGF-β2。SC和原位肾细胞癌(SN12C和SN12PM6)或原位前列腺癌(PC-3M)单独对比研究表明,SC肿瘤中碱性成纤维细胞生长因子mRNA和蛋白质表达降低。PC-3M前列腺癌模型中,原位肿瘤较SC肿瘤表达更低水平的其它促癌转录子,如编码EGFR,mdr-1,IV型胶原酶和IL-8的转录子。最近,研究人员运用1H NMR光谱学,进行了SC或原位肿瘤胰腺导管腺癌细胞系(Panc-1和BxPC-3) 代谢组学研究,结果表明,SC和原位肿瘤小鼠肿瘤代谢物存在显著差异;相较于SC肿瘤,原位肿瘤具有更高水平的腺苷(免疫抑制代谢物)。因此,当前研究证据说明,肿瘤生长组织可能影响肿瘤的分子组成,如RNA,蛋白质和代谢物。此外,原位肿瘤的TME较SC肿瘤具有更强的免疫抑制性和促癌性。
TME细胞构成也随肿瘤生长组织改变。一项高级浆液性卵巢腺癌患者多发转移研究表明,多个不同肿瘤微环境共存于同一患者体内。每一肿瘤中,经免疫相关基因IHC和RNA测序评估的肿瘤免疫浸润和活化不同。化疗后缓解的肿瘤出现大量效应T细胞浸润,而稳定的肿瘤具有低水平T细胞浸润,无应答肿瘤没有免疫细胞浸润。这说明,局部TME可以改变免疫渗透。
组织特异性TME对治疗反应的影响
生长于不同解剖学部位的肿瘤具有不同的TME。当肿瘤发生部位不同时,组织特异性TME可能影响作用于相应肿瘤生长部位的治疗疗效。
最新临床前研究表明,肿瘤生长部位可能决定抗癌疗效。一项试验已经证实,在多个小鼠肿瘤模型中,SC肿瘤较内脏肿瘤trimAb免疫治疗(抗DR5,抗CD40和抗4-1BB)反应更快。应用trimAb可能根除小鼠SC肿瘤。然而,尽管两个部位的肿瘤大小相似,但是相较于SC肿瘤,原位肿瘤trimAb抗肿瘤治疗疗效大大降低。由于分离自Renca SC和原位肿瘤的肿瘤细胞关键特征相似,如MHC I类分子和DR5表达,因此恶性细胞并不会导致治疗反应出现显著差异。不管肿瘤分离部位是否相同,将重新分离的肿瘤细胞注射回相同或相对部位时观察到相同部位特异性trimAb治疗反应。原位或SC Renca肿瘤FACS分析表明,识别免疫抑制性M2巨噬细胞/TAM的F4/80高CD206+细胞增加。此外,消除TAM招募和分化的重要因子,如CCL2和IL-3,改善了原位Renca肿瘤的应答,这说明该亚组可能有助于降低trimAb的功效。
稳定表达HPV16-E7的TC-1肿瘤对疫苗的应答取决于肿瘤移植部位。该疫苗由编码HPV16-E7癌蛋白的mRNA与TriMix组成。植入SC的肿瘤细胞对E7-TriMix的应答最强,肺癌应答不太明显,而当肿瘤细胞植入生殖道时,治疗反应进一步降低。虽然FACS测定显示,接种疫苗的SC肿瘤中Treg比例显著减少,但是Treg仅在肺癌中稍微减少,在生殖道肿瘤中则不受影响。另外,生殖道肿瘤较其他肿瘤具有更高比例的粒细胞和单核细胞MDSC。经E7-TriMix治疗后,生殖道肿瘤中MDSC比例没有降低。结肠癌细胞CT26移植瘤模型中,原位结肠癌较SC肿瘤具有更高的T细胞,B细胞和NK细胞浸润,而(CD11b+CD11c−) Ly6G +或Ly6C +髓样细胞浸润较少。该模型中,相较于较SC肿瘤,原位肿瘤免疫检查点抑制剂联合治疗(抗CTLA-4和抗PD-1)反应增强。小鼠黑色素瘤模型也表明,免疫治疗的细胞应答具有肿瘤部位依赖性差异。该研究表明,血液中Ly6C+单核细胞募集对于抗体依赖性肿瘤细胞杀伤黑色素瘤至关重要。
最新免疫治疗临床前模型研究证实,组织特异性微环境影响免疫治疗反应。从逻辑上讲,数据提示了免疫抑制性TME与免疫治疗疗效降低之间的关系。目前仍需进一步表征组织特异性TME和免疫治疗反应,探究这些特征与人类肿瘤之间的相关性。
晚期癌症患者常见的临床问题是不同的全身治疗反应,相较于其他解剖学部位,某些病变治疗疗效可能较差。这可能是由于肿瘤异质性,但是局部TME也可能发挥重要作用。转移性黑色素瘤患者的生存可能取决于肿瘤的解剖学部位。在有效黑色素瘤系统治疗“缺席”的时代,相较于肺癌或其他非肺脏内转移患者,皮下淋巴结或皮肤转移性患者具有较好的生存。此外,皮下转移患者高剂量IL-2应答率约为50%,内脏转移患者仅为13%。因此,ICI在不同解剖学部位表现出不同的反应率,利于皮下和肺部转移患者治疗。
晚期黑色素瘤和NSCLC抗PD-1治疗的回顾性分析显示,肝转移患者较其他内脏部位转移患者生存结果较差。转移性三阴性乳腺癌患者抗PD-1治疗队列研究表明,TIL水平和治疗疗效取决于转移部位。相较于其他器官(如肝脏)转移,淋巴结转移与更好的应答密切相关。整体而言,不计肿瘤类型,相较于其他部位转移,肝转移ICI治疗疗效降低。
肿瘤间的“Cross Talk”
由于转移性生长或双侧肿瘤的存在,不同肿瘤可能同时存在于同一患者的不同器官中。最新发布的研究表明,同时发生的肿瘤可能相互影响。一项研究表明,伴治疗耐药肿瘤生长的小鼠既往免疫治疗疗效降低。当同一小鼠存在原位肾脏肿瘤时,SC Renca肿瘤免疫治疗疗效降低;当同一SC肿瘤同时存在时没有观察到上述情况。伴肾癌的SC肿瘤TME类似于先前肾癌模型中观察到的免疫抑制性TME。阻断运输(抗CCL2抗体)或消耗巨噬细胞(clodrolip)提高了SC肿瘤免疫治疗作用,这说明,抵抗性肿瘤内的免疫抑制性细胞可迁移至易反应肿瘤并抑制治疗反应。
人类不同部位肿瘤间存在潜在相互干扰。在转移性黑色素瘤中,相较于仅皮肤/SC转移的患者(50%),伴内脏转移的皮肤/SC转移IL-2治疗客观缓解率较低(14%)。加利福尼亚大学Lee等人于2017年ASCO会议上发表的研究表明,伴其他肝转移的黑色素瘤患者CD8+效应T细胞比例较低,肿瘤浸润淋巴细胞内耗竭的CTLA-4+PD1+CD8+活化T细胞比例较高,这与PD-1抑制剂应答降低相关。相较于仅有SC肿瘤的小鼠,SC和肝脏肿瘤小鼠肿瘤生长增加,并且抗PD-1治疗疗效降低。然而,肺转移或不相关MC38肝肿瘤植入SC B16肿瘤负荷小鼠并未改变SC肿瘤生长。该研究表明,肝转移可能与皮肤中的黑色素瘤相互干扰,导致效应T细胞应答减少,PD-1抑制剂应答降低。这些发现对于指导治疗策略至关重要。切除或根除免疫治疗抵抗性肿瘤后进行免疫治疗可能改善患者结局。
总结
传统治疗通常聚焦于恶性细胞,但是TME中的非恶性细胞在肿瘤生长,进展以及治疗应答中发挥重要作用。肿瘤生长的组织对TME构成和免疫治疗应答具有新的作用。大量最新研究表明,不同组织中的肿瘤生长促进组织特异性TME发展。此外,新的证据表明,具有不同TME和治疗反应的肿瘤可以相互干扰,相互影响。深入了解这些独特的抵抗性器官特异性机制可能有助于制定个体化免疫治疗方案。目前正在研发靶向其他免疫检查点(如LAG-3,TIM-3),细胞因子(如TGF-β),溶瘤病毒和其它免疫抑制介质(如IDO,腺苷)的新型免疫治疗组合方案,这些新型药物也可能因器官部位具有不同的活性。因此,根据器官特异性TME调整免疫治疗组合可能改善治疗获益,尤其是转移性疾病。
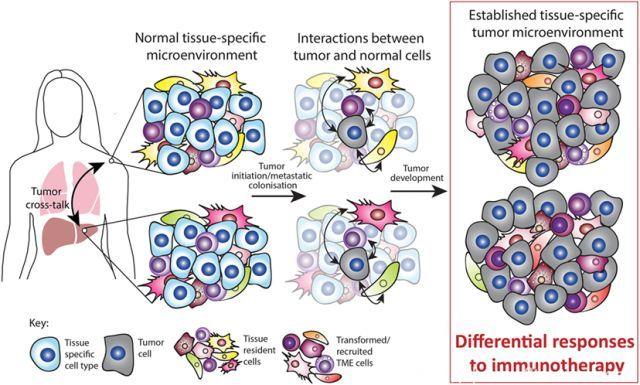
然而,人类肿瘤组织特异性差异特征为技术和研究带来了挑战。肿瘤的遗传异质性使区分器官微环境与肿瘤类型以及基因突变的影响变得更加困难。
文章编译自:Amanda J. Oliver,imagePeter K. H. Lau,imageAshleigh S. Unsworth, imageSherene Loi,imagePhillip K. Darcy,imageMichael H. Kershaw and imageClare Y. Slaney. Tissue-Dependent Tumor Microenvironments and Their Impact on Immunotherapy Responses.Front. Immunol., 31 January 2018.
1.《Nature》重磅 | 免疫疗法最准确的生物标志物找到了?
2.【肿瘤免疫学院IO秒懂系列20】一种因吹斯汀分子-GITR
3.3D动画|3分钟看懂癌症的发生、转移与化疗