这有两种肠道细菌想介绍给你认识,能导致直结肠癌症发生!
导读
最新一期国际著名期刊《科学》杂志发表了一篇来自约翰霍普金斯大学的重磅研究,他们发现两种常见的肠道细菌联合作用促进了遗传性结直肠癌的发生。
不少研究者们在近年来已经把目光越来越投向微生物,就像投机的掘金人在深山老林里面游走,期望能够发现下一座金矿。
确实,人类的身体健康若是只考虑自身的细胞分子的作用,往往还不足以得到让人信服的答案,尤其是与微生物密切接触的身高器官组织比如肠道出现疾病,恐怕还得考虑一下微生物在其中有没有起作用。
结直肠癌(colorectal cancer)可能就是这样的一种疾病,与肠道中的微生物有关系。
最新一期著名学术期刊《科学》杂志发表了一篇来自约翰霍普金斯大学的重磅研究,他们发现两种常见的肠道细菌大肠杆菌E.coli(pks+亚型)以及脆弱类杆菌B. fragilis(ETBF亚型)的联合作用对于遗传性结直肠癌的发生具有关键作用。
结直肠癌高发
据我国国家癌症中心统计资料显示,在中国,每年新发癌症病例达429万,占全球新发病例的20%,死亡281万例。癌症防治已成为我国的重要公共卫生问题。
其中,结肠癌在我国发病率相当高,在男性中仅次于胃癌,排第三位,而在女性中也仅次于肺癌。
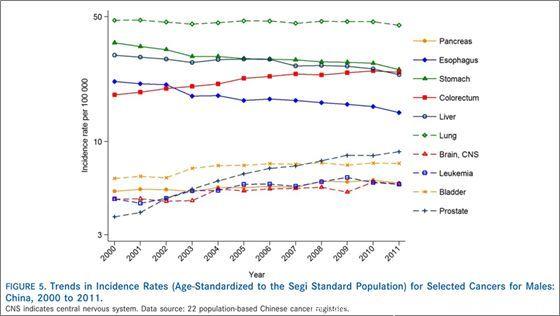
▲我国男性的各种肿瘤发病趋势情况,可以看到结直肠癌(colorectum)发病趋势平稳上升仅次于胃癌,超过肝癌排第三位(Cancer Statistics in China, 2015)
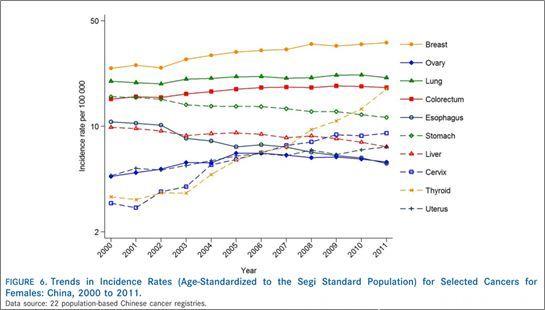
▲我国女性的各种肿瘤发病趋势情况,可以看到结直肠癌(colorectum)排第三位,仅次于肺癌(Cancer Statistics in China, 2015)
在美国亦是如此,结直肠癌具有高发病率以及高死亡率,在美国男性和女性中新增病例均在第三位,而死亡人数在美国男性和女性中也都排在第三位。

▲美国各种癌症的新增人数及死亡人数,可以看到,因结直肠癌(colon&rectum)新增及死亡的人数在男性和女性中均排第三位(Cancer Statistics, 2018)
结直肠癌与细菌
从遗传学观点出发,可将结直肠癌分为遗传性(家族性)和非遗传性(散发性)。
前者的典型例子比如家族性腺瘤性息肉病(family adenomatus polyposis,FAP)(约占结直肠癌1%)和家族遗传性非息肉病结直肠癌(约占结直肠癌5%)。后者主要是由环境因素引起基因突变,当然,即便是散发性结直肠癌,遗传亦起重要作用。
人类胃肠系统内大约含有1 000 种细菌,是人类真核细胞数量的10 倍以上,可想而知,探查胃肠道中的疾病若是不考虑一下细菌的的作用,恐怕难以真正知道疾病的背后的原因。

确实,结直肠癌与细菌的关系一直是关注的焦点,目前也有一定的研究显示,与健康对照组相比,结直肠癌患者的粪便梭杆菌、肠球菌科、弯曲杆菌、柯林斯菌属和消化链球菌明显增多,而梭状芽孢杆菌Ⅳ组的成员如柔嫩梭菌属和罗氏菌属则消耗殆尽。在肠黏膜中,结直肠癌患者的卟啉单胞菌属、梭杆菌和消化链球菌增加,而柔嫩梭菌属和双歧杆菌被耗尽。与结直肠癌相关的菌群则富集了促炎机会致病菌,如梭杆菌、肠球菌科和弯曲杆菌属等。这些结果均提示,肠道菌群种类和数目的变化在结直肠癌的发生和发展中具有重要作用。
然而,究竟这些细菌在结直肠癌的发生在具有怎样的作用,是辅助作用还是起主导作用?这其中的分子机制需要进一步探明。
这篇研究
由约翰霍普金斯大学大学Cynthia L. Sears教授领导的这篇研究以家族性腺瘤性息肉病(family adenomatus polyposis,FAP)(约占结直肠癌1%)为研究对象,来阐述细菌对其发生发展的机制。

Cynthia L. Sears教授
FAP患者十几岁时开始出现腺瘤,如果不治疗,到40岁时绝大多数的患者会转变为结直肠癌。然而,这到底是什么原因引起的呢?换句话说,本来FAP并不致命,虽然也是瘤子,但是是良性的,不致命,结果随着时间的延长,渐渐发展成为结直肠癌,这是什么原因导致的呢?研究者们一直没有搞清楚。
Cynthia L. Sears教授领导的团队决定从微生物的角度入手来探查一番。在FAP患者的肠道表面有一层厚厚的由微生物组成的膜,又叫做细菌生物膜(bacteria biofilm),是由细菌在肠道表面逐渐附着、增殖而成,成分也较为复杂。

细菌生物膜的形成过程
这层厚厚的细菌生物膜会不会与FAP转变成结直肠癌相关呢?
研究者们首先发现,FAP患者的这层厚厚的细菌生物膜中的细菌主要由两种细菌构成,一种是大肠杆菌E.coli,一种是脆弱类杆菌B. fragilis。
研究者们进一步研究之后,发现大肠杆菌E.coli的亚型pks+E.coli和脆弱类杆菌B. fragilis的亚型ETBF是主要的菌株。
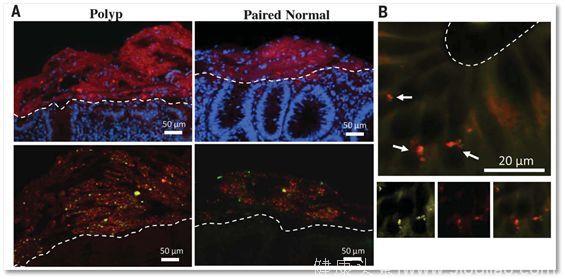
图中A小图上面一排显示FAP患者息肉上面的细菌生物膜(Polyp)和正常肠道组织上面的细菌生物膜对比,前者厚度明显大于后者(图中红色的部分,白线以上为菌膜);图中A小图下面一排则显示,菌膜的主要组成细菌是E.coli和B. fragilis(图中红色表示E.coli,绿色表示B. fragilis);B图则表明细菌已经侵入到FAP患者的正常肠道组织中去了(白线以下为肠道组织细胞,箭头显示的是细菌)
E.coli至少可分成A、B1、B2、D4个亚型,其中B2亚型携带一种保守的基因岛-“聚酮合成酶(polyketide synthase,pks)岛”,可产生一种多聚乙酰一肽的基因毒性物质(colibactin),其可以导致DNA损伤,造成癌变的发生。
脆弱类杆菌(B.fragilis)是正常人和动物结肠区域的厌氧菌,而ETBF是B.fragilis的一种亚型,感染后可无症状定植于人体内,也可引起腹泻等疾病,曾有小鼠实验表明ETBF可引起结肠炎性反应,并显著增加多发性肠道肿瘤小鼠模型中结肠肿瘤的发生率。
在FAP的人群中60%以上的人都具有pks+E.coli和ETBF,而正常人则只有20-30%的人含有这两种细菌。因此,研究者们有理由怀疑pks+E.coli和ETBF与FAP由良性向恶性的结直肠癌转变有关。
进一步研究
仅仅怀疑这两个细菌亚型是没有什么意思的,必须要拿出证据来说明一下。
因此,这又到了科学家们最常干的事情之一了,你说这两个细菌pks+E.coli和ETBF能够造成肿瘤,那我们就在小老鼠身上试一试,把这个细菌喂给小老鼠吃一吃,然后观察它们得没得肿瘤不就行了吗?
确实,研究者们也不必你高明多少,它们就是这么干的!
结果如何呢?
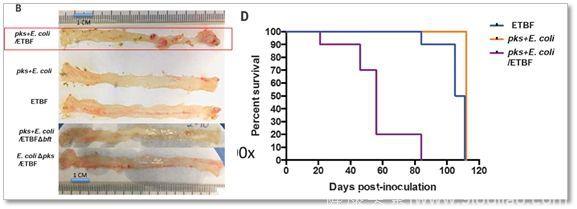
图中B小图显示在pks+E.coli和ETBF处理的各种情况下小鼠的肠道中的肿瘤情况,其中红线框中这一组显示pks+E.coli和ETBF联合处理能够让小鼠肠道长肿瘤(图中血色的凸起物为肿瘤),其他处理组则几乎没有肿瘤;D小图显示pks+E.coli和ETBF联合处理大幅降低小鼠的生存率(图中紫色线条)
结果显示,pks+E.coli和ETBF联合处理能够让小鼠肠道长肿瘤,并且大幅降低小鼠的生存率,而单独使用pks+E.coli或者ETBF则对小鼠没有太大的影响,这说明只有pks+E.coli和ETBF这两种细菌在一起才能够促使结直肠癌的形成。
原因是什么
确实,科学家之所以区别于常人,正是因为需要问一个“why”,为啥pks+E.coli和ETBF这两种细菌在一起就能够促使结直肠癌的形成呢?
研究者们继续深入探讨,一方面发现白介素17(IL-17)在这其中扮演着关键角色,因为,IL-17诱发了大量的炎症反应;另一方面发现,ETBF这种细菌能够有效地帮助pks+E.coli这种细菌定殖(colonization),这样一来,pks+E.coli越来越多,前面也说了,pks+E.coli会产生基因毒性物质(colibactin),其可以导致DNA损伤,造成癌变的发生,因此,越来越多的有毒物质colibactin就会对DNA造成更大的损伤,从而造成肿瘤。
然而,仅仅有上面的解释还不够,分子机制是什么呢?尤其是细菌BTBF是怎么帮助pks+E.coli定殖到肠道表面的呢?还有这个IL-17是怎么来的呢?恐怕还会有更加复杂因素。
▲这支研究团队在最新的另一权威杂志《Cell Host & Microbe》上面发表的相关文章
确实,这支约翰霍普金斯大学的研究者们在最新出版的另一权威杂志《Cell Host & Microbe》上面发表
那么,研究者们发现的是什么机制呢?
主要是首先,BTBF细菌产生一种毒素,叫做BFT(Bacteroides fragilis toxin ,BFT),这是一种依赖锌的金属蛋白,这种毒素可以激活Wnt/bcatenin通路以及NF-kB通路;这些通路一激活,就导致了大量的IL-17的产生,而IL-17就会和它的受体IL-17R结合,这就进一步激活了NF-kB通路NF-kB通路、STAT3,进而促使CXCL1等产生;CXCL1等产生之后就会招募大量的MDSC(Myeloid-derived suppressor cells,MDSCs)细胞。
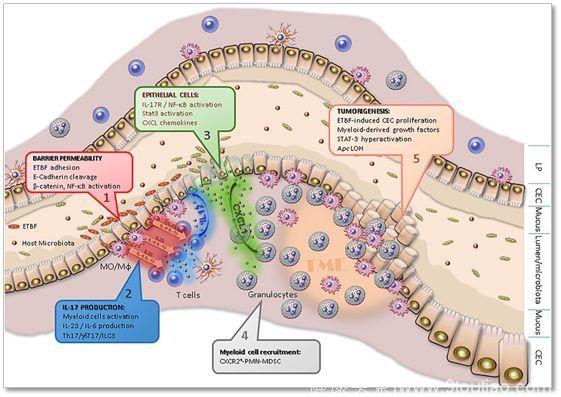
▲BTBF细菌诱导肿瘤发生的分子机制模式图
众所周知,MDSC细胞在肿瘤中起免疫抑制,促进肿瘤发生、侵袭转移和血管生成等作用。
因此,研究者们通过一篇《Science》和一篇《Cell》子刊,共两篇文章深入揭示了两种导致结直肠癌的细菌pks+E.coli和ETBF及其分子机制。为开发相关的肿瘤治疗方案提供了依据。
来源:转化医学平台
参考文献:
1. Patients with familial adenomatouspolyposis harbor colonic biofilms containing tumorigenic bacteria.
2.https://www.sciencedaily.com/releases/2018/02/180201173406.htm
3. Cancer Statistics in China, 2015
4. Cancer Statistics, 2018
5. 肠道菌群在结直肠癌发生和发展中的作用及其机制
6. Linking Gut Microbiota to ColorectalCancer
7. Bacteroides fragilis Toxin Coordinates aProcarcinogenic Inflammatory Cascade via Targeting of Colonic Epithelial Cells.
多西他赛治疗前列腺癌:效果与经济双重获益