两种细菌在遗传性癌症中被“钦定”为致癌驱动因素

最新研究显示,两种常见的细菌及其生成的生物膜已被确定为导致家族性腺瘤性息肉病(FAP)患者发生结直肠癌(CRC)的关键致癌驱动因子。这种途径的发现可能会引导出有针对性的治疗方法,从微生物群中消除致癌细菌,并在早期阻断或延缓结肠癌的形成。
01
现在,肠癌被认为是可以有效预防癌症,但是现实数据却啪啪打脸,2017年美国有将近50,000人死于肠癌,且仅一年就增加了100,000例新诊断的肠癌病例。这次发现的针对肠癌的特定细菌和微生物可能有助于预防肠癌,或者至少能帮助识别那些肠癌的高发患者。
这项研究有两项补充研究,其中一项发表在2月2日的《Science》杂志上,另一篇于2月1日发表在《Cell Host & Microbe》上。
先说那篇发表在Science上的研究,该研究描述了大肠杆菌和脆弱拟杆菌通过产生的毒素破坏了具有保护作用的结肠粘膜层,它们形成一个粘稠的生物膜,与结肠直肠癌形成的上皮细胞相邻。
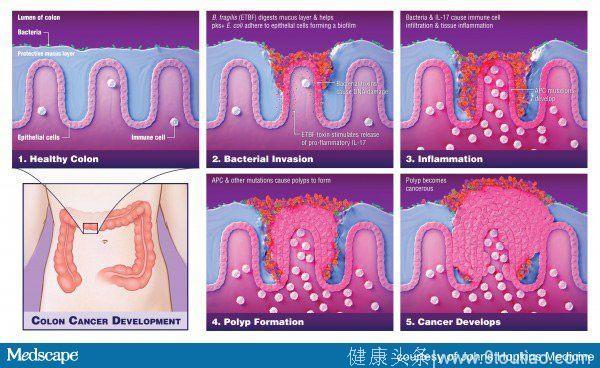
研究小组之前就报道过,偶发性结肠癌的患者中可以在正常长粘膜上观察到致癌的生物膜。这表明,生物的膜形成是影响结肠癌的重要事件。为了确定同一生物膜的形成是否也可能是FAP肿瘤发生的早期启动事件,研究小组比较了6名患者和20例接受筛查结肠镜检查或手术切除的患者的结肠黏膜。
结果显示,所有FAP患者在结肠黏膜层中都有细菌入侵的证据,而从6个FAP患者中收集到的结肠标本中,大约70%的结肠标本都覆盖了由大肠杆菌和脆弱拟杆菌组成的细菌性生物膜。此外,在所有患者的上皮细胞层中都有发现了这两种细菌,证据是片状生物膜,这也表明大肠杆菌和脆弱拟杆菌是FAP胃肠道中常见的黏膜固定器。
02
研究人员进一步分析了这两种细菌的致癌潜能,在FAP生物膜中发现的大肠杆菌菌株会分泌一种叫做Colibactin的蛋白,这种物质会破坏DNA,并导致DNA突变。更具体地说,大肠杆菌包含了聚酮合酶(pks)的基因毒性岛,它编码了Colibactin合成的基因。如果把这个pks基因删除掉,尽管肠炎依旧,但致癌性和侵润性减弱。因此,结直肠癌归根结底还是由肠道细菌感染产生的聚酮类化合物诱发的,这在小组对FAP标本的进一步分析中有重要的影响。
在FAP生物膜中发现的脆弱拟杆菌菌株是一种叫做ETBF的亚型,它激活了结肠上皮细胞的致癌通路并引起炎症。ETBF在FAP中的致瘤潜力有一部分和白细胞介素-17(IL-17)的产生来有关。通过与pks与大肠杆菌联合作用,会增加IL-17发生炎症诱导结肠癌的可能。
经过分析,从FAP患者中提取的肠粘膜中有超过2/3受pks和大肠杆菌的影响,有60%与ETBF相关。相比之下,来自健康志愿者的肠粘膜只有20%受pks和大肠杆菌影响,30%受ETBF影响。
Pks+大肠杆菌和ETBF在FAP结肠高频率的定植,证明了这两种细菌的潜在致癌影响。利用两种小鼠结肠癌模型,发现两种细菌共增殖会导致肿瘤的发生,而在其中一种小鼠模型中,研究人员也证明了,只有pks+大肠杆菌和ETBC共存的小鼠具有明显肿瘤诱导的证据,而那些只有两种菌株之一的鼠几乎没有肿瘤。
综合来看,这些数据表明,在超过一半的FAP患者中发现了与ETBF和pks+大肠杆菌的联合增殖,通过两个不同但互补的步骤促进了致癌作用。
03
至于具体机制,现在来看第一步是由脆弱拟杆菌毒素降解结肠黏液,然后使pks+大肠杆菌附着在结肠上皮细胞上,通过Colibactin蛋白引发损伤。第二步是IL-17诱导炎症,主要由ETBF菌株产生,然后通过pks+大肠杆菌的共同作用来增强。
研究人员表示,在数以万计的微生物中,只有少数细菌可能是推动结肠癌发展的早期关键因素。但对于FAP患者来说,这些因素又非常重要,因为在结肠肿瘤发病前,如果FAP患者的结肠黏膜中出现细菌,可以通过清除结肠内的这些细菌来减缓肿瘤的发展,从而使患者能够在较长一段时间内避免手术治疗。
参考资料:https://www.medscape.com/viewarticle/892280