CheckMate-012:Nivolumab和Ipilimumab双管齐下,一线治疗晚期非小细胞肺癌安全有效
导读
铂类联合其它化疗是非靶位基因突变非小细胞肺癌(NSCLC)患者的一线标准治疗,然而在过去三十年间疗效不佳,并具有中至重度毒性,包括血液学和非血液学毒性,如疲劳,恶心,呕吐和脱发。仅有30%以内的患者对化疗有反应,且反应持久性较差,接近一半的患者在1年内死亡。新诊断的晚期NSCLC患者需要长期生存获益的治疗策略。
抑制免疫检查点[如细胞毒T淋巴细胞抗原4(CTLA-4)和程序性死亡受体1(PD-1)]的抗体可改善不同类型癌症患者的预后。在NSCLC中,与多西他赛相比,nivolumab(一种抗PD-1的全人源化IgG4抗体)明显改善先前治疗过的晚期NSCLC患者的总生存期,且持续反应,即使停药后也持续数月或数年。
PD-1和CTLA-4通过不同的互补机制调节效应T细胞活化、增殖和功能,nivolumab加ipilimumab(抗CTLA-4的全人源化IgG1抗体)的组合可作为改善抗肿瘤免疫力的合理选择。相比nivolumab或ipilimumab单药治疗,nivolumab联合ipilimumab治疗转移性黑色素瘤,抗肿瘤活性强,并且在最少2年的随访时间内未达到中位总生存期。nivolumab联合ipilimumab治疗黑色素瘤已在美国和欧洲获批。
Checkmate012这项Ⅰ期多队列研究旨在评估nivolumab联合ipilimumab一线治疗晚期NSCLC的疗效和安全性。
研究方法
Checkmate 012研究是一项开放、Ⅰ期、多队列临床研究。研究纳入IIIb/IV期、先前未化疗过的NSCLC;年龄≥18岁;ECOG评分为0或1分;可测量病灶(RECIST v1.1);既往使用新辅助化疗和辅助化疗治疗局部晚期疾病是被允许的;之前接受过酪氨酸激酶抑制剂靶向治疗也是被允许的。
患者随机分配接受以下方案,直至疾病进展、出现不可耐受毒性或受试者退出试验:
1.早期方案中的初始队列:
A1组:nivolumab(1mg/kg,3周一次)加ipilimumab(3mg/kg,3周一次),再接受nivolumab(3mg/kg,2周一次)
A2组:nivolumab(3mg/kg,3周一次)加ipilimumab(1mg/kg,3周一次),再接受nivolumab(3mg/kg,2周一次)
2.后期修正方案中的队列:
B组:nivolumab(1mg/kg,3周一次)加ipilimumab(1mg/kg,3周一次),再接受nivolumab(3mg/kg,2周一次)
C组:nivolumab(1mg/kg,2周一次)加ipilimumab(1mg/kg,6周一次)
D组:nivolumab(3mg/kg,2周一次)加ipilimumab(1mg/kg,12周一次)
E组:nivolumab(3mg/kg,2周一次)加ipilimumab(1mg/kg,6周一次)
主要研究结果:安全性及耐受性
次要研究结果:客观缓解率(ORR)、中位反应时间、24周的无进展生存期(PFS)
研究结果
一、初始队列研究结果(N=49,中位随访时间:50周)
ORR:A1组为13%;A2组为20%;PD-L1+及PD-L1-的患者分别为19%和14%;
中位反应时间:均未达到。分别有67%和60%的患者仍能产生持续的疗效;
24周PFS率及中位PFS:A1组分别为44%和16.1周;A2组分别为33%和14.4周;
1年OS率和中位OS:A1组分别为65%和未达到;A2组分别为44%和47.9周;
安全性:3-4级治疗相关不良事件(AEs)的发生率为51%;因治疗相关AEs停止治疗的患者比例为37%。
二、后期队列研究结果
1.B组(N=31)和C组(N=30)的研究结果
安全性:3-4级治疗相关AEs的发生率分别为29%和35%;因3-4级治疗相关AEs停止治疗的患者比例分别为10%和8%;无治疗相关死亡。
ORR:B组为13%;C组为25%;PD-L1表达≥1%患者-B组为8%;C组为24%;
24周PFS率及中位PFS:B组为55%及10.6个月;C组未达到及4.9个月;
PD-L1表达≥1%患者-B组24周PFS率及中位PFS分别为45%和11.5周;C组分别为40%和21.1周;
中位OS:均未达到。
2.D组 (中位随访时间:12.8周)和E组(中位随访时间:11.8周)的研究结果
(1) 患者的入组情况及基线特征
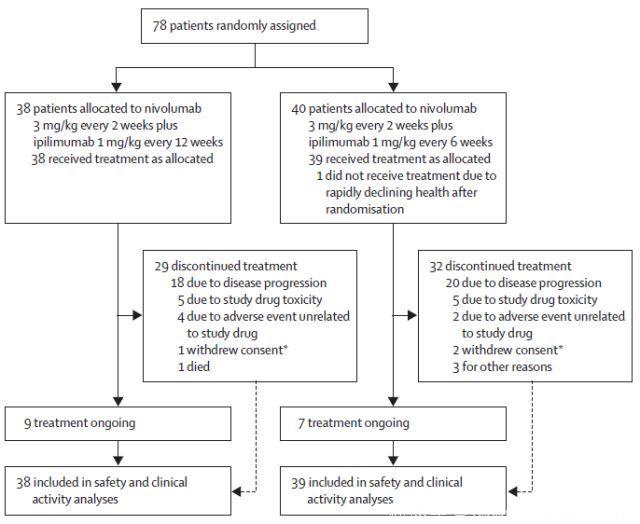
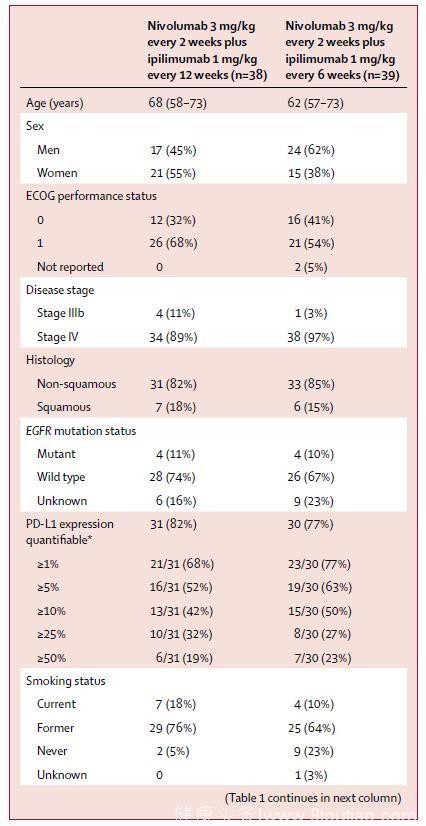
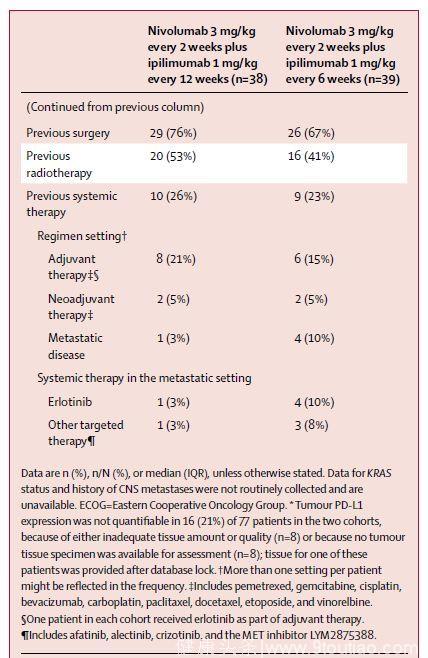
(2)治疗相关AEs的发生率
D组3-4级治疗相关AEs的发生率为37%,E组为33%,且无治疗相关死亡。最常见的3-4级治疗相关AEs为脂肪酶升高、肺炎、肾上腺功能不全和结肠炎。
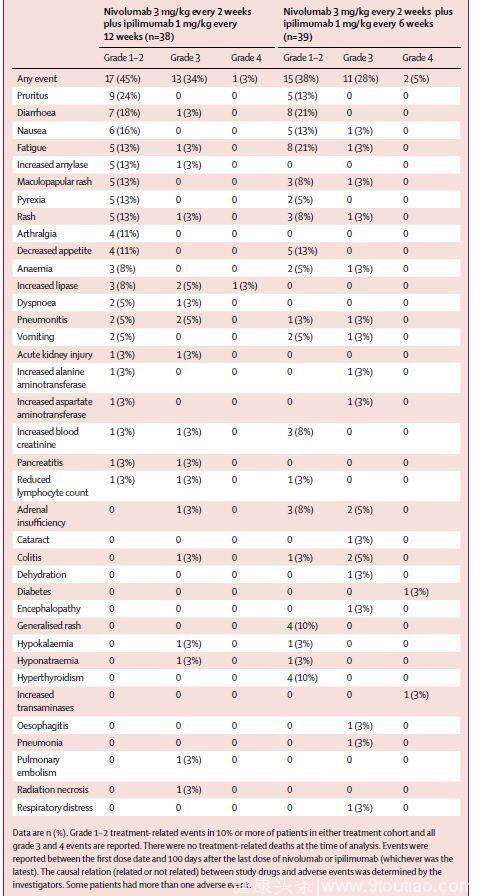
(3) 治疗相关选择性AEs发生率和导致治疗停止的治疗相关AEs
最常见的3-4级治疗相关选择性AEs为皮肤、胃肠道及内分泌反应。两组患者均最常因肺炎停止治疗。
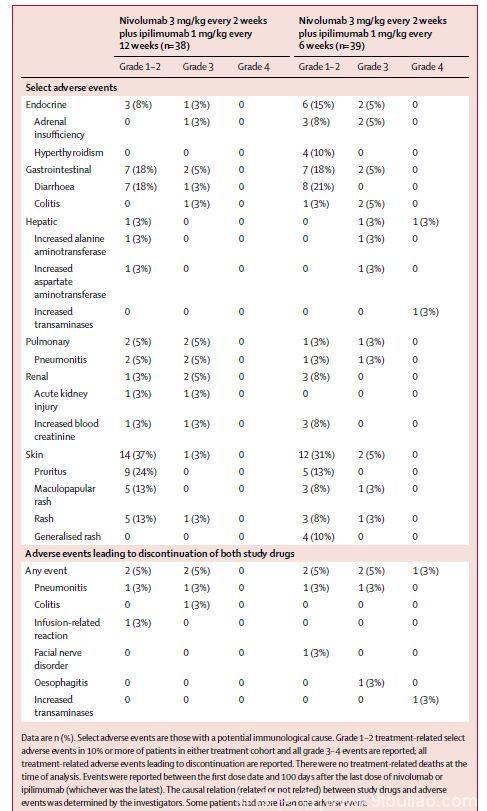
(3) 治疗相关选择性AEs发生率和导致治疗停止的治疗相关AEs
最常见的3-4级治疗相关选择性AEs为皮肤、胃肠道及内分泌反应。两组患者均最常因肺炎停止治疗。
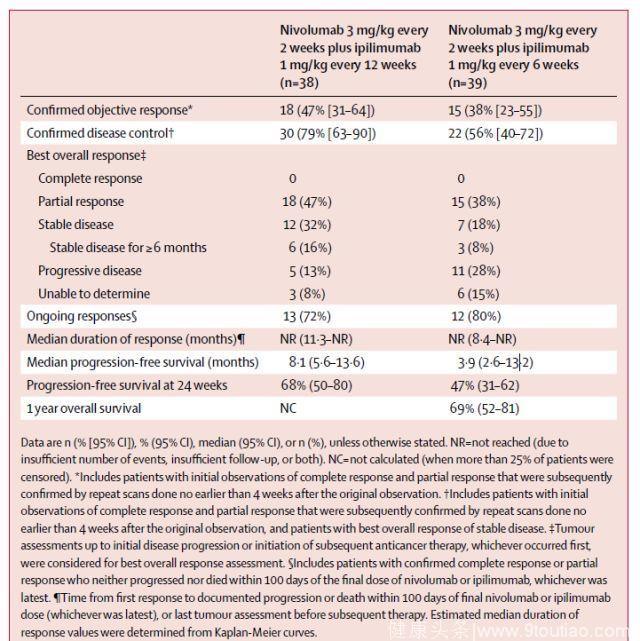
(5) 高PD-L1表达的患者更能从联合治疗中获益
两组PD-L1表达≥1%的患者的ORR均为57%,24周PFS率分别为80%和65%,中位PFS分别为8.1个月和10.6个月。与nivolumab单药相比,联合治疗获益更高,且高PD-L1表达的患者更能从联合治疗中获益。
结论及展望
nivolumab联合ipilimumab一线治疗晚期NSCLC具有良好的临床获益,包括PD-L1+肿瘤患者的高反应率以及深度和持续反应的可能性,且安全性较好、耐受性佳。checkmate012研究是第一个证实免疫治疗组合改善NSCLC一线治疗获益的证据。目前还有几项Ⅲ期临床研究正在进行中,以评估双重检查点抑制剂或免疫治疗联合化疗的疗效及安全性,这些研究旨在改善晚期NSCLC患者的一线治疗策略。
参考文献:
1. Hellmann MD, Rizvi NA, Goldman JW,et al. Nivolumab plus ipilimumab as first-line treatment for advanced non-small-cell lung cancer (CheckMate 012): results of an open-label, phase 1, multicohort study. Lancet Oncol. 2017 Jan;18(1):31-41.
2. Rizvi NA, Gettinger SN, Goldman JW, et al. Safety and efficacy of first-line nivolumab (NIVO; anti-programmed death-1 [PD-1]) and ipilimumab in non-small cell lung cancer (NSCLC). J Thorac Oncol.2015; 10: S176.
3. Antonia SJ, Gettinger S, Goldman JW, et al. Safety and efficacy of first-line nivolumab (anti-PD-1; BMS-936558, ONO-4538) and ipilimumab in non-small cell lung cancer (NSCLC). Int J Radiat Oncol Biol Phys.2014; 90 (suppl): S32–3.
4. Naiyer Rizvi, MD. Combination of Nivolumab and Ipilimumab Is Safe and Well Tolerated in Patients with Chemotherapy-Naïve, Advanced NSCLC.WCLC2015.
Checkmate 017:Nivolumab为鳞状NSCLC患者带来显著的生存获益