老话题,新发现!ACPA与类风湿关节炎的精准治疗
类风湿性关节炎(Rheumatoid Arthritis,RA)中抗瓜氨酸化蛋白抗体(Anti-citrullinated peptide antibodies,ACPA)一直是研究的热点,它与RA的诊断、疾病的预后、影像学影响等均有很大的关联。ACPA部分临床特性为广大风湿医生非常熟悉,近年来新报道认为RA患者的ACPA滴度可能成为未来类风湿关节炎临床靶向药物选择的biomarker以及精准治疗和个性化治疗的突破。
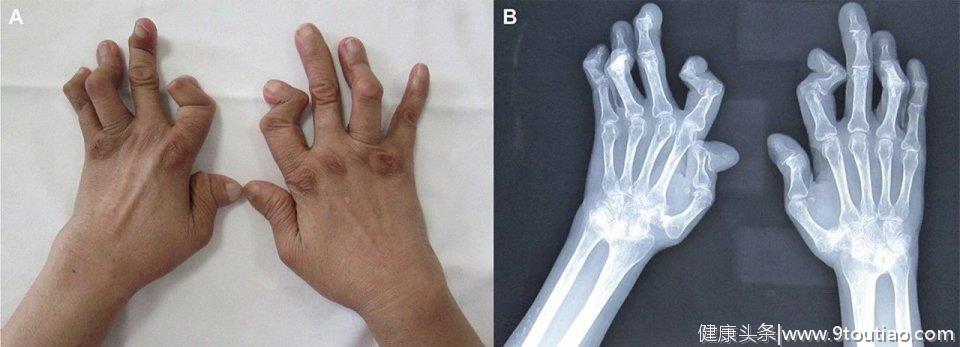
1、ACPA与RA的诊断
RA的诊断主要在临床进行,但患者在就诊前通常经过了一段非特异性的症状困扰。有观点认为,早期积极管理RA存在机会之窗,疾病管理的延迟可能导致关节损伤和残疾概率增加。
ACPA在RA的诊断中有着非常重要的意义,在患者呈现临床症状的前几年,便可在患者血清中检测到ACPA,且ACPA血清学阳性可预测未分化的关节炎患者RA的发展。有研究发现,ACPA阳性的未分化关节炎患者有90%的几率会在3年内进展为RA。
除此之外,ACPA阳性被发现与炎症细胞因子失调有关。在确诊的RA患者中有76%的为ACPA阳性,且特异性为96%。由于ACPA具有较高的特异性,现在已经成为辅助RA诊断的检测工具。
2010年,美国风湿病学会/欧洲风湿病联盟合作倡议的RA的分类标准中,ACPA的测定即被列入其中。然而在临床实践中,为了最大限度地提高RA诊断的灵敏度,大多数风湿病学家建议将ACPA与RF一起测量。
2、ACPA与炎症
RA患者的关节中,持续不断产生的细胞因子使关节损伤逐渐严重。虽然细胞因子持续产生的机制尚不清楚,但是可以清楚的是,巨噬细胞在这一过程中起到至关重要的作用,大部分细胞因子均来源于它,例如肿瘤坏死因子(TNF)、白细胞介素-6等。
众所周知,自身抗原可以通过MHC分子呈递给T细胞后,一方面通过激活巨噬细胞释放细胞因子,一方面可以通过B细胞产生自身抗体。自身抗体与抗原结合后形成免疫复合物,免疫复合物被证明可以通过与巨噬细胞上的Fcγ受体结合,进而刺激巨噬细胞分泌更多的细胞因子。
除此之外,免疫复合物也可以刺激中性粒细胞和肥大细胞,诱导中性粒细胞胞外陷阱和释放细胞因子(例如白细胞介素-8),引起先天免疫。这可能就是为什么自身抗体阳性的RA患者表现出更严重的疾病进展。
3、ACPA与骨破坏
RA患者到后期通常伴有软骨和骨的破坏,若不及时治疗最终会导致严重的关节畸形甚至残疾。成年人通过成骨细胞和破骨细胞的不断产生和凋亡来维持骨骼系统的平衡,当破骨细胞的生成大于凋亡后,平衡会被打破,进而会发生骨侵蚀,其中破骨细胞的产生可以通过活化的T细胞促进滑膜巨噬细胞的分化而产生。
也有研究发现,ACPA可直接诱导破骨细胞的生成,从而导致疼痛和骨质丢失。从RA患者血清中分离出瓜氨酸化肽纯化的IgG ACPA,显示能够引起破骨细胞的体外分化和活化。但需要注意的是,正常的生理进程中,破骨细胞活化过程中在其表面均可检测到瓜氨酸化蛋白的存在,瓜氨酸化是破骨细胞分化和代谢中不可缺少的过程。因此,当非正常生理条件下ACPA的含量增加时,ACPA与破骨细胞前体的特异性结合,可能是造成平衡被打破的原因。
在ESPOIR队列研究中,高滴度的ACPA可以预测快速的放射学进展,并且主要在ACPA / RF血清阳性患者中,此时RA患者全身骨矿物质密度降低。同时,在ACPA孵育和破骨细胞的正常分化过程中,均检测到IL-8的生成,因此IL-8可能也参与其中,并影响破骨细胞的分化。
4、ACPA与疾病预后
在类风湿关节炎患者的日常管理中,风湿学家们会综合考虑鉴定与临床结果相关的预后标志物,以便更好地选择适当的治疗方法。
ACPA与疾病严重程度,疾病的放射学进展,残疾和RA死亡率增加有关。在一项纳入273名RA患者(病程<1年)的初始队列研究中,抗CCP +患者在随访6年后发生更严重的关节破坏。有研究发现,ACPA的存在与缺血性心脏病的发展相关,但是似乎与自身抗体的滴度无关。另外,即使患者没有RA症状,在动脉粥样硬化斑块中检测也可到瓜氨酸化蛋白和PADs存在。
/新发现:ACPA与类风湿关节炎的临床分型与精准治疗/
1、类风湿关节炎临床分型:ACPA阳性和ACPA阴性RA可能是两种不同的疾病

HLA-DRB1等位基因,也被成为“共享表位”,被认为与RA的早发、快速进展和严重程度等有密切的关系,并且可能与疾病的不良预后相关,是第一个被发现并且到目前为止仍是与RA关联性最大的基因。
HLA-DRB1等位基因通过编码MHC分子,赋予机体特殊的易感性,通过T细胞谱系选择,抗原呈递或肽亲和力的改变,在促进自身反应性适应性免疫应答中起作用。然而,共享表位可能并不直接影响疾病的预后,而是通过影响ACPA的产生带来的。事实上,有很多研究认为,共享表位是ACPA含量增加的主要风险因素。
有些研究显示,当环境中某些因素改变,促进精氨酸在肽酰基精氨酸脱亚氨酶(peptidylarginine deiminases,PADs)的催化作用下变成瓜氨酸,瓜氨酸化的蛋白质可以通过抗原呈递细胞(APC)在某些易感的主要组织相容性复合体(MHC)遗传背景下呈递给T细胞,产生ACPA,同时引起RA患者对瓜氨酸化自身抗原的自身免疫反应。但是瓜氨酸为何产生以及机体的耐受性是如何降低的一直是困扰诸多学者的问题,大量研究显示这与吸烟、牙周炎和微生物的分子模拟等有关。
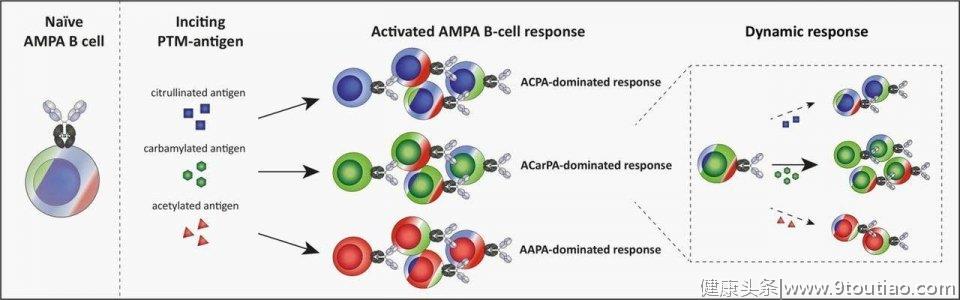
此外,研究者们试图通过全基因组关联分析来研究与RA易感性相关的基因,猜测是否可以进行基因分型。RA患者中,ACPA阳性和阴性与共享表位的关联程度不同,且二者的基因组间与RA易感性相关的非HLA基因仅部分相同,因此有研究者认为ACPA阳性和ACPA阴性RA可能是两种遗传上不同的疾病。且也有研究证实了共有表位与ACPA阴性RA的关联,这种关联发挥的作用及其对ACPA阴性RA的特定血清型或亚型是否有影响仍需要进一步确定。这些研究为RA精准治疗开辟了理论基础。
2、类风湿关节炎精准治疗与个性化治疗
如上所说,诸多学者均在研究发病机制和HLA-DRB1基因之间的关系,同时也包括疾病的精确,个性化诊断与治疗方面。近几年众多文献认为部分类风湿治疗靶向药物的治疗反应率等与抗体滴度相关,如阿巴西普(CTLA4)和利妥昔单抗(CD20);而TNF抑制剂,IL-6,JAK类药物则未能观察到相关性。以上药品的特性为类风湿关节炎患者靶向药物的临床选择提供依据,患者个性化治疗成为可能。同时在一些最新的前瞻性头对头研究中,使用HLA-DRB1 共享位基因作为患者治疗的biomarker,阿巴西普组治疗ACR70反应率显著高于TNFi组。这些前瞻性的研究都为未来类风湿关节炎的精准治疗积累了临床证据。
/总结/
自身抗体,除了ACPA之外,还包括类风湿因子等。虽然ACPA是风湿学家们研究的热点,并证明了其在类风湿关节炎中的可能起到的作用。但是并不是所有RA患者血清中均表达ACPA,且ACPA阳性和阴性的患者在TNF,IL6和JAK治疗下反应率并没有显著性差别;而CTLA4与CD20则不同。抗体与遗传学研究提示我们类风湿关节炎的治疗有可能根据患者抗体滴度和基因分型进行靶向药物选择,例如ACPA滴度与HLA等位基因,以达到个体化或精准治疗的目的。
参考文献:
1、IainB. McInnes, Georg Schett. The pathogenesis of rheumatoid arthritis. TheNew England journal of medicine. 2011,365(23):2205-19.
2、SebastienViatte, Darren Plant, Soumya Raychaudhuri. Genetics and epigenetics ofrheumatoid arthritis. Nat Rev Rheumatol. 2013, 9(3): 141–153.
3、ConigliaroP , Chimenti M S , Triggianese P , et al. Autoantibodies in inflammatory arthritis.Autoimmunity Reviews, 2016:S1568997216300519.
4、XiwenD , Zhaohui Z , Yue Z , et al. ACPA mediates the interplay between innate andadaptive immunity in rheumatoid arthritis. Autoimmunity Reviews,2018:S1568997218301551-.
5、BozecA , Luo Y , Engdahl C , et al. Abatacept blocks anti-citrullinated proteinantibody and rheumatoid factor?mediated cytokine production in humanmacrophages in IDO-dependent manner[J]. Arthritis Research & Therapy, 2018,20(1):24.
6、AletahaD , Neogi T , Silman A J , et al. 2010 Rheumatoid arthritis classificationcriteria: An American College of Rheumatology/European League againstRheumatism collaborative initiative. Arthritis & Rheumatism, 2010,62(9):2569-2581.
7、YoheiKirino, Elaine F. Remmers.Genetic architectures of seropositive andseronegative rheumatic diseases.Nature ReviewsRheumatology,2015, 11(7):401-14.
8、WilliamR, Jane B, Lou B, et al. LB0008 The Effect of HLA-DRB1 Risk Alleles on the ClinicalEfficacy of Abatacept and Adalimumab in Seropositive Biologic-naive Patientswith Early, Moderate-To-Severe RA: Data From A Head-to-Head Single-Blinded Trial.Annals of the Rheumatic Diseases. 78. 263-264.10.1136/annrheumdis-2019-eular.8668.
9、RenéToes, David S Pisetsky.Pathogenic effectorfunctions of ACPA: Where do we stand?Ann Rheum Dis, 2019, 78(6):716-721.
10、AliverniniS , Galeazzi M , Peleg H , et al. Is ACPA positivity the main driver forrheumatoid arthritis treatment? Pros and cons. Autoimmunity Reviews,2017:S1568997217302264.
11. Tanaka M,Krutzik S R, Sieling P A, et al. Activation of FcγR1 on Monocytes TriggersDifferentiation into Immature Dendritic Cells That Induce Autoreactive T CellResponses. The Journal of Immunology, 2009, 183(4):2349-2355.
12.Martin-Mola E, Balsa A, García-Vicuna, Rosario, et al. Anti-citrullinatedpeptide antibodies and their value for predicting responses to biologic agents:a review. Rheumatology International, 2016, 36(8):1043-1063.
编辑 | 拎袋鱼
终审 | L10
本文转载自其他网站,不代表健康界观点和立场。如有内容和图片的著作权异议,请及时联系我们(邮箱:[email protected])