NEJM:严重哮喘患者的福音!III期临床试验表明,抗TSLP单抗能将严重哮喘患者的发作率降低56%丨临床大发现
今天奇点糕要给大家带来一个好消息。
近日,英国皇家布朗普顿医院的Andrew Menzies‑Gow领衔的研究团队在《新英格兰医学杂志》(NEJM)发表了一项重大的临床试验研究成果[1]。
这项名为NAVIGATOR的多中心、随机、双盲、安慰剂对照、平行组的III期临床试验研究表明,
抗TSLP抗体T
ezepelumab可以有效缓解各种原因引起的严重哮喘,
将哮喘急性发作降低了56%
。
这意味着,如果Tezepelumab成功上市,将会造福未控制的严重哮喘患者。

论文首页截图
哮喘又名支气管哮喘,是由多种细胞及细胞因子参与的慢性炎症性气道疾病,这种炎症常伴随引起气道反应性增高,导致反复发作的喘息、气促、胸闷和(或)咳嗽等症状。
哮喘是常见的肺部疾病,
影响全球3.39亿人
[2],但多数哮喘可以通过β受体激动剂和糖皮质激素得到控制。也有相当一部分患者必须长期使用标准治疗药物才能控制,称为难治性哮喘。另外,还有
约10%的患者即使长期用标准治疗药物病情仍然未能控制,属于严重哮喘
。
未控制的严重哮喘患者虽然不多,但是占哮喘医药开支的60%[3],和慢性阻塞性肺疾病(COPD)等其它严重呼吸道疾病加起来是美国第三大死亡因素,仅低于心血管和肿瘤。
不同类型的哮喘由许多不同的诱因引起,现在已经设计出多种单克隆抗体药物来治疗不同诱因引起的哮喘,但仍有许多重度哮喘患者的症状未得到良好的控制。

目前的研究显示,多种炎症途径参与了哮喘的发病过程。其中,2型炎症驱动的哮喘是最常见的,其典型特征是
2型炎性生物标志物水平升高,包括2型细胞因子(白介素-4、白介素-5和白介素-13)、血嗜酸性粒细胞、血清IgE和呼出气一氧化氮(FeNO)
[4]。
针对2型细胞因子或IgE及其受体的单克隆抗体可以改善许多哮喘患者的疾病控制情况,并被纳入治疗指南。然而,目前的生物制剂对许多严重哮喘患者并不适用,特别是没有过敏和非嗜酸性粒细胞表型的患者[5, 6]。
因此,迫切需要研发治疗严重、未控制的哮喘的药物。
胸腺基质淋巴细胞生成素(TSLP)是与哮喘发病有关的上皮细胞源性细胞因子,在气道炎症的发生和持续中起着关键作用[7]。
TSLP可以驱动下游2型细胞因子的释放,从而导致炎症和哮喘症状。因此,TSLP被认为是哮喘的有效治疗靶点
[4]。
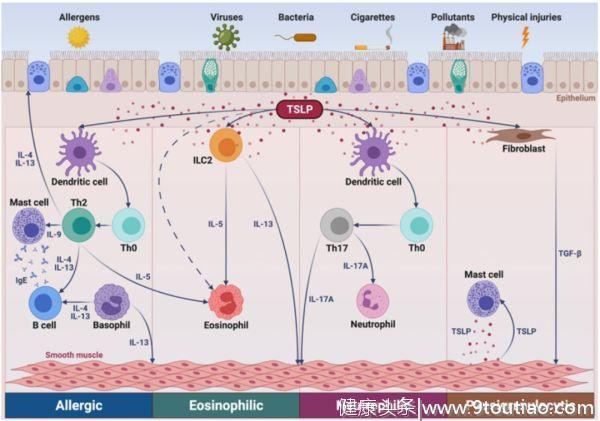
TSLP在几种哮喘表型中的作用机制[4]
Tezepelumab是一种可以阻断TSLP的人源性单克隆抗体,可与TSLP特异性结合并阻断其与受体的相互作用,进而防止哮喘恶化并控制哮喘[8]。
关注哮喘的朋友们应该还记得,早在2017年9月,NEJM上就发表了一项IIb期临床试验PATHWAY的积极结果。这项随机、双盲、平行组、安慰剂对照的临床试验研究显示,
在未控制的重症哮喘患者中,Tezepelumab组的哮喘年发作率比安慰剂组降低了71%
[9]。
然而Tezepelumab的疗效和安全性需要进一步评估。于是,研究人员又开展了Tezepelumab的III期临床试验研究。
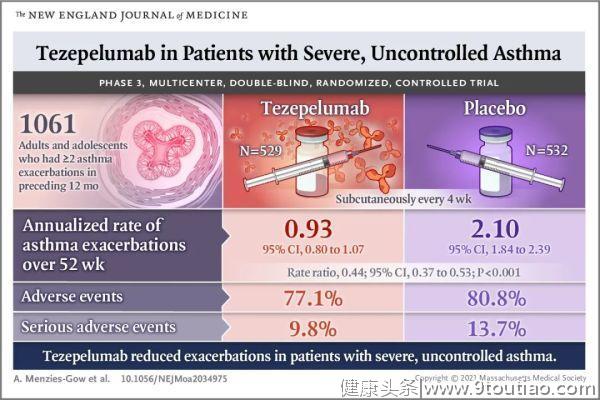
这项研究从2017年11月23日至2020年9月8日,在18个国家297个研究中心,共招募了1061例12~80岁的哮喘患者。
研究人员将这些患者随机分配到Tezepelumab组(210 mg,皮下注射,1次/4周,529例)或安慰剂组(532例),持续治疗52周(约一年)。第52周时,患者进入12周的治疗后随访期。
研究的主要终点是52周内哮喘急性发作的频率(年发作率)。次要终点包括:第一秒用力呼气容积(FEV1)和哮喘控制问卷-6(ACQ-6),哮喘生活质量问卷(AQLQ)和哮喘症状日记(ASD)。
结果显示,经过一年的治疗,
Tezepelumab组(528人完成治疗)和安慰剂组(531人完成治疗)的哮喘急性发作的年发作率分别为0.93和2.10(P
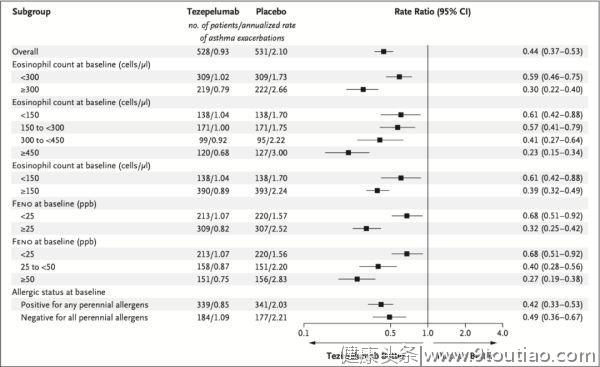
Tezepelumab组与安慰剂组在52周内的哮喘年发作率(主要终点)比较:根据基线生物标志物和过敏状态分亚组
更重要的是,
无论哮喘患者的血嗜酸性粒细胞计数、过敏状态或FeNO水平如何,与安慰剂相比,接受Tezepelumab治疗的患者的年发作率均显著降低
:
在血嗜酸性粒细胞计数<300个/μL的患者中,Tezepelumab组的哮喘发作率比安慰剂组降低了41%(P
在基线血嗜酸性粒细胞计数升高(≥300个/μL)和FeNO水平升高(≥25ppb)的患者中,Tezepelumab组的哮喘发作率比安慰剂组降低了77%;
在受季节性过敏影响的患者中,哮喘发作减少了58%,而对过敏原不敏感的哮喘患者的发作率也减少了51%。
在次要终点方面,与安慰剂组相比,Tezepelumab组的FEV1增加了0.13升(P

Tezepelumab组与安慰剂组在52周内的FEV1比较
另外,研究者们还发现
Tezepelumab还能减少血嗜酸性粒细胞计数并降低FeNO和IgE水平,这提示Tezepelumab可以抑制多个炎症通路
。
最后,在安全性方面,Tezepelumab组与安慰剂组的不良事件发生率分别为77.1%和80.8%,严重不良事件发生率分别为9.8%和13.7%,因不良事件停用试验的患者分别为2.1%和3.6%。最常见的不良事件包括鼻咽炎、上呼吸道感染、头痛和哮喘(安慰剂组的发生率高于Tezepelumab组)。
两组的不良事件发生率和类型无统计学差异,提示Tezepelumab没有明显的副作用。
值得注意的是,与IIb期PATHWAY试验的结果相对比,III期NAVIGATOR试验的哮喘年发作率降幅较低,原因可能是PATHWAY试验中的患者数量较少。这项试验的局限性包括试验时间(52周)、严格的纳入标准(排除了某些亚组,如吸烟患者和有某些合并症的患者)及青少年患者数量少。
总的来说,这项III期临床研究表明,在严重、未控制的哮喘患者中,Tezepelumab能够显著减少哮喘发作,使患者具有更好的肺功能、哮喘控制和健康相关的生活质量,包括在嗜酸性粒细胞计数低的患者中。
2018年,美国食品和药物管理局(FDA)
授予Tezepelumab突破性治疗药物资格(BTD)
。近期,相关公司已向美国 FDA
提交了生物制剂许可申请(BLA)
。
Tezepelumab是第一个在广泛严重哮喘患者中能够持续显著减少病情加重的生物制剂,其治疗人群将远大于目前已上市的生物疗法。Tezepelumab一旦上市,将对重度、没有嗜酸性粒细胞表型的哮喘患者的靶向治疗格局带来重大影响。

参考文献:
[1] Menzies-Gow, A., J. Corren, A. Bourdin, et al., Tezepelumab in Adults and Adolescents with Severe, Uncontrolled Asthma. N Engl J Med. 2021;384(19):1800-1809. doi:10.1056/NEJMoa2034975
[2] El-Husseini, Z.W., R. Gosens, F. Dekker, et al., The genetics of asthma and the promise of genomics-guided drug target discovery. Lancet Respir Med. 2020;8(10):1045-1056. doi:10.1016/s2213-2600(20)30363-5
[3] Sadatsafavi, M., L. Lynd, C. Marra, et al., Direct health care costs associated with asthma in British Columbia. Can Respir J. 2010;17(2):74-80. doi:10.1155/2010/361071
[4] Pelaia, C., G. Pelaia, C. Crimi, et al., Tezepelumab: A Potential New Biological Therapy for Severe Refractory Asthma. International journal of molecular sciences. 2021;22(9):4369. doi:10.3390/ijms22094369
[5] Carr, T.F., A.A. Zeki, and M. Kraft, Eosinophilic and Noneosinophilic Asthma. Am J Respir Crit Care Med. 2018;197(1):22-37. doi:10.1164/rccm.201611-2232PP
[6] Hinks, T.S.C., S.J. Levine, and G.G. Brusselle, Treatment options in type-2 low asthma. Eur Respir J. 2021;57(1). doi:10.1183/13993003.00528-2020
[7] Shikotra, A., D.F. Choy, C.M. Ohri, et al., Increased expression of immunoreactive thymic stromal lymphopoietin in patients with severe asthma. J Allergy Clin Immunol. 2012;129(1):104-111.e101-109. doi:10.1016/j.jaci.2011.08.031
[8] Gauvreau, G.M., P.M. O'Byrne, L.P. Boulet, et al., Effects of an anti-TSLP antibody on allergen-induced asthmatic responses. N Engl J Med. 2014;370(22):2102-2110. doi:10.1056/NEJMoa1402895
[9] Corren, J., J.R. Parnes, L. Wang, et al., Tezepelumab in Adults with Uncontrolled Asthma. N Engl J Med. 2017;377(10):936-946. doi:10.1056/NEJMoa1704064