HIV感染者的非酒精性脂肪肝、肝炎的发病机制
肝病是HIV感染者发病和死亡的主要原因,而在这个能更安全、更有效地治疗丙型肝炎的时代,非酒精性脂肪性肝病(NAFLD)很快就成为这一类人群中最常见的肝病类型。NAFLD在HIV感染者中很常见,并且这些病人比未感染HIV的个体更可能进展为非酒精性脂肪性肝炎(NASH)和NAFLD相关的纤维化或肝硬化。目前有一些发病机制假说以解释HIV感染者NAFLD的严重程度,这些机制包括肠道微生物的影响,以及代谢、遗传和免疫因素。
未感染HIV病人脂肪肝的发生机制是过量脂肪酸在肝脏中积累,而对于HIV感染者,肝细胞损伤、炎症和纤维化进展,均是脂肪肝复杂发病过程中的一部分,不是单一的机制所导致的。
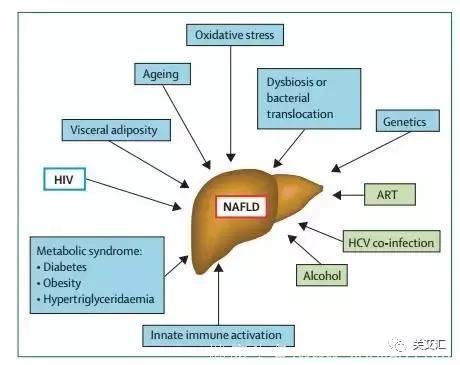
HIV感染者由于其老龄化、传统的NAFLD风险因素过多、肠道-肝脏轴基线紊乱以及HIV感染和ART相关机制的额外影响,容易处于特别高的风险中。
肝脏脂肪变性的继发原因:ART、HCV和酒精
NAFLD的传统定义不包括肝脂肪变性的继发性原因,而其中一些(例如药物诱发的、HCV相关的和酒精诱发的脂肪变性)在HIV感染者中常见。一些ART药物,特别是核苷逆转录酶抑制剂(NRTIs)和早期蛋白酶抑制剂与脂肪变性和肝损伤相关,并且还促进高甘油三酯血症、胰岛素抵抗和内脏肥胖的发生。此外,已有报道双脱氧核苷类似物去羟肌苷和司他夫定与线粒体损伤相关,导致微囊脂肪变性和严重的肝损伤。由于这些毒性,目前这些药物很少使用。来自现代ART时代的文献未发现ART药物或持续使用时间与NAFLD之间的关联,而更多关注抗病毒治疗方案对代谢的影响。此外,HCV几乎在所有情况下都可治疗,其他假设的继发原因,如营养不良,在HIV感染者中很少见。因此,这些继发因素未来在NAFLD发病机制中可能不太重要。
酒精消耗量和酗酒率在HIV感染者中比普通人更为常见,并且与HIV感染者的ART依从性降低和病毒抑制减少相关。此外,酒精使用模式可能是预示单一HIV感染者和HIV-HCV共感染者晚期肝病的血清学证据。然而,NAFLD和酒精性肝炎病人的肝损伤在组织学上无法区分,并且NAFLD的定义是要求在没有摄取酒精的前提下。虽然NAFLD在诊断时通常推荐戒酒,但是构成实质或饮酒所致的肝毒性水平仍然是不确定的。为了试验目的,通常定义2年期的大量酒精摄入量,男性每周饮酒21次以上,女性每周饮酒超过14次,不同文献中的定义差别很大。横断面研究表明,大量饮酒、超重或糖尿病对一般人群肝脏结局可能产生协同作用。然而,关于轻度或中度饮酒是否可能对肝脏和心血管具有相反的保护性作用也存在争议。因此,关于这种关系的许多重要问题仍然没有得到解答。没有研究系统地分析不同饮酒水平对HIV感染者NAFLD自然病史的影响,但因为酒精摄入是一种潜在的可改变的风险因素,建议病人避免过度饮酒是治疗NAFLD的重要组成部分。
代谢综合征、高脂血症和糖尿病
肥胖和代谢综合征影响HIV感染者的比例可能越来越高。根据多中心D:A:D研究组的数据发现,代谢综合征患病率从2000~2001年的19.4%显著上升至2006~2007年的41.6%。然而,与普通人群一样,由于地理、性别、年龄、种族和所使用代谢综合征的定义等因素的影响,代谢综合征的患病率差异很大(14%~42%)。总体来说,HIV感染者代谢综合征的患病率通常与非HIV感染者的人群相似,特别是当BMI调整时。
当HIV感染者出现代谢综合征时,最常见的特征是血脂异常,几乎没有HIV和代谢综合征病人符合腰围标准(华人男性>90cm,女性>80cm)。在32个中心里接受ART治疗的病人,特征明显的代谢综合征总体发病率为18%,尽管49%具有至少两个特征,但由于其不符合腰围或腰部比标准而未归类为代谢综合征。
HIV和代谢综合征病人的血脂异常可能是HIV感染和ART治疗的影响。据报道,在ART之前,这些病人的血浆脂质分布有多种异常,包括甘油三酯的浓度增加和总胆固醇、低密度脂蛋白和高密度脂蛋白浓度降低。在治疗组病人中,血浆甘油三酯浓度升高、HDL浓度升高(尽管不是健康浓度)和LDL浓度逐渐升高是最常见。然而,要考虑的一个重要因素是ART药物其联合使用与单独使用可以对脂质分布产生不同的影响,难以确定哪种药物有哪些作用。最近美国对两大HIV感染者群体(即妇女机构间HIV研究和多中心HIV队列研究(MACS))就心血管危险因素进行了调查,与未感染HIV的个体相比,所有使用降脂药但还未患冠心病的HIV感染者,男性(n=931)和女性(n=1455)具有高LDL、低HDL和高甘油三酯浓度等特点。虽然HIV感染者比未感染者超重或肥胖的几率要低,但血脂异常在HIV感染者中更常见。血脂异常的治疗是否影响NAFLD的发病风险或疾病进展仍有待研究。
治疗中的HIV感染者其糖尿病发病率也因人口统计学和所用糖尿病的定义而有很大差异。在以往ART时代,接受治疗的HIV感染者糖尿病的发病率被认为是相当低的(治疗初期病人约为2%)。在现今的ART时代,尽管报告的发病率在队列之间仍有差异,但ART初始治疗HIV感染者糖尿病的发病率可能高于一般人群。。例如,D:A:D队列中33389例HIV感染者中糖尿病的新发率较MACS队列中的更低(每1000人年随访5.72次,接受与不接受ART治疗的个体每1000人年随访中分别有47例和14例)。HIV感染者糖尿病新发病率是否高于未感染HIV的对照群体尚有争议,但MACS队列研究发现,接受ART治疗的HIV感染者其相对的糖尿病风险(4年以上10%)与未感染HIV的对照组(3%)相比,增加近四倍。年龄增长、体重、种族、累积暴露于ART药物(特别是NRTI)和血脂异常与这些群体的糖尿病风险都相关。此外,脂肪代谢障碍或内脏脂肪组织过多(VAT)可能是发生糖尿病的重要危险因素。在一项病例对照研究中,分别在7%和35%的HIV相关性脂肪营养不良病人中发现糖尿病和葡萄糖耐量异常,但年龄和BMI匹配的未感染HIV的对照组分别为0.5%和5%。
因此,虽然代谢综合征及其组成部分一直被报告为HIV感染者NAFLD的危险因素,但其患病率和发病率差异很大,在这个人群中它们可能仅占风险因素的一部分。
内脏肥胖和脂肪萎缩
除了HIV感染者代谢综合征的高发病率以外,在20世纪90年代中期引入ART后不久,已开始对HIV感染者脂肪分布的变化(包括增加VAT和外周脂肪萎缩症)进行了调查。最初脂肪分布的这种变化被认为是一种归因于药物副作用的综合征(称为脂肪代谢障碍),但现在的证据表明脂肪分布的特异性变化是一种复杂的病理生理过程。外周脂肪萎缩既是慢性HIV感染的直接后果,也是特定ART药物(包括胸苷类似物)的结果。
相反,内脏脂肪过多可能主要是治疗HIV/恢复健康和自然衰老过程的结果。然而,在接受治疗的病人群体中,VAT积累变化很大,意味着简单地实现病毒抑制和改善健康可能不是唯一的潜在机制。NRTIs和蛋白酶抑制剂对代谢综合征和内脏肥胖的影响已被广泛研究,证据表明这些药物可以加速血脂异常和胰岛素抵抗的进展。然而,当在随机试验中将蛋白酶抑制剂和非NRTI的组合治疗与单独治疗进行比较时,治疗组中腹部和肢体脂肪的变化相似。中枢脂肪沉积的其他危险因素包括女性、更高的基线体脂肪和血浆甘油三酯浓度,突出了代谢体质的影响。
尽管脂肪代谢障碍的发生率被认为随着NRTIs的下降而减少,但因为有效的治疗策略很少,其流行率仍然相对较高。由于VAT或与HIV相关的脂肪紊乱疾病在临床上缺乏简单有效的标准,难以从普通人群异质脂肪分布模式中区分这种综合征,也大大限制了这一研究。这些脂肪分布变化被认为可能是代谢综合征的一部分,因为内脏肥胖与血脂异常及糖尿病的进展密切相关。然而,HIV感染和长期ART治疗可能进一步加强这些变化。HIV相关综合征与代谢综合征不同的具体方面,以及HIV相关肝脂肪积累和肝损伤与HIV未感染者相比如何不同尚不清楚。
肠-肝轴
已经在动物模型和人体研究中证实,肠-肝轴与NAFLD和NASH的发病机制密切相关。该轴包括肠道微生物、肠屏障、粘膜免疫系统、肠系膜静脉系统(其直接汇入门静脉)、肝脏和肠内循环分子(包括胆汁酸)。该模型表明,在肥胖和慢性肝病期间,肠道微生物和宿主对微生物的反应以及肠道渗透性增加(导致细菌产物和内毒素转移到门静脉系统中)都可导致肝脏脂肪变性、炎症反应和纤维化。此外,该模型表明由微生物引起的营养物质代谢(如乙醇和胆碱)的改变,促进了NAFLD的病发。
由于HIV引起的肠道微生物多样性的减少,使得HIV感染者可能处于肠道相关肝损伤的高风险中,ART不能完全重建这种多样性。此外,强有力的证据支持了对于HIV感染者甚至ART治疗者,粘膜免疫功能改变和肠道通透性的增加在慢性微生物易位和免疫激活中所起的作用。循环内毒素和可溶性CD14(慢性单核细胞活化的标志物)的浓度与HIV-HCV共感染者肝脏疾病的严重程度以及单一HIV感染者的内脏肥胖有关。虽然肠-肝轴线上HIV相关变化可能会促进这些病人NAFLD的进展,但尚无公开的研究明确将肠道微生物和菌群易位与HIV感染者的这一过程相关联,这可能是未来工作的重要领域。
遗传学
在普通人群的全基因组相关研究中,几种遗传多态性与NAFLD风险相关。描述最好的是PNPLA3基因的多态性,其与NAFLD风险和疾病严重性增加相关。在小队列HIV感染者中也观察到PNPLA3多态性对NAFLD风险的影响。虽然这种关联程度和PNPLA3在肝脏中确切的生理作用尚不清楚,但遗传易感性可能在HIV感染者中起重要作用。
HIV的直接影响
HIV感染本身也与代谢综合征的进展相关,因此也有肝脂肪变性的风险。未经治疗的HIV感染者,其病毒血症的程度与高甘油三酯血症、血脂异常及胰岛素抵抗有关,HIV相关的线粒体损伤也涉及糖尿病发病机制中的全身免疫激活。此外,病毒可能通过脂肪生成和胰岛素信号传导的关键分子(固醇调节元件结合蛋白1和过氧化物酶体增殖活化受体γ)之间的相互作用来促进肝脂肪变性。证据表明,HIV影响肝星状细胞的活化,从而导致肝胶原沉积和纤维形成。最后,虽然单一HIV感染者的研究不尽如人意,但初步证据表明,HIV治疗抑制病毒可能会降低脂肪变性发生和进展的风险。在222例HIV-HCV共感染者的研究中(其中涉及对配对肝活检样本评估,来发现脂肪变性进展的危险因素),通过比较两次肝穿刺标本发现,累积暴露于抗病毒药物和高CD4 T淋巴细胞计数可以减少肝脏脂肪变性的进展。
排除其他形式的慢性肝病和继发性脂肪变性是本次检查的重要组成部分,可能包括病毒性肝炎的检测和详细的饮酒史。另外,一部分患有肥胖和代谢综合征但血浆肝酶浓度正常的病人也会有NAFLD,甚至可能是纤维化。因此,随着HIV感染者的数据积累,即使有正常的肝脏检查结果,具有多个NAFLD危险因素的病人也可以合理评估脂肪变性和纤维化。
关注微信公众号【艾滋免费远程匿名检测咨询】获取更多服务。