肠道菌群致脂肪肝核心机制被发现!调整菌群更有益健康
点击上方“转化医学网”订阅我们!
干货 | 靠谱 | 实用

导 读
肠道菌群群在脂肪肝疾病进展中起重要作用;然而其机制仍有待阐明。研究人员发现肠道菌群在HFD下大大减少色胺和吲哚-3-乙酸(I3A)的合成。该研究结果表明肠道微生物群可以通过代谢物参与宿主受体进而影响肝脏的炎症反应。那么,逆转脂肪肝是否先调整肠道菌群呢?少吃油腻食物,多运动才能保持健康呀!
非酒精性脂肪性肝病(NAFLD)是西方国家最流行的慢性肝病,其发病率与肥胖和代谢综合征密切相关。它涵盖了从简单脂肪变性到非酒精性脂肪性肝炎(NASH)的一系列疾病,其特征为肝内炎症,肝细胞气球样变性和进行性纤维化。持续性脂肪性肝炎可导致肝硬化和肝癌。
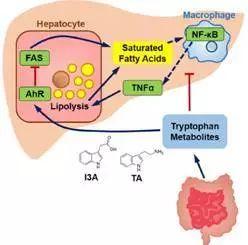
肠道菌群调控脂肪肝发展机制
目前驱动NAFLD进展的机制尚不清楚。首先,细胞脂质沉积物积聚在肝脏中。随后是免疫细胞的活化和促炎细胞因子的产生。营养,遗传和表观遗传因素对患有脂肪变性的个体是否发生更严重的脂肪肝疾病中起作用。另一个有助于NAFLD发病机制的新兴诱因是肠道微生物群的生态失调。

无高血脂(GF)小鼠喂食高脂肪饮食(HFD)并接种高血糖小鼠粪便中的细菌分离物可产生脂肪性肝炎,而GF小鼠饲喂相同的HFD但接种来自正常血糖小鼠的细菌仅显示轻度脂肪变性。这一现象的共同点是脂肪性肝炎的进展与肠道微生物群的代谢相关。最近的研究结果表明,微生物群产生的生物活性代谢物与宿主细胞通路相互作用,调节免疫细胞的命运和功能,肠内脂质吸收。转基因动物模型的研究表明,芳烃受体(AhR)在调节脂质和脂肪酸代谢中发挥重要作用。在小鼠中,AhR激活负调控脂肪生成酶,包括脂肪酸合酶(Fasn)和胆固醇代谢调节剂甾醇调节元件结合蛋白-1c(SREBP-1c)。
I3A和色胺能够大大减少促炎因子的释放
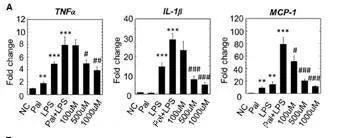
总之,研究人员证明肠道微生物依赖性代谢物吲哚-3-乙酸(I3A)可以直接调节肝细胞和巨噬细胞的炎症反应。该研究结果表明,I3A至少可以通过两种方式调节肝脏炎症反应。 I3A作用于巨噬细胞,可减弱促炎细胞因子的释放,诱导肝脏合成游离脂肪酸,从而刺激巨噬细胞。I3A还可减弱细胞因子介导的脂肪生成上调。 I3A对肝细胞的这些作用是AhR依赖性的,因为通过特异性拮抗剂抑制AhR抑制了I3A的作用。在动物模型和人类受试者中进一步研究可以明确I3A或其他微生物代谢物是否可以有效干预NAFLD的发展。
参考文献
Smitha Krishnan, YufangDing,NimaSaedi.Gut Microbiota-Derived Tryptophan MetabolitesModulate Inflammatory Response in Hepatocytesand Macrophages

转化医学领域核心门户
识别图中二维码,点击关注
投稿、应聘医学编辑:
微信:vipmed360
商务合作
微信:zhyxkf
END
活动
推荐
转折点——生物医药招聘第一平台
