《细胞》子刊:两周甩掉脂肪肝,养好产生叶酸的肠道微生物是关键|临床大发现
不管是刚毕业没多久的小青年,还是在职场历练多年的老司机,大部分人的体检报告上都会出现“脂肪肝”三个字。
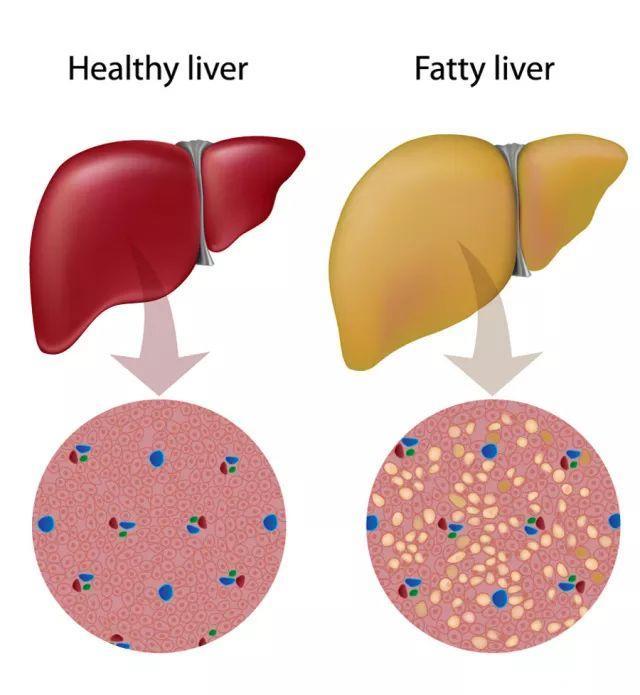
近年来的大规模流行病学调查显示,非酒精性脂肪性肝病(NAFLD)的发病率在显著增加。例如,在美国等西方国家中,每10个成年人,就有2-3个NAFLD患者。而对于肥胖人群来说,这一数值更加恐怖,每10个胖子中就有9个NAFLD患者[1]。
虽然在短时间内,我们可能感受不到它的威胁,但肝脏脂肪的长期积累,终究会引发肝脏炎症,进一步发展为肝纤维化,肝衰竭甚至肝癌等等。同时,NAFLD还是独立的心血管疾病以及2型糖尿病的高危风险因素[2,3]。
追求健康养生的现代人,开始努力去给肝脏减肥。不过对于NAFLD患者来说,目前最好的治疗办法是连科学家也搞不清为什么会有奇效的低碳饮食疗法[4]。但要是能管住嘴的话,谁还会得这毛病,更何况饮食干预一旦停止,它还很容易就反弹。
因此,搞清楚低碳饮食的机制,开发替代治疗方案迫在眉睫。
近日,来自瑞典哥德堡大学分子与临床医学系的Jan Boren教授领导的研究团队,通过对一组NAFLD患者进行饮食干预联合多组学分析,首次确定了低碳饮食治疗NALFD的可能机制,并将这一研究发表在《细胞代谢》杂志上[5]。
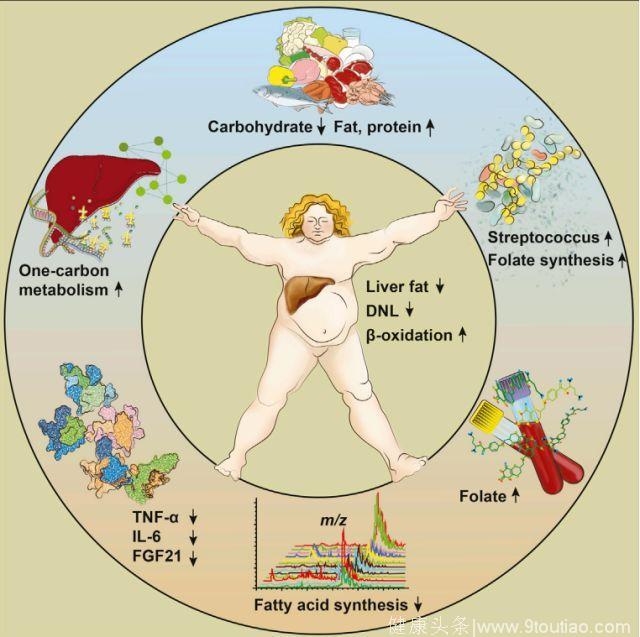
Boren教授发现,低碳饮食之所以可以在不改变患者体重情况下,两周将肝脏脂肪含量降低43.8%,与叶酸密切相关。具体来说,低碳饮食会促使患者肠道微生物中生产叶酸的链球菌丰度显著增加,而叶酸浓度的增加会导致肝脏代谢的改变,抑制肝脏细胞内脂肪的合成,同时加速脂肪的氧化分解。

Boren教授
说到这一研究,就不得不提低碳饮食和肠道微生物的关系了。
此前的研究已经表明,低碳饮食在显著抑制NAFLD进展的同时,还会显著改变患者的肠道微生物[6]。有趣地是,一些研究人员还发现,NAFLD在进展的过程中也都伴随着肠道微生物的变化,而肠道微生物移植也可以抑制NAFLD进展[7]。
因此,Boren教授怀疑,低碳饮食可以显著抑制NAFLD进展,应该靠的就是肠道微生物。
为此,Boren教授首先招募了一组NAFLD患者,进行为期两个星期的低碳饮食干预计划,使用等热量的蛋白质替代他们饮食中的大部分碳水化合物,并在两周后联合多组学方法对患者肝脏和肠道微生物进行分析。
核磁共振检查显示,在开始低碳饮食后仅一天,患者肝脏中的脂肪含量就开始下降。而两周后患者的肝脏脂肪含量平均下降了43.8%,空腹血液甘油三脂含量降低了48.4%。而在实验结束一个月后,Boren教授又对实验参与者进行了MRS检查,结果发现,回归正常生活后,他们的肝脏脂肪含量又回到了之前的水平。这也意味着,实验中肝脏脂肪含量的下降的确是由饮食模式改变介导的。
那么低碳饮食是如何降低患者肝脏脂肪的呢?
使用同位素标记,Boren教授发现,低碳饮食两个星期后,患者体内肝细胞脂肪从头合成水平降低了近80%,而脂肪氧化能力增强了4.9倍。同时,随着肝脏脂肪含量降低,肝脏功能改善,患者肝脏蛋白质合成显著增加,损伤得以修复,肝脏炎症水平也得到控制。
由于大量的研究表明,低碳饮食和肠道微生物的改变以及NAFLD密切相关[8]。因此,Boren教授对患者的肠道微生物进行了系统分析,结果发现,在进行低碳饮食干预仅一天后,有94株肠道微生物丰度显著改变。其中,一种肠道微生物链球菌的丰度显著增加,并产生了大量的叶酸,使患者血清叶酸水平显著增加。
叶酸与肝脏脂肪代谢
此前的研究表明,缺乏叶酸会诱导肝脏促炎性因子分泌的增加以及肝脏脂肪代谢受损,导致肝脏脂肪堆积和纤维化。同时,也有大量的证据表明,叶酸缺乏也促进NAFLD的发生[9]。因此,Boren教授随后开始研究患者肝脏脂肪水平的降低是否由链球菌产生的叶酸介导的。
通过对不同时间患者血清叶酸浓度和脂肪含量进行测量并进行部分回归分析建立线性混合模型,Boren教授发现,血清叶酸浓度的增加可以解释患者肝脏35.4%的脂肪含量降低。同时,通过对患者肝脏细胞进行转录组分析,Boren教授还发现,患者肝细胞内参与脂肪酸合成的基因表达显著下调,同时参与脂肪酸氧化的基因表达升高。
总体来说,Boren教授发现,即使进行短期低碳水化合物等热量饮食,也能显著增加NAFLD患者肝脏蛋白质含量,显著改善NAFLD患者的多种代谢。特别地,他们观察到肝脏脂肪合成明显减少,脂肪酸氧化显著增加,导致肝脏脂肪急剧减少。
同时,他们还发现,低碳饮食会使肠道微生物迅速向叶酸的生产转移。同时,叶酸浓度的增加,可能会导致肝脏脂肪的急剧减少。这也意味着,对于NAFLD患者来说,适当补充叶酸或许很有必要。


参考资料:
1.Lazo M, Hernaez R, Eberhardt M S, et al. Prevalence of nonalcoholic fatty liver disease in the United States: the Third National Health and Nutrition Examination Survey, 1988–1994[J]. American journal of epidemiology, 2013, 178(1): 38-45.
2.Marengo A, Rosso C, Bugianesi E. Liver cancer: connections with obesity, fatty liver, and cirrhosis[J]. Annual review of medicine, 2016, 67: 103-117.
3.Targher G, Byrne C D, Lonardo A, et al. Non-alcoholic fatty liver disease and risk of incident cardiovascular disease: a meta-analysis[J]. Journal of hepatology, 2016, 65(3): 589-600.
4.Rinella M E, Sanyal A J. Management of NAFLD: a stage-based approach[J]. Nature reviews Gastroenterology & hepatology, 2016, 13(4): 196.
5.Mardinoglu A, Wu H, Bjornson E, et al. An integrated understanding of the rapid metabolic benefits of a carbohydrate-restricted diet on hepatic steatosis in humans[J]. Cell metabolism, 2018, 27(3): 559-571. e5.
6.David L A, Maurice C F, Carmody R N, et al. Diet rapidly and reproducibly alters the human gut microbiome[J]. Nature, 2014, 505(7484): 559.
7.Zhou D, Pan Q, Shen F, et al. Total fecal microbiota transplantation alleviates high-fat diet-induced steatohepatitis in mice via beneficial regulation of gut microbiota[J]. Scientific reports, 2017, 7(1): 1529.
8.Leung C, Rivera L, Furness J B, et al. The role of the gut microbiota in NAFLD[J]. Nature Reviews Gastroenterology & Hepatology, 2016, 13(7): 412.
9.Christensen K E, Wu Q, Wang X, et al. Steatosis in Mice Is Associated with Gender, Folate Intake, and Expression of Genes of One-Carbon Metabolism–3[J]. The Journal of nutrition, 2010, 140(10): 1736-1741.

奇点:30万极客医生热爱的医疗科技媒体