权威:中国糖尿病足防治指南(2019版)(Ⅰ)
文章来源:中华糖尿病杂志, 2019,11(2) : 92-108
作者:中华医学会糖尿病学分会 中华医学会感染病学分会 中华医学会组织修复与再生分会
摘要
糖尿病足是糖尿病患者致残、致死的主要原因之一,本着"中国实践,中国证据,中国指南"的原则,中华医学会糖尿病学分会联合中华医学会感染病学分会、组织修复与再生分会以及其他相关领域的多学科专家,共同制定此部适合我国糖尿病足现状的临床指南,旨在规范我国糖尿病足的预防、诊断与治疗。本指南有以下特点:(1)突出临床实用性;(2)充分纳入糖尿病足领域的中国证据;(3)重视早期筛查与管理,强调糖尿病足的预防胜于治疗;(4)强调规范化综合管理的重要性;(5)强调糖尿病足的多学科协作诊断与治疗。另外,参照2017版中国2型糖尿病防治指南的要求,增加了要点提示和证据级别,根据证据质量、临床意义、普遍性、适用性等将证据级别分为A、B、C三个等级。A级:证据基于多项随机临床试验或Meta分析。B级:证据基于单项随机临床试验或多项非随机对照研究。C级:仅为专家共识意见和(或)基于小规模研究、回顾性研究和注册研究结果。
前言
糖尿病在我国已从少见病变成流行病,糖尿病足的患病率也明显增加,我国50岁以上的糖尿病患者,糖尿病足的发病率高达8.1%。据估计,全球每20秒钟就有一例糖尿病患者截肢;糖尿病足溃疡患者年死亡率高达11%,而截肢患者死亡率更高达22%;国内外研究表明,糖尿病足花费巨大,约占整个糖尿病医疗费用的三分之一。因此,糖尿病足是糖尿病患者致残、致死的主要原因之一,也是造成社会沉重负担的重大公共卫生问题。
有鉴于此,1996年中华医学会糖尿病学分会(CDS)糖尿病足与周围血管病变学组成立后,一直致力于通过多种途径促进我国糖尿病足相关领域学术交流以提高学术水平。除了组织大型流行病学调查、召开全国糖尿病足病及相关疾病论坛外,还积极制定糖尿病足相关共识与诊疗手册,以帮助各级医师提高糖尿病足相关知识,组建多学科协作的治疗团队,同时积极探讨糖尿病足的诊疗新技术。近20年来,虽然我国糖尿病足的小截肢率没有变化,但大截肢率从12.1%降至2.14%,从而降低了糖尿病足相关社会和经济负担。
纵观全球,自2005年以来,国际糖尿病联盟(IDF)在全球范围内提出"关注足以预防截肢",国际上开始重视糖尿病足并发症,一系列足病相关的指南相继问世,如在2011年开始,英国国立卫生保健研究所(The National Institute for Health and Care Excellence,NICE)糖尿病足问题住院管理指南与国际糖尿病足工作组(The International Working Group on the Diabetic Foot,IWGDF)糖尿病足管理和预防实践指南,2012年澳大利亚糖足网糖尿病足溃疡的管理临床实践指南,2016年美国足病医学会(American Podiatric Medical Association,APMA)联合血管外科学会及血管内科学会共同制定的糖尿病足管理实践指南等。但我国糖尿病足病患者与西方国家相比,有其自身的特点,因此我国的糖尿病足患者需要自己的指南予以临床指导。
2009年,我国CDS糖尿病足与周围血管病变学组起草了"中华医学会糖尿病学分会关于干细胞移植治疗糖尿病下肢动脉病变的立场声明",2013年起草了"2型糖尿病合并下肢动脉病变的筛查及管理规范",2015年出版了《糖尿病足病规范化诊疗手册》并在全国推广,2017年中国医疗保健国际交流促进会糖尿病足病分会发布了"中国糖尿病足诊治指南"以及2018年中国微循环学会周围血管疾病专业委员会糖尿病足学组起草了"糖尿病足创面修复专家共识"等。总体看来,上述指南或共识都是针对已经发生的糖尿病足的诊断和治疗进行规范,对于提高我国糖尿病足的愈合率、降低截肢率具有不可磨灭的作用,但是都忽略了糖尿病足的预防。目前我国糖尿病足呈现出治愈率提高、截肢率明显下降、但是糖尿病足发病率却逐年升高的现象。
实际上,糖尿病足的预防胜于治疗,通过加强糖尿病高危足的管理,以早期发现、诊断及治疗高危足,降低糖尿病足的发生,可以达到事半功倍的目的。因此,中国糖尿病足需要自己的指南,该指南应包括糖尿病足溃疡(diabetic foot ulcer,DFU)的预防、诊断、治疗以及与足病相关疾病的规范化处理。基于此,CDS责成糖尿病足与周围血管病变学组,联合中华医学会感染病学分会与中华医学会组织修复与再生分会,同时邀请血管外科、足踝外科、精神心理科、中医学及文献学、循证医学等相关领域专家,共同成立指南编写委员会及工作小组,对糖尿病足病相关领域新的临床证据进行梳理,汇中外精华、融百家智慧,历时一年余精心制定出这部中国糖尿病足防治指南。
该指南制定的宗旨是坚持防治结合,立足中国人群循证医学证据,着眼于临床应用的适用性和实用价值,规范临床医疗实践、改善中国糖尿病足防控现状。在指南内容表述中,参照2017版中国2型糖尿病防治指南的要求,增加了要点提示和证据级别,根据证据质量、临床意义、普遍性、适用性等将证据级别分为A、B、C三个等级。这些证据级别水平的推荐建议是在系统评价的基础上由多学科专家反复讨论形成的,A级:证据基于多项随机临床试验或Meta分析。B级:证据基于单项随机临床试验或多项非随机对照研究。C级:仅为专家共识意见和(或)基于小规模研究、回顾性研究和注册研究结果。
本版指南的制定还参考了世界卫生组织、中华医学会临床指南制定的标准流程并借鉴了国际相关指南制定标准。但是,正如前面所述,中国糖尿病足与国外有其不同的特点,因此本版指南中增加了糖尿病自主神经病变的诊治、下肢静脉疾病的防治、糖尿病足诊治过程中的营养评估与处理、糖尿病足诊治过程中的心、肾功能障碍的处理、糖尿病足的中医药治疗以及糖尿病足患者的心理问题等内容,旨在全方位地诊治糖尿病足相关问题,进一步提高糖尿病足的治愈率,降低截肢率和死亡率。
在指南制订过程中,我们发现,我国关于糖尿病足相关研究相对较少,虽然我们秉承"中国指南,中国证据,中国实践"的原则,但是我们自身的证据仅占四分之一左右(25.3%)。尽管本版指南尚有一些不尽如人意的地方,但相信本指南的发布,对于我国糖尿病足的防治可指明航行的方向,对于年轻医师和基层工作者,可起到规范职业行为作用。同时,在临床实践中发现问题并寻找解决问题的方法,进一步完善我国足病相关的证据,为今后指南的再版提供坚实的基础。
DFU和截肢的流行病学及医疗负担

一、糖尿病足的危害
糖尿病足的基本定义是糖尿病患者踝关节以远的皮肤及其深层组织破坏,常合并感染和(或)下肢不同程度的动脉闭塞症,严重者累及肌肉和骨组织。糖尿病足是糖尿病患者致残、致死的主要原因之一,也是造成社会沉重负担的重大公共卫生问题。据估计,全球每20秒钟就有一例糖尿病患者截肢[1,2]。糖尿病足预后很差,甚至比大多数癌症的病死率和致残率还高(除肺癌、胰腺癌等)。DFU患者年死亡率高达11%,截肢患者更是高达22%[3]。天津地区245例接受过截趾的病例随访5年,第1、3、5年累计新出现DFU的发生率分别是27.3%、57.2%和76.4%,再截趾率分别是12.5%、22.3%和47.1%,死亡率分别是5.8%、15.1%和32.7%[4]。国外学者估计,50%~70%的下肢截肢与糖尿病有关。Vadiveloo等[5]报告,在有足病高危因素的患者中,2年内死亡风险是截肢风险的9倍;已愈合DFU患者较活动性DFU患者的无截肢存活率更低,但后者截肢率更高。
全球每年约有400万糖尿病患者发生DFU。DFU是糖尿病足最常见的表现,也是造成糖尿病患者截肢的主要原因。85%以上的糖尿病患者截肢起因于DFU,每5个溃疡中有4个始于外部创伤,降低糖尿病截肢率应该从预防和及早发现并规范治疗DFU开始。
糖尿病足是最常见的住院原因,具有住院时间长、治疗困难、医疗费用高等特点。美国最近的大数据显示,相对于非卧床的糖尿病门诊患者,糖尿病足患者送住院或急诊者是前者的3.4倍、转诊给专科医师是前者的2.1倍、年就诊次数是前者的1.9倍,医师花费在诊治上的时间更多;糖尿病足感染(diabetic foot infection,DFI)患者直接转诊到急诊或住院更高达6.7倍[6]。
周围神经病变、下肢动脉病变(lower extremity arterial disease,LEAD)和足畸形是DFU发病风险增加的主要原因。年龄、性别、文化程度、经济条件、生活习惯和其他糖尿病并发症或合并症也是重要的发病因素。充分了解这些因素,对于糖尿病足的风险评估以及采取相应的预防措施相当重要。
二、DFU的患病率
确切的糖尿病足患病率和发病率的数据很有限,往往被低估。目前有关糖尿病足流行病学数据大多来自医院基础上的研究,例如欧洲的Eurodial研究和我国2004年、2012年的DFU调查等。相当多的DFU患者并未认识到足溃疡的严重性和治疗的急迫性,因而不能及时到医院专科就诊。许多患者的足相关问题(如胼胝等)是在家中自我处置或非医疗单位如澡堂、修脚店处理。部分严重患者即使来医院就诊,也会因为费用问题,放弃在医院的综合性治疗,甚至放弃所有治疗。即使在医院住院治疗,患者往往分散于内分泌(糖尿病)科、骨科、血管外科、烧伤科及普通外科等多个科室,导致某一专业的专科调查往往会漏诊部分患者。因此,现有文献数据可能低估了糖尿病足的患病率和截肢率。
文献中大多数数据来自于有选择的人群,且使用不同的定义,难以将国内或全球范围内的糖尿病足标准化,糖尿病足的类型和程度各地差别很大。如在发达国家,60%的新发溃疡是与周围动脉病变有关,即所谓神经缺血型或缺血型溃疡;在发展中国家,更常见的是神经性溃疡[7]。
Meta分析发现,全球DFU患病率为6.3%,男性高于女性,2型糖尿病高于1型糖尿病。不同国家、地区之间DFU患病率差距极大,介于1.5%~16.6%[8]。
根据2004年的多中心调查,我国DFU患者以单发、Wagner 1级和2级溃疡为主,合并坏疽者28.8%,部位多在足趾。DFU以神经缺血性为主,67.9%的溃疡合并感染[9]。2012年再次调查显示DFU的感染率、Wagner 3级以上及Texas分期D期比例升高,与2004年相比,总截肢率增加,但大截肢率降低、愈合率明显增加,住院天数由21 d缩短到18 d[10]。近期调查显示,45%的患者为Wagner 3级以上;总截肢率19.03%,其中大截肢2.14%,小截肢16.88%[11]。这些与文献报告的发达国家糖尿病足小截趾率增加、大截肢率下降一致[5]。
与南方地区相比,我国北方地区的糖尿病足患者足病病程长,高血压、血脂异常、冠心病、肾脏疾病、视网膜病变和神经病变患病率高,合并的其他危险因素多,足病预后更差。南方患者较多受血管和炎症因素方面的影响,北方患者受到的影响因素更多一些,不仅有血液学、血管病变的影响,还受经济条件方面的制约[12]。
根据我国多中心住院患者慢性皮肤溃疡调查,糖尿病作为致病因素已经由1986年的4.9%上升到2008年的32.6%,而创伤则由67.0%降低到23.8%[13]。
糖尿病足的主要不良结局是截肢和死亡。空军总医院报告该院自2001年至2015年1 771例糖尿病足患者总截肢率为18.24%,其中大截肢为2.32%,小截肢为15.92%;截肢患者血糖控制更差、炎症指标更高、营养学指标更差,合并下肢血管病率更高[14]。我国2010年多中心糖尿病截肢率调查收集了39家医院共有1 684例患者截肢数据,其中475例是因糖尿病足截肢,占28.2%,但各医院糖尿病截肢所占全院同期截肢率的百分比差别很大,最低为2.5%,最高为95.2%[15]。
国内有关DFU发病率的研究很少。Jiang等[16](姜玉峰)报告,我国糖尿病患者1年内新发溃疡发生率为8.1%,愈合的DFU患者1年内再发溃疡发生率为31.6%。
三、糖尿病足的医疗费用
2017年全球糖尿病医疗费用高达7 270亿美元,其中中国为1 100亿美元[1]。在发达国家,糖尿病足占用了12%~15%的糖尿病医疗卫生资源,而在发展中国家,则高达40%[17]。美国糖尿病医疗费用的三分之一用于糖尿病足患者[18]。故糖尿病足产生巨大的社会和家庭的经济负担。
美国糖尿病患者约2 230万,2012年度糖尿病医疗花费是2 450亿美元,其中糖尿病足的人均花费是8 658美元,除了基础的糖尿病花费以外,糖尿病足的医疗费用占90亿~130亿美元;与对照者相比,DFU患者住院时间更长、家庭医护费用更多,医疗费用是非足溃疡者的2倍,人均年增加医疗费用11 711美元(医疗保险卡使用者)和15 890美元(私人保险)[19]。英国2010~2011年糖尿病足医疗费用约5.80亿英镑,占全国医疗卫生支出的0.6%,该费用的一半以上(3.07亿英镑)用于社区和一级医疗服务单位DFU的护理,住院DFU费用为2.19亿英镑,截肢费用为5 500万英镑[20]。
我国2004年多中心调查显示,DFU患者平均住院天数为25天,次均总费用14 906元[9];2012年再次多中心调查显示DFU患者住院费用高于2004年,日均住院费用升高(955比589元),但住院天数缩短[18(12~32)比21(15~32)d],经过消费价格指数校正后,两组住院费用差异无统计学意义[10]。
我国2010年多中心糖尿病截肢率调查说明,病程大于20年的患者住院天数最长(42 d),住院费用最多(34 253元);随着Wagner分级的增加,住院天数无明显增加,但住院费用却明显增加;小截肢患者与大截肢患者比较,住院时间平均少3 d,住院费用平均低10 000元;二次或多次截肢及死亡患者不但住院时间明显延长,费用也显著增加[15]。
糖尿病足加重糖尿病患者的医疗经济负担,贫穷也与糖尿病足发生有关,不卫生的习惯导致感染性足病。延迟就诊在我国较为普遍,尤其在偏远经济不发达地区。
四、糖尿病足防治策略
发达国家多年的糖尿病足防治经验证明,贯彻预防为主、专业化诊治和多学科协作能够有效地降低DFU的发生、发展,提高治愈率,降低截肢率和医疗费用。
多学科协作的糖尿病足医疗护理专业团队可有效降低糖尿病截肢率和医疗费用,提高患者生活质量。新近报告的有24万人的英国乡村地区在建立血管外科专家主导的糖尿病足多学科协作队伍后,糖尿病下肢截肢率从10万分之412降低到10万分之15~44[21]。医疗服务的改变体现在:增加社区对这种多学科协作的足病团队服务的知晓率和临床路径;尽可能使患者入住专科病房;有快速的转诊通道;在门诊有操作室施行清创和微小截趾;有足病师、骨科和血管外科联合门诊;医院资深足病师与社区足病师有联动网络来关注糖尿病患者;在需要加强门诊随诊的患者,实行每周或两周一次的联合门诊;医院专科医师和护士对于患者实行密切随访,实现在患者家里的临床随访。法国医管部门要求,糖尿病足患者必须在48 h内转诊给有糖尿病足医护团队的医院诊治。
对于有足病风险因素的糖尿病患者,需要及早完成糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)、血管病变和足病筛查,及早发现和管理教育这些高危患者。非糖尿病足专业的医务人员对于出现以下情况的患者,应该及时转诊给糖尿病足专科或请相关专科会诊:皮肤颜色的急剧变化、局部疼痛加剧并有红肿等炎症表现、新发生的溃疡、原有浅表溃疡恶化并累及软组织和(或)骨组织、播散性蜂窝组织炎、全身感染征象、骨髓炎等。及时转诊或会诊有助于降低截肢率和减少医疗费用,外科医师及时介入有利于降低糖尿病截肢率和截肢平面[22]。
我国已经积极开展了全国性的糖尿病足防治专业培训和建立区域性的综合性多学科协作的糖尿病足中心,强调糖尿病足预防为主、专业化诊治和多学科协作基础上的综合治疗,促进糖尿病足的分级管理,取得了良好的社会效益和经济效益,显著地降低了糖尿病大截肢率[23]。
糖尿病足的筛查与预防
一、糖尿病足的整体危险因素
早期识别和及时有效干预糖尿病足的危险因素对糖尿病足的防治非常重要。
糖尿病患者的社会经济状况影响糖尿病足患病率、院前驻留时间、住院时间及预后[24,25],也是1型糖尿病患者痛性神经病变独立的预测因素及截肢的重要危险因素[25];低教育水平、低收入、缺乏运动、离异等患者糖尿病足风险明显升高[26];性别也是糖尿病足的重要影响因素,男性患者大截肢和小截肢(趾)的风险分别是女性的1.39和1.77倍[25,26]。

糖尿病并发症和合并症与糖尿病足发生的关系非常密切。糖尿病足患者合并脑血管疾病和周围血管疾病,不论大截肢还是小截肢(趾)风险均明显增加;合并症越多,足溃疡截肢率越高。合并三个以上疾病者其大截肢率高达20.8/1 000,而小截肢率也高达23.3/1 000[25]。视力障碍是糖尿病足的独立危险因素[27],糖尿病肾脏疾病不仅是DFU的危险因素也是截肢的高危因素[9,11,16,28,29,30]。糖尿病病程与糖尿病足发病高度相关,病程10年以上的糖尿病患者更易并发糖尿病足[9,11,16,28]。
代谢紊乱与糖尿病足密切相关,低甘油三酯、低胆固醇,高密度脂蛋白胆固醇降低与低密度脂蛋白胆固醇水平升高等脂代谢异常,低白蛋白血症、高尿酸血症、贫血、肥胖等均是DFU发生的危险因素或是独立危险因素[9,16,29,30,31,32]。血清胆红素、胱抑素C及纤维蛋白原水平也与糖尿病足发病及严重程度相关[30,31]。
由于吸烟是周围动脉疾病重要的危险因素[33],周围动脉病变与糖尿病足发生直接相关,戒烟对于预防足病非常重要。
二、糖尿病足的局部危险因素
1.DPN
DPN是糖尿病足发生的重要危险因素[34,35]。运动神经病变影响了足部肌肉的牵张力,使足部肌肉萎缩并改变了足底受力部位,导致足畸形,如爪形趾、锤状趾等。感觉神经受损,保护性感觉丧失,使足部对外界压力、异物或冷热反应性和抵御能力下降而易受伤,形成溃疡。自主神经病变使患者皮肤泌汗功能减弱,从而出现足部皮肤干燥皲裂,易引发细菌感染。运动神经、感觉神经及自主神经病变可以分别或共同成为糖尿病足发生的危险因素,影响糖尿病足的预后。
2.糖尿病周围动脉病变
糖尿病患者不仅出现周围动脉硬化、钙化和狭窄,还伴发微血管病变和微循环障碍,使下肢血流量减少,组织缺氧和营养成分供给不足,出现下肢发凉、疼痛和间歇性跛行,严重供血不足者可致溃疡、肢体坏疽[36]。我国50岁以上糖尿病LEAD的患病率为21.2%[37],且随着年龄增加患病率也随之增加,单纯下肢血管病变引起的DFU约占24%[11,37]。
3.截肢(趾)病史
既往有足溃疡史者,再次发生足溃疡的危险是无足溃疡史者的13倍,截肢(趾)的风险是无足溃疡史者的2.0~10.5倍[38,39]。有截肢史者,一半以上在5年内需进行第二次截肢[40]。
4.足底压力异常
足底压力增高是DFU发生的独立危险因素,相关性高达70%~90%[41]。长时间足底压力过高,导致足底局部缺血和组织分解,产生炎症,进而形成DFU[42]。Charcot神经骨关节病、畸形足、胼胝、不合适的鞋袜都可以引起足的生物力学(压力)异常而导致DFU发生[43,44]。
其他如嵌甲、水疱、出血及真菌感染均为DFU的前期病变,也是DFU发生的强烈预测因素。虽然治疗足溃疡前期病变对降低DFU发生的有效性并没有直接的证据,但2015国际糖尿病足工作组关于糖尿病足的预防指南仍建议积极处理患者的足溃疡前期病变[45]。
5.下肢静脉功能不全
没有足够的证据证明下肢静脉功能不全与DFU有直接相关性,但在糖尿病患者发生下肢静脉性溃疡感染几率增加,治疗与愈合的困难性增加,因此,建议要认真评估其危险因素,尽早发现这些危险因素并积极处理,预防其进展。
三、糖尿病足筛查
1.病史采集
病史采集[46]主要包括年龄、性别、身高、体重、民族、文化程度、职业在内的人口学资料,吸烟史、系统疾病史、糖尿病史、DFU病史、截肢(趾)病史、下肢血管病史、周围神经病史、过敏史等,记录糖尿病及并发症和(或)合并症病程与治疗措施。
2.体格检查
全身体格检查[46]应包括皮肤黏膜、浅表淋巴结、呼吸系统、循环系统、消化系统、泌尿系统、神经系统、运动系统的检查。
重点检查:足踝部的任何生物力学异常表现,包括拇外翻、拇囊炎、骨突出、槌/锤状趾、爪形趾、Charcot神经骨关节病和趾甲畸形等;足踝部任何关节活动范围受限;足踝部保护性感觉是否存在;双侧股、腘、胫后动脉的触诊及足背动脉搏动评估;皮肤的全面检查,包括皮温,是否存在干燥、皲裂、变色、硬结、水肿、真菌感染、胼胝等可能导致足溃疡的前期病变。
3.实验室及辅助检查
常规检查包括生化代谢指标、并发症状况等[46]。包括:空腹血糖、餐后血糖、糖化血红蛋白(HbA1c)、肝功能、肾功能、电解质、血脂、血常规、尿常规、尿微量白蛋白/尿肌酐和24 h尿蛋白定量、C反应蛋白(C reactive protein,CRP)及红细胞沉降率(erythrocyte sedimentation rate,ESR)等;心电图应作为常规检查,有条件的医院应开展步态及足底压力检查。
4.DPN的筛查
(1)远端对称性多发性神经病变:是DPN的常见类型。所有2型糖尿病患者确诊时和1型糖尿病患者诊断后5年,应进行DPN筛查,随后至少每年筛查一次。
(2)有典型症状者易于诊断,无症状者需要通过体格检查或神经电生理检查做出诊断。临床筛查DPN,推荐联合应用踝反射、针刺痛觉、震动觉、压力觉、温度觉5项检查方法[47,48]。
(3)用128 Hz音叉评估震动觉,10 g尼龙丝评估压力觉判断足溃疡和截肢的风险[49,50,51],适用于基层医疗单位或大规模人群筛查。
(4)根据有无远端对称性多发性神经病变,确定糖尿病足筛查的频率[52],见表1。

5.LEAD的筛查
对于50岁以上的糖尿病患者,应该常规进行LEAD的筛查,以全面评估下肢血管状况。伴有LEAD发病风险因素(如心脑血管病变、血脂异常、高血压、吸烟或糖尿病病程5年以上)的糖尿病患者应该每年至少筛查一次。对于有足溃疡、坏疽的糖尿病患者,不论其年龄均应该进行全面的动脉病变检查及评估。具体筛查路径见图1[53]。
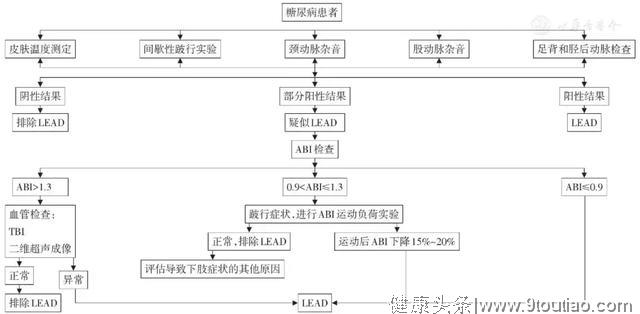
注:ABI为踝肱指数;TBI为趾肱指数
图1 糖尿病下肢动脉病变(LEAD)的筛查流程图
四、糖尿病足的预防
由于高危足的筛查及管理方法不统一、耗时长,尽管大家都知道高危足筛查的重要性,但是临床实际操作性差。刘瑾等[54]研究构建了糖尿病患者高危足筛查、分级及干预规范流程,该流程增加了粗筛环节,通过简单的病史询问发现至少1项危险因素的患者,方进入细筛流程。一方面通过粗筛缩小了筛查范围,节省了人力和时间成本,保证筛查的特异性;另一方面,将存在危险因素但无神经血管病变及足畸形的患者纳入0+级,兼顾了筛查的灵敏度,从而保证了高危足筛查和管理的可操作性和合理性,值得临床推广应用。
(一)整体预防
1.健康宣教
系统的糖尿病足相关知识教育可以减少糖尿病高危足患者DFU的发生率,降低DFU的复发率和提高无足溃疡事件的生存率[55,56],降低DFU的截肢率[56],降低医疗费用和提高患者的生活质量[57]。
由糖尿病足专科医护人员对患者及家属进行足部保护相关知识和护理方面的教育,并帮助他们转换成有效的行动。虽然专门评估健康教育能否预防DFU发生的临床研究较少,且证据等级较低[58],但这些健康教育措施可以使患者早期发现DFU的前期病变,加强自我行为管理,并保持足部清洁,是预防溃疡发生和复发的重要手段[59]。
2.血糖控制
严格控制血糖有助于减少糖尿病患者微血管并发症的发生[60]。因此,对于未发生足病的患者,应该尽量使血糖控制达标,以降低慢性血管并发症的发生风险。
3.心血管疾病高危因素的控制
高血压可通过加重周围动脉病变而增加DFU的发生风险,同时高血压也是周围动脉病变出现间歇性跛行的危险因素。基于糖尿病足的整体预防,糖尿病患者的血压控制应参照《中国2型糖尿病防治指南(2017版)》[22]建议实施。
血脂异常是引起糖尿病血管病变的危险因素,血脂异常的干预应根据《中国2型糖尿病防治指南(2017版)》[22]建议实施。
对于年龄大于50岁的糖尿病患者,尤其是合并有多重心血管危险因素者,在没有禁忌证的情况下应该口服阿司匹林以预防或延缓LEAD的发生。在糖尿病性LEAD的二级、三级预防中,都应给予抗血小板药物的治疗[53]。
4.戒烟
应劝告每一位吸烟的糖尿病患者戒烟或停用烟草类制品,减少被动吸烟,对患者吸烟状况以及尼古丁依赖程度进行评估,提供戒烟咨询,必要时加用药物等帮助戒烟[53]。
5.适度规律的运动
规律及适量的运动可增强胰岛素敏感性,有助于控制血糖,减轻体重和改善循环,减少心血管危险因素。运动方式和运动量的选择应在医师指导下进行,在确保安全的前提下,根据性别、年龄、体型、体力、运动习惯和爱好以及并发症的严重程度制订个体化的运动方案。运动前后要加强血糖监测,以免发生低血糖[53]。
对LEAD伴或不伴间歇性跛行的患者,进行监督下的运动训练,以降低足部溃疡的发生率[61,62]。
(二)局部预防
1.每天检查足与鞋袜[46]
建议糖尿病患者穿合适、具有足保护作用的鞋子,包括有足够的长度、宽度和深度。袜子需保持干燥、透气,应选择无接缝、无压迫性的跟帮、白色或浅色的棉袜,因其吸汗、柔软舒适,渗液易被发现。
2.胼胝与嵌甲的处理
(1)胼胝的处理
去除胼胝应由接受过糖尿病足专业培训的医护人员进行。胼胝形成后立即修剪,约每2~3周1次[63],建议胼胝修剪后使用减压鞋具进行减压治疗。
(2)嵌甲的处理
无论是修剪趾甲、拔甲、趾甲支架还是使用化学烧灼法去除嵌甲均需要由经过专业培训的医护人员进行,不宜去公共浴室或修脚处修理嵌甲。
3.足畸形的矫形处理
参见相关章节。
4.Charcot神经骨关节病的处理
参见相关章节。
5.减压鞋与减压支具
不可拆卸的减压装置和减压鞋对于糖尿病足底溃疡的预防和治疗有明显的效果[64],基于足跖压力和足部形状设计和制造的矫形减压器更有效预防和减少高危患者足溃疡发生[65]。建议根据患者的实际情况选择合适的减压装置来预防足溃疡。
6.下肢静脉功能不全的处理
参见相关章节
7.足真菌感染的处理
足癣较轻的患者可以局部使用抗真菌药物;在混合细菌和真菌感染的情况下,单独使用克霉唑和酮康唑可能会加剧细菌感染,特比萘芬可能更适用[66]。需注意降糖药与抗真菌药物之间的相互作用,在使用时要谨防血糖的过度降低。
8.皮温测定
糖尿病神经病变、血管病变及感染均与皮肤温度有一定关系[67,68]。测量皮温可以在任何情况下,由任何人在诊所或患者家中完成。加强足部皮肤温度监测,特别对于糖尿病高危足患者,有助于发现隐匿的糖尿病足、神经病变、血管病变及是否存在感染,做到早期诊断、早期治疗。
糖尿病神经病变

一、糖尿病足神经病变的流行病学和临床表现
(一)糖尿病足神经病变的流行病学
目前研究显示中国2型糖尿病患者DPN患病率为8.4%~61.8%[69,70,71,72],差异主要源自于研究人群、筛查和检测方法以及诊断标准的不同所致。糖尿病神经病变是糖尿病足重要发病因素之一,合并DPN的DFU患病率达5.0%~7.5%[73];DPN伴感觉缺失的患者发生DFU风险增加7倍[74];有45%~60%的DFU主要是因为神经病变所致,其中单纯性神经性溃疡占32.5%[75],同时因神经病变和缺血因素所致者占45%[11]。
(二)DPN的临床表现[76]
1.远端对称性多发性神经病变:双侧肢体麻木、刺痛、烧灼感、触电样疼痛及感觉异常等。
2.近端运动神经病变:一侧下肢近端严重疼痛为多见,可与双侧远端运动神经同时受累,伴迅速进展的肌无力和肌萎缩。
3.局灶性单神经病变:可累及颅神经或脊神经。颅神经损伤以上睑下垂(动眼神经)最常见,其次为面瘫(面神经)、眼球固定(外展神经)、面部疼痛(三叉神经)及听力损害(听神经)。
4.非对称性的多发局灶性神经病变:同时累及多个单神经,出现麻木或疼痛。
5.多发神经根病变:最常见为腰段多发神经根病变,主要为L2、L3和L4等高腰段的神经根病变引起的单侧下肢近端麻木、疼痛等。
6.自主神经病变:可累及心血管(直立性低血压、晕厥、冠状动脉舒缩功能异常、无痛性心肌梗死、心脏骤停或猝死)、消化(吞咽困难、呃逆、上腹饱胀、胃部不适、便秘、腹泻及排便障碍等)、泌尿生殖[排尿障碍、尿失禁、尿潴留、尿路感染等,性功能障碍如男性表现为勃起功能障碍和(或)逆向射精,女性表现为性欲减退、性交疼痛]等系统,还可出现体温调节、泌汗异常,对低血糖感知减退或无反应,低血糖恢复的过程延长及神经内分泌障碍。
7.部分DPN患者可以无任何临床症状。
二、DPN的诊断
(一)DPN的诊断标准[22,76]
1.DPN诊断缺乏特异性,糖尿病患者可存在非糖尿病所致的神经病变,诊断应排除以下情况:其他病因所致如颈腰椎病变(神经根压迫、椎管狭窄、颈腰椎退行性变)、脑梗死、格林-巴利综合征;严重动静脉血管性病变(静脉栓塞、淋巴管炎)等;药物尤其是化疗药物引起的神经毒性作用以及肾功能不全引起的代谢毒物对神经的损伤。
2.明确的糖尿病病史。
3.诊断糖尿病时或之后出现的神经病变。
4.临床症状和体征与DPN的表现相符。
5.有临床症状(疼痛、麻木、感觉异常等)者,5项检查(踝反射、针刺痛觉、震动觉、压力觉、温度觉)中任1项异常;无临床症状者,5项检查中任2项异常,临床诊断为DPN。
(二)DPN的诊断分层[76,77]:
1.确诊:
有远端对称性多发性神经病变的症状或体征,同时存在神经传导功能异常;
2.临床诊断:
有远端对称性多发性神经病变的症状及1项阳性体征,或无症状但有2项或2项以上体征为阳性;
3.疑似:
有远端对称性多发性神经病变的症状但无体征,或无症状但有1项体征阳性;
4.亚临床:
无远端对称性多发性神经病变症状和体征,仅存在神经传导功能异常。
(三)DPN的类型诊断[76]:
1.远端对称性多发性神经病变:
表现为双侧肢体疼痛、麻木、感觉异常等;
2.近端运动神经病变:
累及下肢近端运动神经,可与双侧远端运动神经同时受累;
3.局灶性单神经病变:
累及单根颅神经或脊神经;
4.非对称性的多发局灶性神经病变:
同时累及多个单神经的神经病变称为多灶性单神经病变或非对称性多神经病变;
5.多发神经根病变:
主要为L2-L4等高腰段的神经根病变;
6.自主神经病变:
可累及心血管、消化、呼吸、泌尿生殖等系统,还可出现体温调节、泌汗异常及神经内分泌障碍。
(四)DPN的诊断流程
主要根据临床症状和体征进行检查和诊断[22,78](图2)。
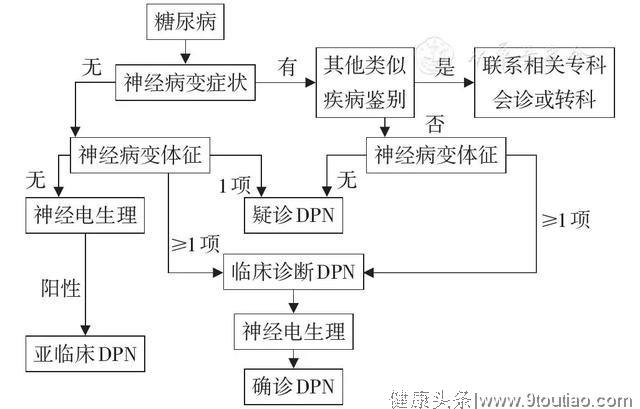
图2 糖尿病周围神经病变(DPN)诊断流程
临床诊断有疑问时,可做肌电图进行神经传导功能等检查,若上肢的感觉性或运动性神经传导速度<45 m/s,下肢的神经传递速度<40 m/s,且累及3支及以上神经,不管有无临床症状,即可做出诊断。
三、糖尿病自主神经病变的诊断
(一)心血管自主神经病变
糖尿病心血管自主神经病变是糖尿病自主神经病变的重要部分,主要表现为静息性心动过速和直立性低血压。早期可无明显症状,疾病进展可出现心悸、站立时轻度头痛、视力障碍、晕厥等。
1.糖尿病心血管自主神经病变的诊断标准
依据临床症状和/或体格检查,包括静息性心动过速(即静息心率>100次/min),直立性低血压[由卧位、蹲位到直立位时收缩压下降>20 mmHg(1 mmHg=0.133 kPa)或舒张压下降>10 mmHg],且心率没有代偿性增加[79,80]。心率变异性、24 h动态血压监测可作为辅助诊断[81]。
2.糖尿病心血管自主神经病变的诊断流程
(1)副交感神经系统:深呼吸时心率改变,直立时心率改变,Valsalva动作时心率改变;(2)交感神经系统:直立时血压改变;(3)通过5 min静息心电图记录或24 h动态心电监测评价心率变异性。
以上有二项检查结果阳性时,应怀疑心脏自主神经病变;三项检查结果阳性时,可以诊断(图3)。
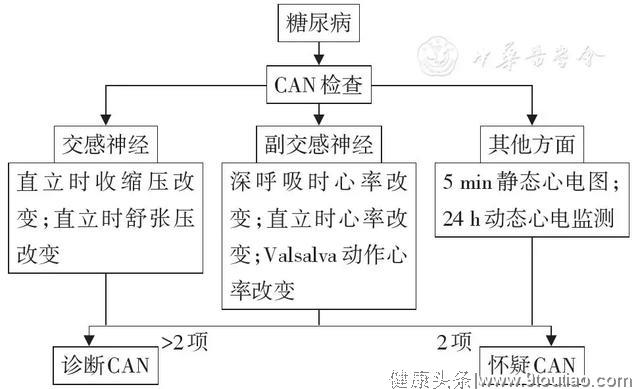
图3 糖尿病心脏自主神经病变(CAN)诊断流程
(二)消化系统自主神经病变
消化系统自主神经病变可表现为食管蠕动障碍、胃轻瘫、便秘、腹泻、大便失禁等。
1.胃轻瘫
对于血糖控制不佳或不明原因上消化道症状(早饱、腹胀、恶心、呕吐等症状)的患者,建议筛查是否存在胃轻瘫。
胃轻瘫诊断方法:进食后4 h内每隔15分钟做一次可消化固体的闪烁图扫描,测定胃排空情况[82]。13碳呼气试验及胃电图也有助于诊断胃轻瘫[83,84]。
胃轻瘫应排除应用胰高糖素样肽-1(GLP-1)受体激动剂、阿片类等影响胃排空药物、消化道梗阻、消化性溃疡(胃镜或胃钡餐)后方可诊断。
2.其他消化道功能紊乱
小肠功能障碍:没有特异性的诊断性试验,但测压法可以明确是否存在肠道动力异常。大肠功能障碍:钡剂测压可辅助诊断。胆囊功能障碍:功能超声可辅助诊断。
(三)膀胱自主神经病变
表现为尿失禁、夜尿多、尿频、尿急、排尿无力等。对有反复下尿路感染、肾盂肾炎、尿失禁或尿潴留的糖尿病患者,建议进行膀胱功能评估。
膀胱测压(包括排尿前后膀胱容量评估)、尿动力学检查等可辅助诊断糖尿病膀胱自主神经病变。
(四)其他自主神经病变
1.排汗异常
表现为出汗减少或不出汗,从而导致手足干燥皲裂,容易继发感染。简单排汗测试、Sudoscan等可辅助评价排汗功能[85]。也可用汗印法诊断膏贴进行排汗神经功能检测,该方法简便,可早期筛查[86,87]。
2.无症状低血糖
对低血糖感知异常,尤其存在自主神经病变时,糖尿病患者对低血糖感知减退或无反应,低血糖恢复的过程延长,严重时可危及生命。因此,应加强血糖监测,及时处理。
四、糖尿病神经病变的治疗
(一)病因治疗
代谢控制是DPN治疗的基础,针对病因的治疗应包括综合代谢控制:控制血糖、血压、调节血脂[建议参照《中国2型糖尿病防治指南(2017年版)》[22]]、戒烟(吸烟是DPN重要的风险因素,鼓励患者戒烟[88])、运动[长时间有氧运动可延缓DPN发生和延缓进展[89],但有足部皮肤破损和(或)溃疡时,受累肢体需要制动]。
(二)针对神经病变的发病机制治疗
DPN的发病机制复杂,治疗应针对发病机制的不同方面进行(抗氧化、改善缺血、抑制醛糖还原酶及神经修复剂等)。
1.抗氧化应激
α-硫辛酸是目前临床应用最广的强抗氧化剂。ALANDIN、SYDNEY等多项临床研究证实,α-硫辛酸600 mg/d静滴3周,可改善神经感觉症状(TSS评分)[90,91,92,93]和神经传导速度[90,91],600 mg 3次/d长期口服亦可改善电生理改变[94],且安全性好,并建议尽早给予治疗[95]。推荐用法:α-硫辛酸针剂600 mg/d静滴2~4周,其后600 mg 3次/d口服,疗程3个月,该药安全性良好。
2.改善微循环
前列腺素及前列腺素类似物制剂:前列腺素E1改善DPN症状及体征以及神经传导速度均优于B族维生素、安慰剂及其他改善微循环药物,且前列腺素E1脂微球载体制剂较前列腺素E1粉针剂改善自发性疼痛和感觉异常等症状更有效[96]。口服贝前列腺素钠也有类似作用[97]。此外,前列腺素E1脂微球载体制剂联合硫辛酸治疗DPN,临床效果和神经传导速度的改善均明显优于单一的前列腺素E1脂微球载体制剂或α-硫辛酸治疗,且并没有严重的副作用发生[98]。推荐用法:前列腺素E1脂微球载体制剂10 μg/d静滴2周,然后序贯给予贝前列腺素钠20~40 μg每日2~3次口服,连续治疗8周。该类药物安全性好,副作用发生率低(主要是胃肠道反应,静脉制剂主要是静脉炎)。
胰激肽原酶:具有改善运动或感觉神经传导速度,抑制血小板聚集,防止血栓形成,改善血液循环等作用,在改善DPN症状及体征以及神经传导速度方面与前列腺素E1脂微球载体制剂相似,优于对照组[99]。推荐用法:胰激肽原酶每日40 U,肌肉注射,连续10日,然后隔天肌肉注射一次,连续20日作为一个疗程。
3.改善代谢紊乱
常用药物为醛糖还原酶抑制剂,研究证实依帕司他(epalrestat)对DPN有改善症状和延缓进展的疗效[100]。新近发表的3项Meta分析结果均显示[101,102,103]:依帕司他联合ɑ-硫辛酸治疗DPN,临床效果明显优于单一的硫辛酸治疗或依帕司他治疗,其正中运动神经传导速度、腓总运动神经传导速度、正中感觉神经传导速度和腓总感觉神经传导速度的改善也明显优于单一治疗。这些研究结果值得临床借鉴,但纳入研究存在设计报道简单、主观指标少、随访时间短等问题,纳入文献质量普遍不高,临床应用需谨慎考虑此结论。推荐用法:依帕司他片,50 mg 3次/d口服,长期应用耐受性较好,副作用偶有恶心、腹痛等,长期服用应注意肝酶学的变化,其代谢产物有颜色而致眼泪和尿色变粉红。
4.营养神经及神经修复
活性维生素B12制剂如甲钴胺,可明显改善DPN的临床症状、体征以及神经传导速度[104],且甲钴胺与前列腺素E1脂微球载体制剂联合应用疗效更优于单药[105]。推荐用法:甲钴胺针剂500~1 000 μg/d肌注或静脉滴注,2~4周,其后给予甲钴胺片500 μg 3次/d口服。该类药物安全性好,无明显副作用。
(三)针对疼痛症状的治疗
疼痛是DPN的主要症状,对症止痛是DPN治疗的重要环节。目前推荐用于DPN止痛治疗的有以下药物。
1.抗抑郁药
(1)三环类抗抑郁药物(tricyclic antidepressant,TCAs):TCAs可提高疼痛阈值,具有较强的止痛效果。阿米替林作为经典药物[106],一直是治疗神经性疼痛的一线药物,系统评价表明阿米替林应继续作为治疗神经性疼痛的药物,但更应该关注的是对治疗效果的高估[107]。推荐用法:起始剂量为12.5~25.0 mg/d,根据病情变化逐渐增至有效剂量或患者最大耐受剂量100 mg/d。每天只需服用一次,6~8周起效,花费最低。常见不良反应有口干、瞳孔散大、直立性低血压、心率增快、尿潴留和便秘,嗜睡、体重增加等。禁用于癫痫和眼内压升高者、有跌倒病史者。有缺血性心脏病、心室传导阻滞者也应谨慎使用。
(2)选择性5-羟色胺和去甲肾上腺素再摄取抑制剂(serotonin-norepinephrine reuptake inhibitors,SNRIs):SNRIs通过抑制疼痛冲动传导通路可塑性止痛。推荐药物是度洛西汀,度洛西汀60 mg/d和120 mg/d对痛性DPN有效,治疗12周后,近50%的患者疼痛可获得50%以上的缓解[108]。推荐用法:度洛西汀起始剂量为60 mg/d,餐时服用,逐渐增加至有效剂量或最大耐受剂量(不超过120 mg/d),7~14 d起效,疗程12周。常见不良反应为恶心、嗜睡、头晕、食欲下降和便秘,可导致血压轻度升高,高血压患者应慎用。
2.抗惊厥药物
抗惊厥药物可使受损神经元的动作电位放电频率减慢,从而缓解疼痛症状。相关药物有:
(1)普瑞巴林(pregabalin):普瑞巴林3个剂量(150、300和600 mg/d)均显著减轻糖尿病周围神经痛和疼痛相关睡眠干扰,且效果呈剂量依赖性[109];新近的两个随机对照试验(randomized controlled trial, RCT)研究也证实了每日150~300 mg的普瑞巴林能够有效地治疗神经痛[110,111]。推荐用法:自50 mg每日3次(150 mg/d)起,根据效果逐渐将剂量加至最大剂量600 mg/d。常见不良反应为头晕、嗜睡和外周水肿,停药时应缓慢减量,突然撤药容易诱发脑水肿和脑病。
(2)加巴喷丁(gabapentin):对六种抗抑郁药和抗惊厥药治疗疼痛型DPN的疗效和安全性进行的网状Meta分析显示,获益/风险比的有利排序分别为:加巴喷丁、文拉法辛、普瑞巴林、度洛西汀/加巴喷丁联合制剂、度洛西汀、安慰剂和阿米替林,加巴喷丁不但疗效最佳,而且在疗效和安全性之间表现出最佳的平衡[112]。新近的一项系统评价表明1 800~3 600 mg/d的加巴喷丁可以为DPN患者提供良好的止痛效果[113]。推荐用法:加巴喷丁起始剂量为900 mg/d,可逐渐增加剂量至3 600 mg/d。该药耐受性较好,不良反应有头晕、下肢乏力、走路不稳等。
3.阿片类镇痛药
止痛原理主要是作用于中枢痛觉传导通路阿片受体,提高痛觉阈值,对前述治疗方案无效的患者可选用。推荐药物是曲马多,应用于难治性DPN病例[114]。新近的一项系统评价显示,与安慰剂(30%)相比,曲马多可使53%的患者疼痛减轻50%,需要治疗的患者数[number need to treat (NNT)]=4.4[115]。推荐用法:起始剂量为200 mg/d,分剂量使用,根据效果逐渐增加至有效剂量或最大耐受剂量400 mg/d。常见不良反应包括便秘、恶心和头晕;重要副作用包括耐受性、撤药综合征、情绪变化及滥用风险。
4.局部止痛治疗药物
适用于局部疼痛且不能耐受口服药物的患者。目前常用的是辣椒素贴膏,其剂型为膏状。研究显示:在治疗疼痛性DPN中,8%的辣椒素贴片效果不劣于普瑞巴林,且更快发挥作用,副作用更少,患者满意度更高[116];其后的网状Meta分析发现其效果与口服药物(如普瑞巴林、度洛西汀、加巴喷丁)相似,但患者耐受性更好[117];新近的头对头RCT研究显示,8%的辣椒素贴片效果优于普瑞巴林,疼痛完全缓解的数量是普瑞巴林的一倍[118]。推荐用法:每天4次,局部外敷。副作用有皮肤烧伤、红斑和打喷嚏。
(四)糖尿病自主神经病变的治疗
目前对于糖尿病自主神经病变的干预研究较DPN少,且研究样本量均偏小,所得结论在临床上应用尚需谨慎。
1.心血管自主神经病变
醛糖还原酶抑制剂:一个小型的病例对照研究[119]显示长期给予依帕司他治疗36个月,发现在糖尿病心血管自主神经病变患者的RR间期的变异系数有所增加,但QTc间期没有任何改变,提示长期使用醛糖还原酶抑制剂可能对较年长且持续时间较长的糖尿病患者的心脏自主神经病变有一定效果。最近一项系统评价[120]表明给予醛糖还原酶抑制剂治疗可以改善心脏自主神经病变,尤其是对于轻度或无症状的糖尿病心血管自主神经病变患者,但由于纳入研究的质量及方法学问题,所得结论需要慎重采纳。
血管紧张素转化酶抑制剂(angiotensin converting enzyme inhibitor,ACEI):一项小型的RCT研究[121]显示,给予喹那普利(quinapril)治疗3个月,发现能够增加糖尿病心血管自主神经病变患者的副交感活动,并持续到第6个月;随后一项治疗时间长达1年的病例对照研究[122]显示,喹那普利治疗降低了糖尿病心血管自主神经病变患者的交感优势,尤其在早晚期间明显;有学者研究显示,在无症状的1型或2型糖尿病伴有糖尿病心血管自主神经病变患者,分别给予喹那普利、氯沙坦以及喹那普利联合氯沙坦治疗1年,结果发现早期给予ACEI或血管紧张素Ⅱ受体拮抗剂(angiotensin Ⅱ receptor blocker,ARB)治疗均可改善糖尿病心血管自主神经病变及左室舒张功能,且喹那普利联合氯沙坦疗效略优于单一治疗[123]。鉴于上述研究样本量较小,所得结论应该慎重考虑,但是为糖尿病心血管自主神经病变的治疗提供了参考。此外,有研究发现,与单纯ACEI相比,左室功能障碍患者在ACEI+ARB联合治疗中发生不良事件导致停药的风险增加[124]。这种过度的风险,再加上缺乏持续的死亡率效益,表明ARB不应常规加入ACEI治疗左心室功能障碍。
α-硫辛酸:目前的证据并不支持α-硫辛酸用于治疗糖尿病心血管自主神经病变,Tankova等[125]研究提示采用硫辛酸治疗仅有轻微的作用,虽然其后Ziegler等[126]研究提示硫辛酸有效,但最近Pop-Busui等[127]研究认为,硫辛酸不但不能阻止糖尿病心血管自主神经病变的进展,对于心肌灌注没有益处,有可能还有害处。因此,鉴于目前的证据,临床上使用硫辛酸治疗糖尿病心血管自主神经病变尚需慎重。
米多君(midodrine):是一类外周α1-肾上腺素能受体激动剂。可改善体位性低血压,延长症状缓解时间[128]。其主要不良反应为仰卧位高血压、感觉异常。严重心血管疾病、甲状腺功能亢进者禁用。
屈昔多巴(droxidopa):是一种口服去甲肾上腺素前体药,在激动α-肾上腺素能受体同时,通过β1-肾上腺能效应提高心脏离子通道活性。在症状性神经源性直立性低血压患者,给予屈昔多巴治疗,能够较好地改善患者的症状以及症状对日常活动的影响,同时增加站立收缩压,该药耐受性良好[129,130]。
2.消化系统自主神经病变
饮食调整:例如少食多餐、减少饮食中脂肪和纤维素的含量,用小颗粒饮食[131]。
停用影响胃肠动力的药物:包括阿片类药物、抗胆碱药、GLP-1受体激动剂、二肽激肽酶Ⅳ(DDP-4)抑制剂等[132]。
药物治疗:(1)甲氧氯普胺(胃复安):是多巴胺D2受体拮抗剂,目前推荐短期使用。然而,其有严重副作用风险(锥体外系症状如急性排斥反应、药物诱发的帕金森综合征,静坐不能,迟发性运动障碍);只有在其他药物无效的严重胃轻瘫,才考虑应用5 d以上[133,134]。(2)多潘立酮(吗丁啉):在治疗糖尿病胃轻瘫上,效果与甲氧氯普胺相似,且中枢副作用较轻,但需监测QT间期[134]。(3)大环内酯类抗菌素:作为胃动素受体激动剂,能刺激肠道蠕动[135],目前红霉素、阿奇霉素多用。可促胃肠动力、缩短胃排空时间,可以作为治疗糖尿病自主神经病变引起的胃轻瘫的替代药物[136,137,138]。
3.膀胱自主神经病变
非药物治疗:避免尿潴留,勤于排尿,排尿前膀胱外按摩,膀胱导尿(临时或永久)、膀胱造瘘等;
药物治疗:可选择抗胆碱能药物如氨甲酰甲胆碱[139]。
(未完待续)
本指南学术委员会成员名单
指南制定工作组长:冉兴无,贾伟平
领导小组(排名不分先后):贾伟平,付小兵,王贵强,朱大龙,纪立农,翁建平,周智广,邹大进,郭立新,姬秋和,李小英,冉兴无,许樟荣,王鹏华,冯波,薛耀明,顾洪斌
工作委员会(按姓氏汉语拼音排序):曹烨民(上海中医药大学附属上海市中西医结合医院脉管科);陈明卫(安徽医科大学第一附属医院内分泌科);成志锋(哈尔滨医科大学附属第四医院内分泌科);董再全(四川大学华西医院心理卫生中心);冯波(同济大学附属东方医院内分泌科);付小兵(解放军总医院生命科学院、基础医学研究所、全军创伤修复与组织再生重点实验室);顾洪斌(解放军战略支援部队特色医学中心血管外科);谷涌泉(首都医科大学宣武医院血管外科);郭立新(北京医院内分泌科);韩春茂(浙江大学医学院附属第二医院烧伤科);韩会民(黑龙江大庆市第四医院内分泌科);黄文祥(重庆医科大学附属第一医院感染病科);纪立农(北京大学人民医院内分泌科);姬秋和(空军军医大学西京医院内分泌科);贾伟平(上海交通大学附属第六人民医院内分泌代谢科);姜玉峰(解放军战略支援部队特色医学中心创面修复科);况伟宏(四川大学华西医院心理卫生中心);李秋(山东省立医院糖尿病足防治中心);李小英(复旦大学附属中山医院内分泌科);李益明(复旦大学附属华山医院内分泌科);林少达(汕头大学医学院附属第一医院内分泌科);刘芳(上海交通大学附属第六人民医院内分泌代谢科);陆树良(上海交通大学医学院附属瑞金医院创面修复中心);吕晓菊(四川大学华西医院感染性疾病中心);冉兴无(四川大学华西医院内分泌代谢科);孙鑫(四川大学华西临床医学院循证医学研究中心);孙学礼(四川大学华西医院心理卫生中心);汤正义(上海交通大学医学院附属瑞金医院内分泌科);王爱红(解放军战略支援部队特色医学中心糖尿病中心);王爱萍(解放军东部战区空军医院内分泌科);王椿(四川大学华西医院内分泌代谢科);王贵强(北京大学第一医院感染疾病科);王明贵(上海华山医院抗生素研究所);王鹏华(天津医科大学代谢病医院足病科);肖永红(浙江大学医学院附属第一医院);谢挺(上海交通大学医学院附属第九人民医院创面修复科);谢晓敏(银川市第一人民医院内分泌科);许樟荣(解放军战略支援部队特色医学中心糖尿病中心);薛耀明(南方医科大学南方医院内分泌代谢科);颜晓东(广西壮族自治区人民医院内分泌科);闫振成(第三军医大学大坪医院高血压内分泌科);杨兵全(东南大学附属中大医院内分泌科);杨川(中山大学孙逸仙纪念医院内分泌科);杨颖(中华糖尿病杂志编辑部);俞光荣(同济大学附属同济医院骨科);张朝晖(天津中医药大学第二附属医院糖尿病足科);张建中(首都医科大学北京同仁医院足踝外科);张明珠(同济大学附属同济医院骨科);赵纪春(四川大学华西医院血管外科);赵湜(华中科技大学同济医学院附属武汉中心医院内分泌科);周智广(中南大学湘雅二医院代谢内分泌学科);朱大龙(南京大学医学院附属鼓楼医院内分泌科);邹大进(海军军医大学长海医院内分泌科)
工作委员会秘书:王椿(四川大学华西医院内分泌代谢科);王爱红(解放军战略支援部队特色医学中心糖尿病中心)