赵立平等《科学》亮剑:用膳食纤维"钓"出15株缓解糖尿病的细菌!

十年磨一剑!上海交大赵立平、张晨虹、彭永德等人在《科学》杂志发布重大菌群研究成果。
作者丨栾晓东、李丹宜、沈志勋、热心肠先生
来源丨热心肠先生
前不久,《科学》杂志上线了一篇论文,介绍了上海交通大学赵立平、张晨虹和彭永德教授等人合作完成的重量级研究成果——利用多种膳食纤维的组合,改善了糖尿病人的肠道菌群,选择性地促进一组产短链脂肪酸细菌的富集,这组菌的丰度和多样性越高,血糖改善越好。
这是赵立平教授和团队的厚积薄发之作,在经过十几年的摸索和沉淀后,他们的研究成果终于登上世界最顶级的学术期刊。
我们谨向赵立平教授和团队致以最热烈的祝贺!
下面,我们特别刊发对这篇文章的解读和赵立平教授专访。
论文解读

图片来源:Science.2012 Jun 8;336(6086):1248-50.
在食物中有一类物质,被称为膳食纤维。这类物质通常是寡糖或多糖,难以被人体消化和吸收,不会直接为人体供能,在一段时间里都被认为是“无营养物质”而被忽视。
但这类物质却可以被一些有益菌利用,促进这些有益菌生长并释放短链脂肪酸,后者的产生不足与2型糖尿病的发展密切相关。通过改善饮食结构,可以有效地富集这类有益菌,帮助改善2型糖尿病。
赵立平教授和团队正是基于以往的研究结果,大胆假设并充分设计和完成了巧妙而合理的实验,从而进一步揭示了真相。
1
高膳食纤维饮食改善2型糖尿病患者的血糖指标、体重及血脂
首先,他们将2型糖尿病患者分为两组:按2013版中国糖尿病学会患者教育和膳食指南接受常规治疗的对照组(U组,最终入组16人)和接受高膳食纤维饮食干预的实验组(W组,入组27人)。
控制两组摄入的膳食总热量和宏量营养素基本一致,W组采用含有复杂组分的三种不同膳食纤维组合进行干预,两组都使用α淀粉酶抑制剂阿卡波糖进行治疗。
结果发现,两组患者的糖化血红蛋白比例(衡量血糖总体控制情况的指标),在起初都会出现明显下降,但从28天以后,W组的下降水平会更加显著。
糖化血红蛋白达标的患者比例,W组也明显高于U组(89%vs 50%),此外W组的其他血糖指标、体重和血脂情况的改善也更好。
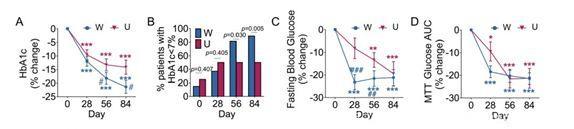
对照组与实验组各项血糖指标的比较
虽然仅通过阿卡波糖就可以改善疾病,但是额外的高膳食纤维饮食,可以更有效快速地缓解疾病。
2
肠道菌群变化与改善2型糖尿病之间的“因果关联”
膳食纤维几乎无法被人体自身消化和吸收,大多被肠道菌群发酵利用。那么,高膳食纤维饮食是否作用于肠道菌群,从而改善患者的临床指标呢?
赵立平团队为了搞清这个问题,将同一病人干预前后的菌群移植给无菌小鼠。移植成功的小鼠中,接受了患者干预后菌群的小鼠,血糖情况明显优于移植了患者干预前菌群的小鼠。
这说明高膳食纤维确实改变了菌群,进而改善血糖代谢。
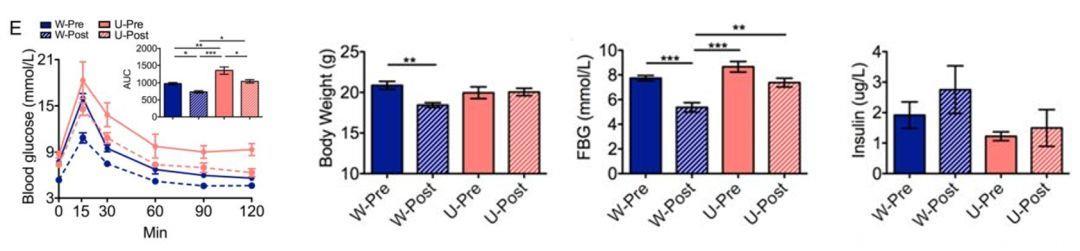
因膳食纤维摄入而改变的人体菌群改善小鼠的血糖反应及体重
那么,菌群结构到底发生了哪些改变?
经过0天、28天、56天和84天的采样,进行鸟枪法元基因组测序后发现,在起初的28天,肠道菌群基因的丰富度明显下降(有趣的是,许多研究指出,菌群基因的高多样性通常预示着较高的健康状况),但在28天后,W组的基因丰富度明显高于U组;并且在干预结束时的84天,两组的肠道菌群结构存在明显差异。
将所有临床生理指标与肠道菌群的整体结构变化做进一步分析发现,肠道菌群的结构改变与临床现象密切相关。
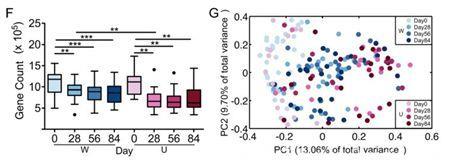
高膳食纤维导致的肠道菌群变化
3
肠道菌群在基因水平上的变化
在基因水平上的进一步分析表明,降解碳水化合物的基因的丰度,可以更好地反映与患者健康相关的菌群变化。干预后,参与淀粉和菊粉分解的基因在两组受试者肠道中均显著增加,而参与利用果胶质和黏液素的基因则均显著减少。
比较W组与U组发现,编码用于分解植物细胞壁多酶复合体衔接和锚定部分的基因仅在W组干预后增加。
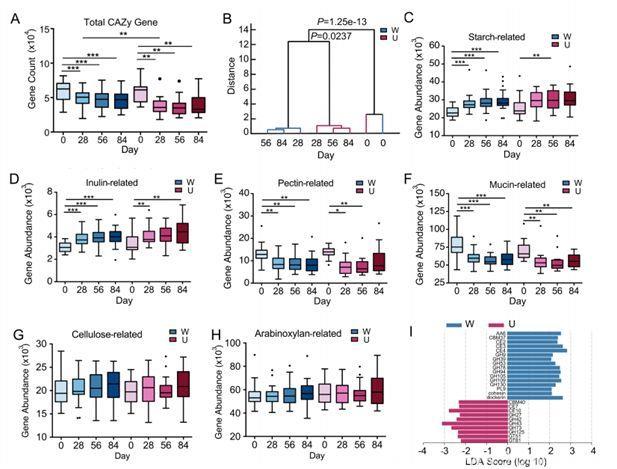
高膳食纤维调节肠道菌群的碳水化合物利用相关基因
再将目光聚集在与短链脂肪酸合成的相关基因上。肠道菌群代谢膳食纤维产生的短链脂肪酸,可能介导了菌群对血糖稳态的影响。其中乙酸和丁酸的产生被认为可以增加肠道中胰高血糖素样肽-1(GLP-1)和YY肽(PYY的)分泌,从而促进胰岛素分泌,改善2型糖尿病。
通过分析菌群中代谢短链脂肪酸的基因通路和患者粪便中短链脂肪酸的含量,赵立平团队发现乙酸(及乙酸合成通路)在两组中均有所增加,而丁酸(及丁酸合成通路)只在W组中显著增加,相应的,干预后W组的GLP-1及PYY的增加也显著高于U组。同时,高膳食纤维的摄入增加了餐后的胰岛素分泌。上述结果共同提示,短链脂肪酸驱动了胃肠道激素及胰岛素对血糖的调节。
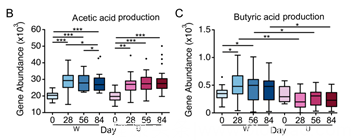
短链脂肪酸(乙酸和丁酸)合成通路的变化情况
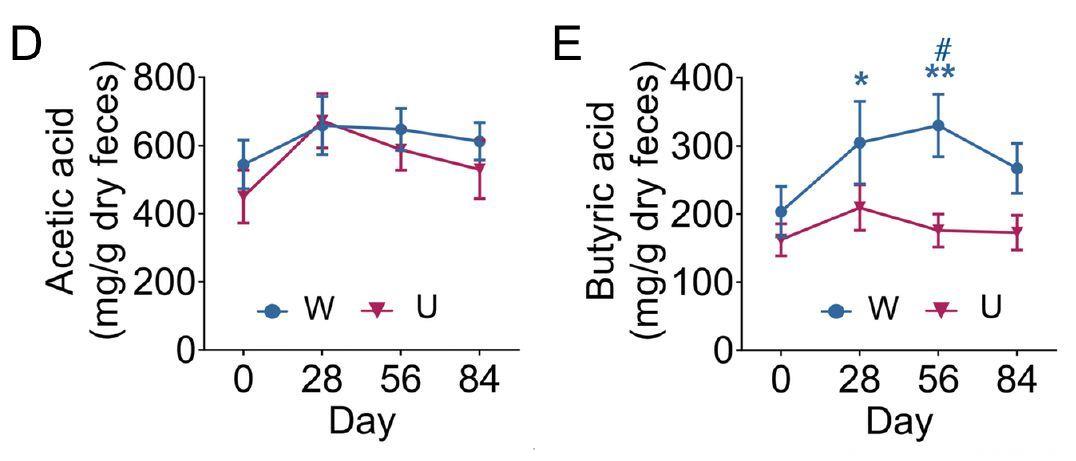
短链脂肪酸(乙酸和丁酸)的变化情况
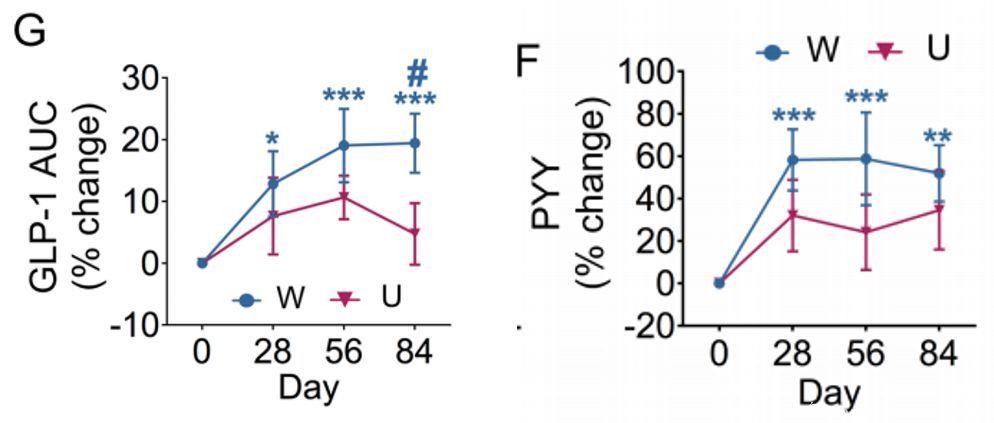
GLP-1及PYY的变化情况
4
精确“钓”出15株缓解2型糖尿病的细菌
那么,到底是哪些细菌对膳食干预作出了响应呢?
经过一系列分析后,79个菌株在高膳食纤维饮食后没有变化,47个发生显著降低,而还有15个菌株被富集,并在28天时达到最大。
这15个菌株主要来源于三个门,在W组,15个菌株均可产生乙酸,其中5个还能产生丁酸;而在U组,15个菌株中仅有3个可产生乙酸的菌株显著增加,提示这15个菌株是高膳食纤维改善代谢的主要贡献者。
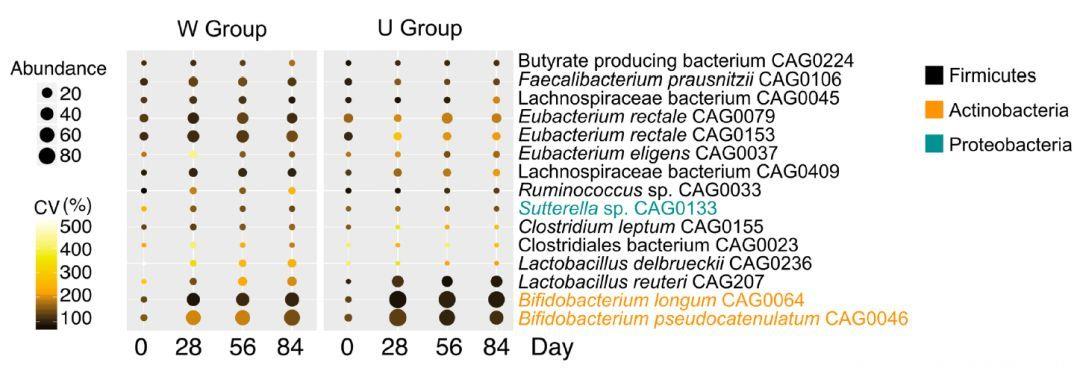
15株短链脂肪酸产生菌的丰度变化
在这15个菌株被大量富集的过程中,人体的肠道环境也被不断改造,肠道pH值降低,丁酸盐水平增加,15个菌株竞争性地抑制了其他“有害菌”减少了有害代谢产物(例如吲哚、硫化氢)的产生,从而构建了更加健康的肠道。
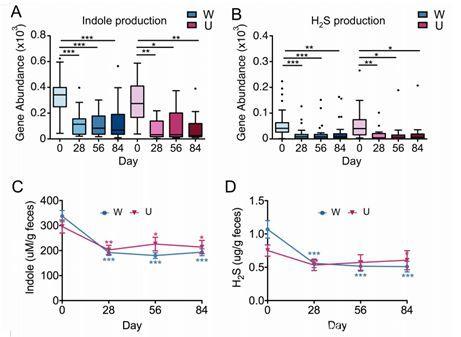
患者粪便中的吲哚及硫化氢在干预后显著减少
进一步分析高膳食纤维富集的15个菌株与临床指标的关联,发现在W组中有7个被富集的菌株与至少一个临床指标显著相关。
而选取Bifidobacterium pseudocatenulatum(假链状双歧杆菌)C95株接种至高脂饮食小鼠体内,显著改善了小鼠的体重、体脂、血糖等指标。
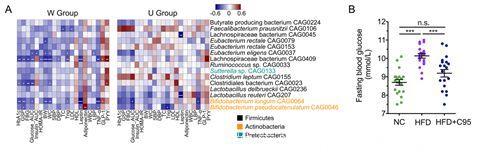
高膳食纤维富集的短链脂肪酸产生菌与临床指标的关联
5
被“钓”出的细菌形成功能群以守护肠道健康
肠道作为一个“生态系统”,这15个菌株组成的菌群就好像是肠道生态系统的“守护者”。那么,作为这样一个功能群,是如何影响宿主健康的呢?
根据上述15个高膳食纤维富集的短链脂肪酸产生菌的丰度和多样性,计算了活跃短链脂肪酸产生菌指数(ASP指数):ASP指数在干预过程中,W组始终高于U组,对应了W组更多的临床收益。
干预后28天,ASP指数升至顶峰并在后续干预中保持一致,而糖化血红蛋白却在干预中持续下降。
上述结果提示:肠道菌群快速响应高膳食纤维信号,导致的代谢产物变化使得宿主代谢在随后发生变化。这样的时序差异不仅仅意味着膳食纤维改变的肠道菌群是宿主代谢改善的主要原因,而且提供了以肠道菌群为早期靶点预测饮食干预效果的可能。
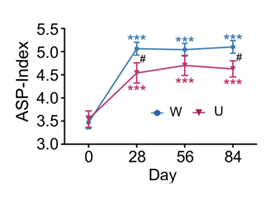
干预过程中的ASP指数变化情况
这项研究为通过膳食纤维改善肠道菌群结构来改善2型糖尿病提供了有力证据,也为靶向肠道菌群以干预其他疾病的研究提供了重要参考。
(论文介绍完)
赵立平教授专访
热心肠团队:您多年来一直致力于肠道菌群与人类疾病的研究,可否介绍一下您和团队在过去十几年的研究历程中的关键性成果?这些积累是否帮助成就了这篇《Science》文章?
赵立平教授:我们从2004年开始发表第一篇研究肠道菌群的SCI收录的论文,到这篇Science,已经发表超过70篇。用“俗套”的发文期刊的影响因子来看,第一篇是发在《微生物学方法杂志》,影响因子只有1.5。这些年下来,影响因子10分左右的或以上的,只有十来篇。
但无论文章不管大小,每一篇都有所创新,也都不“人云亦云”。如果说有什么特别之处的话,第一,我们强调菌株水平的研究,努力追求能做菌株水平分析的方法;第二,我们注重菌株之间的生态学关系,不注重分类地位的相近性;第三,我们努力遵循科赫法则解析因果关系。
的确,这次发表的所谓高影响因子的论文,是十几年创新积累的结果,不是什么意外的“运气”。
热心肠团队:发表一篇高影响力的文章,肯定不是一蹴而就的,可否请您简要介绍一下在研究过程中,是否有一些值得分享的故事呢?对团队成员您有何介绍和评价?
赵立平教授:从2007年到现在,我们一共有6篇论文在Nature/Science杂志被送外审,但最终只有这一篇得以发表,其他都被拒稿的。因此,用“十年磨一剑”来形容恐怕也不过分。
而这次发表的工作,从开始筹划,到完成现场试验和样品分析,到分析数据和写作,到投稿和发表,也用了整整6年的时间。
我们的团队以及合作单位的同事们都非常地努力和团结。彭永德主任和张晨虹博士作为共同通讯作者,为研究的完成和论文的发表发挥了举足轻重的作用。每一位作者的贡献都是不可或缺的。

共同通讯作者彭永德主任

共同通讯作者张晨虹博士
热心肠团队:这篇文章中通过合适的膳食干预改善2型糖尿病患者的代谢情况,那么,这些成果离转化还有多远呢?您和团队未来会拓展哪些转化研发工作?
赵立平教授:这次发表的是“机制性临床研究”,里面用到的营养干预方法具有应用前景。接下来,需要在国际范围内开展多中心临床试验,收集足够的临床证据,最终应该将膳食纤维改变菌群改善糖尿病的内容写进“糖尿病临床防治指南”中。
我们会和合作企业一道,与临床医院和公共卫生机构等合作,扎扎实实遵循科学规律,努力推进成果的产业化,为病人造福。
热心肠团队:在论文中,您提到了一个肠道“生态系统”的概念,在“生态系统”当中,也存在着很多类型的“生态系统服务提供者”,那么,往往在过程中,不是单一的微生物进行或者发挥作用,请问如何更好的解析或者解释这个现象呢?向完全没有生命科学背景的普通读者科普相关概念,您有什么好的建议吗?
赵立平教授:这次发表的工作,一个最重要的亮点,就是通过试验证实了肠道菌群中存在生态功能群(Guild)。“Guild”本来是指中世纪欧洲各地商人组织的“商会”或者“行会”,后来被生态学借用,来指一个生态系统里面“抱团取暖”的一组成员。
其实,在一个复杂生态系统里面,成员之间都不是相互独立,互不相干的。相反,成员之间会“拉帮结伙”,共同适应新的环境或者利用新的资源来生长。总之,“抱团”以后有利于成员的生存和发展。我们这次发现的能够充分利用大量多样化的膳食纤维生长的有益菌就可以看作是一个“生态功能群”。
生态系统能够给人带来的每一项益处可以看作是一个“生态系统服务”。而这些重要的“生态功能群”就是重要的“生态系统服务的提供者”,对维护人体健康非常重要。
热心肠团队:您和团队在研究中充分利用了组学等技术分析了饮食干预造成的菌群变化,并因此验证了特定干预方法可造福于2型糖尿病患者。在研究中也可以看到明显的组内个体化差异,您如何看待这些差异?未来对糖尿病等慢性疾病的干预,是否需要利用先进的检测技术进行个体化设计?您如何评价目前炙手可热的个体化营养(精准营养)?
赵立平教授:这种与膳食纤维改善糖尿病有关的细菌构成的生态功能群在每个人肠道里的丰度和多样性是有差异的,会影响每个人对营养干预措施的反应和最终临床指标的改善效果。未来的糖尿病等慢性病的营养干预应该会走向“靶向性”和“个性化”。
精准营养的核心是要有“分子靶标”,通过精确检测进行精准调控,才能实现精准营养。
热心肠团队:肠道特别是肠道菌群领域是一个多学科充分交叉和融合的领域,您和团队的研究也充分展示了交叉的魅力,您最看好这个领域哪些专业背景的团队、哪些技术的交叉?
赵立平教授:我们的研究涉及到了很多学科,是微生物生态学、内分泌代谢学、食品与营养学、元基因组学、中医学等学科的知识和技术交叉和融合的结果。每一项微生物组相关的研究,都需要组建自己的多学科交叉的队伍。
热心肠团队:作为即将于今年5月在北京召开的中国肠道大会的名誉主席,您对这个大会有何期待?您会向参会者分享什么内容?
赵立平教授:我相信这次大会会成为中国临床微生物组研究领域的一次盛会。我希望能跟大家分享这次Science发表的结果。
(专访内容完)
写在最后

2012年6月8日,《科学》杂志曾经以“My microbiome and me(我的微生物组和我)”为标题,报道了赵立平教授和团队所做的菌群研究和减肥故事。
彼时,人类微生物组计划(HMP)和人体肠道元基因组计划(MetaHIT)刚刚结束,肠道菌群研究刚刚开始进入火热阶段。很多人还在观望、质疑甚至否定,全心投入的团队并不多,但赵立平教授和团队在那时已完成多个重要研究,在国际上获得了同行的广泛关注和认可。
也就是在彼时,如赵立平教授在上面的专访中所说,他和团队开始了今天发表的这项研究的设计和落地执行,直到今天,成果落地。
6年前,赵立平教授和家人的照片登在了《科学》上,这很破天荒;6年后,赵立平教授和团队的论文登在了《科学》上,这更令人振奋!
相隔6年的两篇《科学》文章,见证了赵立平教授和团队的努力和成功,也见证了中国科学家在世界生命科学研究领域的进取与创新。
这是最美好的时代,是属于像赵立平教授一样有远见、有能力的坚持不懈的创新者的时代!
再次祝贺赵立平教授和团队!期待更多中国团队带给我们新的惊喜。
(全文完)