JAMA 子刊研究:心率每增加5次/分,死亡风险增加13%!
看来,在临床实践中我们应多关注心率的变化。
作者丨戴允浪
来源丨医学界心血管频道
在心血管疾病患者或者普通人群中,静息心率是不良事件的预测因素[1,2],且在心衰患者中,通过降低静息心率能够改善预后[3]。最近来自JAMA子刊(Cardiology)的社区队列研究证实了心率和心率的时间变化能够预测远期的全因死亡和心血管事件[4],下面就让我们来看一看这个研究。
JAMA子刊(Cardiology)发布这项研究
这个研究纳入了美国四个社区15680名居民,在1987至1998年之间进行了四次随访调查,平均随访间期为3.0年,调查内容是对心血管疾病危险因素的标准评估。最后的随访直到2014年底,相当于28年的随访时间。
研究中的心率数据来自于每次随访时12导联心电图,在这个研究中,研究者定义了两个变量:更新HR值(time-updated HR,缩写为uHR)代表在事件发生前或者下次随访前的最新HR值;△HR(change in HR)表示心率的时间变化,由uHR值减去前一次随访的HR值得来。此次研究探究了基础静息HR值(首次随访HR值)、uHR值以及△HR和终点事件间的相关性,而终点包括全因死亡、心衰事件、心肌梗死事件、脑卒中以及心血管原因死亡和非心血管原因死亡。
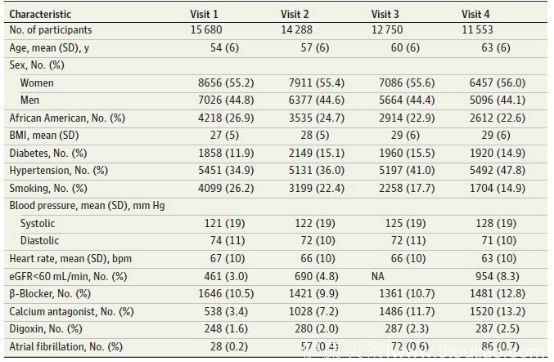
参与居民的基线特征方面,首次随访调查时平均年龄为54岁,女性比例为55.2%,非裔大约占了1/4,高血压及糖尿病的患病比例分别为34.9%和11.9%,平均心率为67 次/分,有大概15%的居民使用了影响心率的药物,随后的三次随访的情况见表1。
表1 参与居民随访调查的临床特征
在28年的随访时间中,共有6467名居民死亡,死亡原因中心血管死亡、非心血管死亡及癌症死亡人数分别为1685、4782及1463名,心力衰竭,心肌梗死、脑卒中的事件数分别为2939、1921及1359次。在多因素校正后,△HR每增加5 次/分(以△HR=0作为参照)全因死亡率增加13%(95%CI,10%-15%)、心力衰竭事件增加13%(95%CI,9%-16%),此外心肌梗死事件、脑卒中事件、心血管死亡、非心血管死亡及癌症死亡也同样增加(见表2)。
表2 心率有关变量和预后的相关性
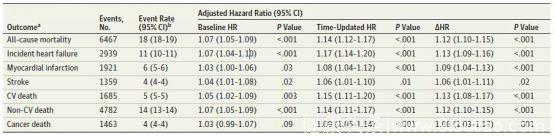
注:校正的因素包括性别、种族、更新的年龄、糖尿病、BMI、eGFR、收缩压、脉压、房颤、更新的β受体/地高辛/抗心绞痛/抗高血压/抗心律失常药物使用情况、基线时工作时的活动水平、业余时间的运动量、基线酒精摄入量以及吸烟状态。
而且,△HR的变化和全因死亡之间的关系是线性相关的(见图1和2)。同样uHR每增加5 次/分(以HR=60 次/分作为参照)全因死亡和心衰事件发生分别增加14%(95%CI,12%-17%)和17%(95%CI,13%-20%),基线HR和预后的相关性要弱一些(见表2)。
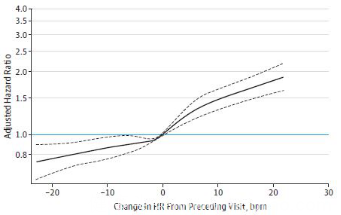
图1 △HR和全因死亡率
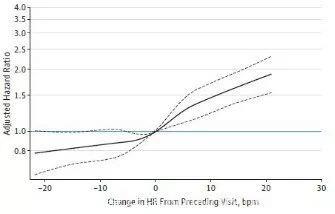
图2 △HR和心衰事件
在校正的限制性立方样条模型(restricted cubic spline models)中,uHR在50-60 次/分之间(以uHR=60 次/分作为参照)的死亡率和心衰事件发生较低,而在60-66次/分之间uHR值和全因死亡无相关性,但是仍和心衰事件相关(见图3和4)。研究还发现在β受体阻滞剂的居民中,△HR及uHR和全因死亡的相关性消失,但是糖尿病、吸烟与种族不影响这种相关性。
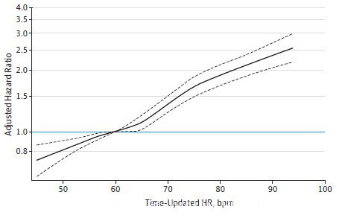
图3 uHR和全因死亡率
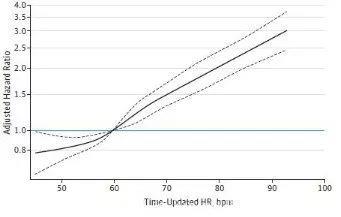
图4 uHR和心衰事件
相比于既往研究,此次研究使用了uHR这种新的概念,探究了多次随访间心率变化和远期预后之间的相关性,不仅证实了uHR及△HR和不良预后有关,而且发现随访期间心率的下降和不良事件减少相关。本研究显示在社区队列研究中,uHR、△HR和全因死亡以及心衰、心肌梗死和脑卒中事件发生显著相关。
临床实际工作中,很多能够降低心率的药物在广泛使用,下面做一简单介绍:
- β受体阻滞剂通过拮抗交感神经系统减低心率,在心血管疾病领域有着多种适应症,特别是在窦性心律的射血分数减低型心力衰竭患者中可以降低34%的死亡率[5]。
- 伊伐布雷定通过阻滞窦房结If电流减低心率,在临床上主要应用于应用传统标准化心衰药物治疗后LVEF≤35%、窦性心律且静息心率≥70 次/分的心力衰竭患者,可以降低18%的临床符合终点事件[3]。
- 地高辛作为最古老的应用于心力衰竭的药物通过阻滞钠钾ATP酶减低心率、增加心脏收缩力且能发挥有益的神经内分泌效应,然而在临床研究中并没有带来全因死亡率的降低[6]。
- 非二氢吡啶类钙离子通道阻滞剂通过延长心肌动作电位中钙依赖的平台期降低心率,然而在心力衰竭患者中这类药物是有害的[5]。
- 胺碘酮作为第III类抗心律失常药物通过阻滞多种离子通道减缓窦房结电活动及传导来降低心率,其在心力衰竭领域研究中基本是中性的结果甚至是有害的[7]。
- 决奈达隆作为胺碘酮样的抗心律失常药物也通过多种机制降低心率,其已被证实在心力衰竭治疗中的有害性[8]。
参考文献:
1.Fox K, Borer JS, Camm AJ, et al. Resting heart rate in cardiovascular disease. Journal of the American College of Cardiology 2007;50:823-30.
2.Palatini P, Julius S. Elevated heart rate: a major risk factor for cardiovascular disease. Clinical and experimental hypertension (New York, NY : 1993) 2004;26:637-44.
3.Swedberg K, Komajda M, Bohm M, et al. Ivabradine and outcomes in chronic heart failure (SHIFT): a randomised placebo-controlled study. Lancet (London, England) 2010;376:875-85.
4.Vazir A, Claggett B, Cheng S, et al. Association of Resting Heart Rate and Temporal Changes in Heart Rate With Outcomes in Participants of the Atherosclerosis Risk in Communities Study. JAMA cardiology 2018.
5.McMurray JJ, Adamopoulos S, Anker SD, et al. ESC guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC. European journal of heart failure 2012;14:803-69.
6.The effect of digoxin on mortality and morbidity in patients with heart failure. The New England journal of medicine 1997;336:525-33.
7.Bardy GH, Lee KL, Mark DB, et al. Amiodarone or an implantable cardioverter-defibrillator for congestive heart failure. The New England journal of medicine 2005;352:225-37.
8.Kober L, Torp-Pedersen C, McMurray JJ, et al. Increased mortality after dronedarone therapy for severe heart failure. The New England journal of medicine 2008;358:2678-87.