危重病营养的生物标志物
 1 摘要 营养支持目标是提供满足患者能量需求所需的基质,并保持机体体重、器官功能和免疫力所需大分子的净合成。 一些观察性研究已经揭示了危重患者营养不良普遍与不良临床预后相关。 最直观假设是优化营养输送可改善ICU期间的临床预后。 多个大型随机对照试验未能证明最大化营养摄入的临床益处; 可能是由于缺乏来识别最有可能从营养干预中获益患者以及监测营养支持效果的生物标记。 本文讨论了危重病营养实用风险分层工具,提出了生物标志物开发的基本原理以及识别和验证的方法。
1 摘要 营养支持目标是提供满足患者能量需求所需的基质,并保持机体体重、器官功能和免疫力所需大分子的净合成。 一些观察性研究已经揭示了危重患者营养不良普遍与不良临床预后相关。 最直观假设是优化营养输送可改善ICU期间的临床预后。 多个大型随机对照试验未能证明最大化营养摄入的临床益处; 可能是由于缺乏来识别最有可能从营养干预中获益患者以及监测营养支持效果的生物标记。 本文讨论了危重病营养实用风险分层工具,提出了生物标志物开发的基本原理以及识别和验证的方法。 2 背景 营养物质输送及其在合成代谢中的应用被认为在危重病病程中起着关键作用。对儿童和成人观察性研究表明,能量和蛋白质缺乏与并发症和死亡率增加密切相关;与代谢易损相关因素(如快速减肥)可以确定哪些患者在最佳营养支持中受益最大。推荐肠内或肠外营养来大量补充营养,尤其是被认为限制蛋白质分解代谢。研究设计缺点在于没有考虑到治疗效果的异质性(HTE)偏差。异质性可能源于个体之间疾病严重程度和预后差异。受试者终点不同,RCT可能无法检测到干预效果,这在重症监护室营养随机对照试验中成为问题;异质性也可能源于个体对营养支持干预反应差异。机制可能包括阻止有益代谢(如合成代谢抵抗),或逆转原本对营养限制有益的适应性反应(如自噬)。人们对营养素剂量、时间和给药途径之间的复杂相互作用知之甚少,因此需要一种更精确的方法来设计危重病营养的随机对照试验。本文提供使用生物标记来解决这些基本原理,对当前技术进行总结、对其未来发展表示看法。 3 危重病营养对生物标志物的需求 生物标志物(见表1)可作为临床决策或临床试验诊断或预后风险分层的工具。理想情况下,其反映疾病发病机制和治疗反应的生物学机制。预后标志物在临床试验中可用于识别高风险患者。一项针对高营养风险(即低或高体重指数、虚弱、营养不良、机械通气)的危重患者高剂量与低剂量蛋白质对照试验(EFFORT;NCT03160547)正在进行。预测性生物标志物反映了个体对干预反应的异质性。在危重患者中,蛋白质生物标志物组被确定为最有可能受益于呼气末正压通气PEEP或保守液体策略的成人呼吸窘迫综合征患者。生物标志物可类似地预测营养支持时代谢反应大小、动力学和异质性,从而解决营养支持期间使用剂量、时间和营养底物等问题。在重症监护室中,不同的生物过程可以解释为什么患者对营养干预有不同反应(即代谢异质性)。危重患者中采用新的以患者为中心的代谢支持方法、代谢反应阶段已被很好地记录;不同个体患者这些阶段在程度和时间上可能不同。肠道细菌、肠道吸收、组织利用以及细胞适应过程的改变都会改变营养的可获得性或利用率。变异的其他来源包括疾病易感性和代谢异质性、遗传或表观遗传驱动因素以及疾病潜在病因和器官功能障碍严重性。4 危重病营养生物标志物:当前技术水平 为了更好地界定营养风险、代谢异质性以及评估营养干预措施有效性开发了许多评估工具。由于器官功能障碍是危重患者临床预后的主要预测因素,我们在此重点关注最有可能反映器官或全身营养代谢反应的生物标志物(表2)。基线风险分层工具Heyland等开发的危重病营养风险预测评分包括炎症细胞因子白细胞介素-6 (IL-6)、合并症和疾病严重程度相关衍生参数,可用于大样本研究以满足可能存活患者的热量或蛋白质需求。TOP-UP试验可能适用于前瞻性研究,但在最近另一项RCT研究中没有发现类似或者与之不同的结果。代谢生物标志物蛋白质合成和分解指标是目前反映全身营养吸收和代谢的最佳指标。在非重症监护室中,通过输注稳定同位素示踪、评估“全身蛋白质平衡”是营养或其他干预(如胰岛素治疗)代谢反应的生理指标。在危重患者中,蛋白质平衡通过能量摄入而增加,并且开始肠内喂养促进了合成代谢;这使得它作为大型随机对照试验的临床生物标志物既昂贵又不实用,在儿童人群研究中也受到限制。与全身蛋白质平衡相反,氮平衡是计算蛋白质合成和分解之间的净差异。氮平衡已被用于确定健康受试者的膳食蛋白质需求,但在重症成人和儿童中结论不佳。可变因素包括全身水变化以及尿中和尿外氮的损失。全身蛋白质、氮平衡或身体组成变化可能有助于监测一般人群代谢反应,但其与重症监护室临床预后关系却研究较少。营养状况、底物可利用性和其他代谢标记如白蛋白、前白蛋白、视网膜结合蛋白、甲状腺素运载蛋白和转铁蛋白水平不会因营养干预而急剧改变,也不能准确预测临床预后。 系统性炎症标志营养支持理论的假设之一:逆转分解代谢可以减轻炎症、促进组织再生影响预后。如逆转骨骼肌分解代谢也可防止危重病期间肌肉萎缩、有利于预后。一项对重症监护室营养随机对照调查研究发现,炎症介质作为营养干预潜在的标志可对其进行预先的计划与评估。对于外源性营养如何影响危重病期间组织损伤或修复的研究很少,对全身炎症和器官损伤生物标志物研究比较透彻,如氧化和亚硝化应激、补体激活、炎症和器官功能障碍标志物。炎症单参数(如VAP中性粒细胞计数)或多参数(如急性呼吸窘迫综合征的细胞因子组)测量可作为预后标志物,但尚未有研究其预测重症监护室患者营养反应或代谢异质性的能力。在非重症监护室人群中研究表明,全身性炎症标志物可以考虑作为预测因子。在接受心脏手术患者中,补充氨基酸减弱了白细胞介素-6和肿瘤坏死因子-α的旁路相关诱导。白细胞介素-6水平升高有利于重症监护室营养干预,但其作为监测或分层工具预期用途暂无深入研究。随着时间推移,炎症标志物的系列测量可能有助于确定营养干预的时机和确定受益者。目前生物标志物(表2)一方面难以广泛应用,另一方面为不能完全反映营养干预易感性或生理反应生物学机制的预测价值,还没有在临床试验中被用作预后或预测工具。单一标志物(如白细胞介素-6、降钙素原)未能在评估其他ICU相关危重症(如败血症或急性呼吸窘迫综合征)的随机对照试验中提供院前评估、预后分类;需要能更好地监测营养风险和代谢异质性相关的生物学机制替代。 开发有效营养生物标志物与基于假设的单一标志物不同,非目标多维方法更好地反映已知和未知生物机制。按病理生物学机制分类,可根据患者对利益结果的风险(预后强化)或干预反应性(预测强化)对患者进行分类。这些非目标性的方法可以指导我们对调节细胞营养感知和驱动代谢、炎症和危重患者修复的基本机制的理解。 5 对营养限制(饥饿)和补充(喂养)的生物反映 器官功能障碍的危重患者在入住重症监护室时呈分解代谢。这是由病理生理学因素(如全身炎症、应激激素)以及重症监护室入院前后的营养限制造成的。危急疾病的代谢适应是指,细胞对营养限制的适应可以迅速发生,并由感知合成代谢底物或细胞能量水平的蛋白质介导。蛋白激酶“雷帕霉素的机械靶点”(mTOR)协调一个信号中枢,该信号中枢将营养或能量可用性(如氨基酸)与细胞对营养限制的适应(如自噬)、基因表达和表观遗传机制联系起来,预测细胞功能的长期变化。转运蛋白或细胞内受体可以结合或转运单一必需氨基酸(如亮氨酸),这些氨基酸以药理学方式控制mTOR合成代谢活性。这些反应的异质性可能源于遗传变异或可能导致生物能量学和代谢持续失调的长期表观遗传变化。其他相关的细胞营养和能量传感器包括GCN2和LKB1/ AMPK途径,其能感知代谢应激和控制适应性生物能量反应。营养相关代谢反应的范围和群体动力学异质性只能通过详细的多维分析及其随时间的重复测量来定义,可以做一些关于生物标记发展的假设。第一,组织对代谢压力反应不同,它们对营养有效性的反应也可能不同。从骨骼肌中动员氨基酸所需的深度蛋白质分解代谢和萎缩可能是一种适应性机制,以支持严重疾病期间所需的其他基本功能(如免疫)。第二,在危重病期间观察到的细胞代谢失调可能会破坏利用营养素来生产三磷酸腺苷或合成蛋白质,不及时输送营养素可能会抑制适应性反应。第三,介导能量和底物可用性、感知和代谢反应的机制的遗传和表观遗传变异可以解释主体间的变异性。第四,营养限制或全身炎症可能诱发表观遗传反应,导致代谢的持续改变,而营养支持不能立即克服这种改变。随着时间的推移,对患者变化的详细描述将对营养有效性反应的范围和异质性,以及开始或停止营养支持的最佳时机提供重要意见。时间敏感因素包括合成代谢抗性、微生物多样性、器官功能障碍和内分泌应激反应。细胞内代谢传感途径的几个特征使它们有可能成为有用的生物标志物,其表现出药理学配体/受体特性和剂量反应特性。营养传感机制也介导重要的器官特异性功能,包括骨骼肌分解代谢和免疫功能障碍,可以被测量并作为替代结果。代谢的细胞内传感器控制代谢变化,响应系统炎症或营养物质的可用性。酶活性、翻译后修饰或细胞内蛋白质水平的评估在临床环境中是不切实,并且表现出不理想的动态范围和再现性。Stoppe等人对患者营养感应(如基因表达模式)引发的生物效应机制的多重分析而言,该样本易于获得且风险较低,可潜在地用作临床试验护理点。 6 危重病营养中生物标志物发展的多维方法基本原理 与单一分析物不同,多维标记更有可能描绘与干预和目标结果相关的生物信号网络,或定义营养反应(图1)。替代生物标志物的预测能力由被测分析物介导治疗效果比例决定。如果生物标志物是对干预反应和临床预后的生物介质,它将表现出高治疗效果比(PTE)。作为一种替代生物标志物,在检测适当抗生素对死亡率影响时,血液中肺炎链球菌的检测及其随后的根除将显示出高的PTE。一维标记没有捕捉到危重疾病的生物学复杂性,也没有有效地对预后组进行分类。在一个随机对照试验中,分别使用了内分泌刺激试验和白介素-6作为潜在的预后分类器,但未成功。相比之下,多重检测或生物标记组类似于条形码,可以根据预测治疗或预后效果的生物因素更有效地将患者分为亚组(图1c),但不清楚这些工具对治疗干预的监测效果如何。因为测序技术的进步,对脱氧核糖核酸或核糖核酸序列的详细注释,以及包括机器学习方法在内的生物信息学工具的发展,使得多维生物标志物的研究越来越多。在临床环境中使用整体“组学”分析的元数据可以减少,以构建显示高PTE和捕获患者异质性的生物标志物组。非靶向方法也提供了价值,揭示了以前未知的疾病机制,可以为新疗法的发展提供信息。结合遗传、转录组学和表观基因组学分析揭示了响应微生物产物而驱动炎症的代谢途径,以及可持续改变炎症的代谢驱动表观遗传机制。这些长期的表观遗传修饰可能导致免疫或代谢功能障碍,从而可能对危重患者营养剂量和时机有影响。 7 危重病营养中生物标志物鉴定的分析 本文认为最有希望的检测方法是容易获得的组织或液体中的营养可用性和代谢相关的检测方法,以及利用快速适应临床环境的技术的检测方法(表3)。 DNA测序现代技术可以检测个体受试者所有基因序列,得出与营养支持代谢反应可能性相关的内型。脱氧核糖核酸很容易从临床样本中获得,并且可以通过扩增分析进行查询。基因组变异可能有助于理解易感性或预后,但其静态的,不能反映组织特异性变化或治疗反应。由于环境因素严重影响危重病的干预和预后,遗传变异往往在治疗效果中所占比例较低。生物标记候选物已经出现在其他危重疾病领域的基因组分析中。 评估基因水平和表观遗传修饰与基因组DNA相反,核糖核酸表达和表观基因组修饰是动态的,可以通过代谢或营养信号机制的改变而直接改变。危重病期间发生的细胞代谢变化可改变用于染色质修饰和选择性基因诱导或沉默的底物(如α-酮戊二酸、腺苷甲硫氨酸)和酶(如脱氧核糖核酸甲基化酶、组蛋白乙酰转移酶)的水平。RNA-seq是目前整个转录组的标准,而全基因组表观基因组评估技术现在才出现。一旦简化为生物标记组,从转录组和表观基因组元数据中获得的分析物可以在基于多重聚合酶链反应的组中进行测试。全血或外周血单核细胞基因水平的测量可以在临床环境和随机对照试验中实施。临床实验室或护理点测试提供了标准化的脱氧核糖核酸或核糖核酸测量技术。大多数表观基因组分析要么需要活细胞(如ATAC序列),要么需要大样本量(如亚硫酸氢盐测序),这表明目前它们的应用可能仅限于生物标志物鉴定阶段——基于核糖核酸的富集。 蛋白质组学和代谢组学分析尽管蛋白质组学和代谢组学分析是有前途的生物标志物开发工具,但是其注释和解释不如评估脱氧核糖核酸和核糖核酸的注释完善。允许在同一样本中评估大量蛋白质的新技术已经被用于在危重疾病中建立。在回顾性危重病队列中采用代谢组学方法确定预后指标,但尚未系统评估其前瞻性预测营养干预反应的能力。蛋白质和代谢物都可以在基于即时质谱的设备中进行测量。 微生物组通过16s微生物测序或宏基因组学评估的肠道微生物群多样性是另一个候选多维生物标志物,它在危重病期间显著改变,可通过营养摄入改变,并导致可能改变临床预后的适应性或病理生理学机制。如肠道和呼吸道微生物多样性与疾病的严重程度和死亡率呈负相关但需要更多的研究来探索营养支持时机、剂量和途径如何影响微生物多样性以及如何影响患者预后 8 设想 人们对评估骨骼肌或机体重量作为重症监护室幸存者对营养支持和功能结果反应的指标,其中包括可在床边使用便携式技术进行的成像模式,包括骨骼肌厚度的超声评估或无脂肪质量以及椎旁或肢体脂肪与肌肉比率的CT评估。一个设计良好的超声协议允许临床医生评估机械通气患者骨骼肌的定量和定性变化。正在进行的评估蛋白质营养和/或运动对危重患者功能恢复影响的临床试验结果尚未公布。除了床边方法之外,测量组织代谢物吸收和动力学的核成像技术(如用于癌症的2DG-正电子发射断层扫描)可能适于在器官或全身水平的营养限制或补充期间检测代谢底物摄取(例如,亮氨酸、苯丙氨酸)。对于危重患者来说,需要运送患者进行长时间成像的措施不太可能。 9 将生物标志物开发脑乳危重病营养研究 研究者和决策者概述了临床试验设计中生物标志物开发和采用的要求。就营养支持而言,挑战包括给药制剂的复杂性,以及需要更好地定义营养供应调节细胞和器官功能的生物机制。复杂的营养干预的药效学特性是可以测量的(例如,全身代谢,营养传感途径),并可用于开发生物标志物。越来越多的临床试验正在测试宏量和微量营养素的单独或有限混合物的免疫调节作用(如维生素C、ω-3)。前瞻性纵向队列研究询问临床数据和用于遗传和分子分析的库存样本,有助于识别候选生物标志物。在缺乏现有观察队列的情况下,第一期和第二期试验提供了一个环境,在这个环境中可以前瞻性地测量营养剂量和假定的生物标志物水平之间的关系,建立营养支持干预的药效学特性,或者更好地定义代谢异质性。生物标志物开发的有效方法及其在第二和第三阶段临床试验中的应用已经有研究发表。第二阶段研究的主要结果通常是可测量的疾病相关或对干预的生理反应(如蛋白质平衡),并在小样本中进行评估。二期试验可以进行适应性设计,其中生物标志物水平的中期分析可用于改变随机化比例,从而扩大患者的纳入。生物标志物将有助于创建核心结果集,这些结果集可用于综合危重病营养试验的研究 10 讨论 营养研究一直受到方法和实践挑战的困扰,这些挑战限制了我们从临床试验中得出有意义结论的能力。表4总结了当前的知识差距和潜在的解决方案。专家和监管者现在建议在试验设计的早期采用基于生物标记的富集工具,并将其纳入核心结果集。需要在营养随机对照试验中采用协作和标准化的生物标志物识别、验证和实施方法。多学科联盟将促进新生物标记技术的快速转化,背离当前“一刀切”的试验设计方法,开创重症监护营养领域精准医学的新时代。
 表1 一些名词的术语解释
表1 一些名词的术语解释  表2 营养相关的单维生物标记
表2 营养相关的单维生物标记 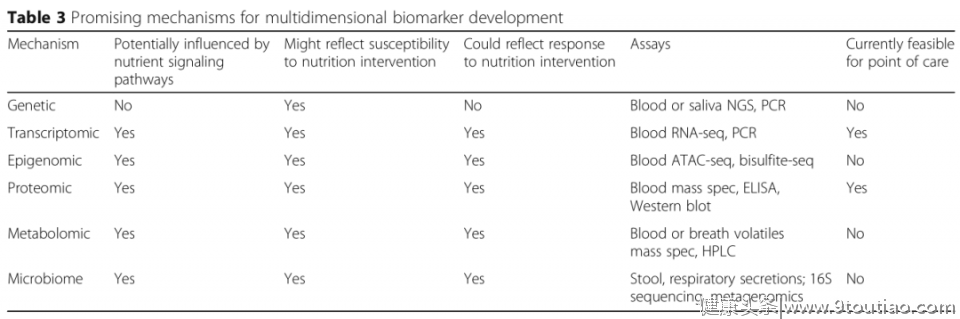 表3 多维生物标记物的发展前景
表3 多维生物标记物的发展前景 表4 危重护理营养生物标志物开发的当前挑战和潜在方法
表4 危重护理营养生物标志物开发的当前挑战和潜在方法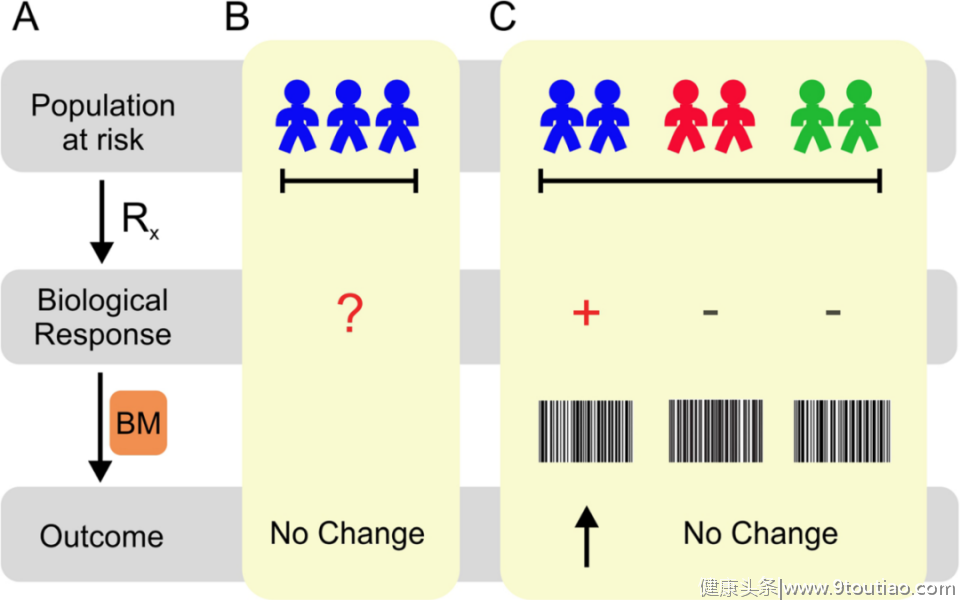 图1 与单维标记不同,多维标记更有可能描绘与干预和目标结果相关的生物信号网络 编译:曾迎楠Doi:10.1186/s13054-020-03208-7东风文献速递-浙大二院急诊医学科文献解读团队
图1 与单维标记不同,多维标记更有可能描绘与干预和目标结果相关的生物信号网络 编译:曾迎楠Doi:10.1186/s13054-020-03208-7东风文献速递-浙大二院急诊医学科文献解读团队本文转载自其他网站,不代表健康界观点和立场。如有内容和图片的著作权异议,请及时联系我们(邮箱:[email protected])