HIV相关认知障碍该如何管理?专家这样说!
*本文所涉及专业部分,仅供医学专业人士阅读参考

3月25日,中国艾滋病网络研讨会等你来。
在人类免疫缺陷病毒(也称艾滋病毒,HIV)流行的最初十年,因为缺少有效的治疗药物,很多HIV相关的疾病发生率也相当高,HIV相关痴呆症就是其中之一。当时的晚期HIV感染者中,HIV相关痴呆症的患病率约为15%,每年的发病率为7%[1]。不过随着抗反转录病毒治疗(ART)的出现,越来越多的患者能够得到较好的病毒抑制和免疫恢复,HIV相关的疾病在这些患者中也越来越少出现。
在无症状期,即有部分HIV感染者已经出现轻度的认知损害。即使实现了病毒学抑制,仍有患者会出现轻度的认知障碍。在延长寿命的同时,提高患者的生活质量也是非常重要的,因此近年来,除了病毒学抑制外,包括长期免疫恢复、患者自我报告的生活质量,以及神经精神健康等问题都逐渐受到重视。
在认知障碍这一领域,过去几十年,出现了很多研究方向,也带来了很多可讨论的问题,例如,用什么标准来定义HIV感染者的认知障碍?它和什么因素有关?如何筛查、诊断和管理这种认知障碍?
对此,我们特别邀请了北京大学第六医院的石川教授对这一领域的讨论进行了综合的梳理。
01HIV相关认知障碍判定标准的争论
为了弥补HAND标准的限制,目前也有一些其他的定义标准,按照这些标准,认知障碍的发生率明显要低很多,但它们还需要更多的临床验证。
表一:HIV相关认知障碍判定标准对照
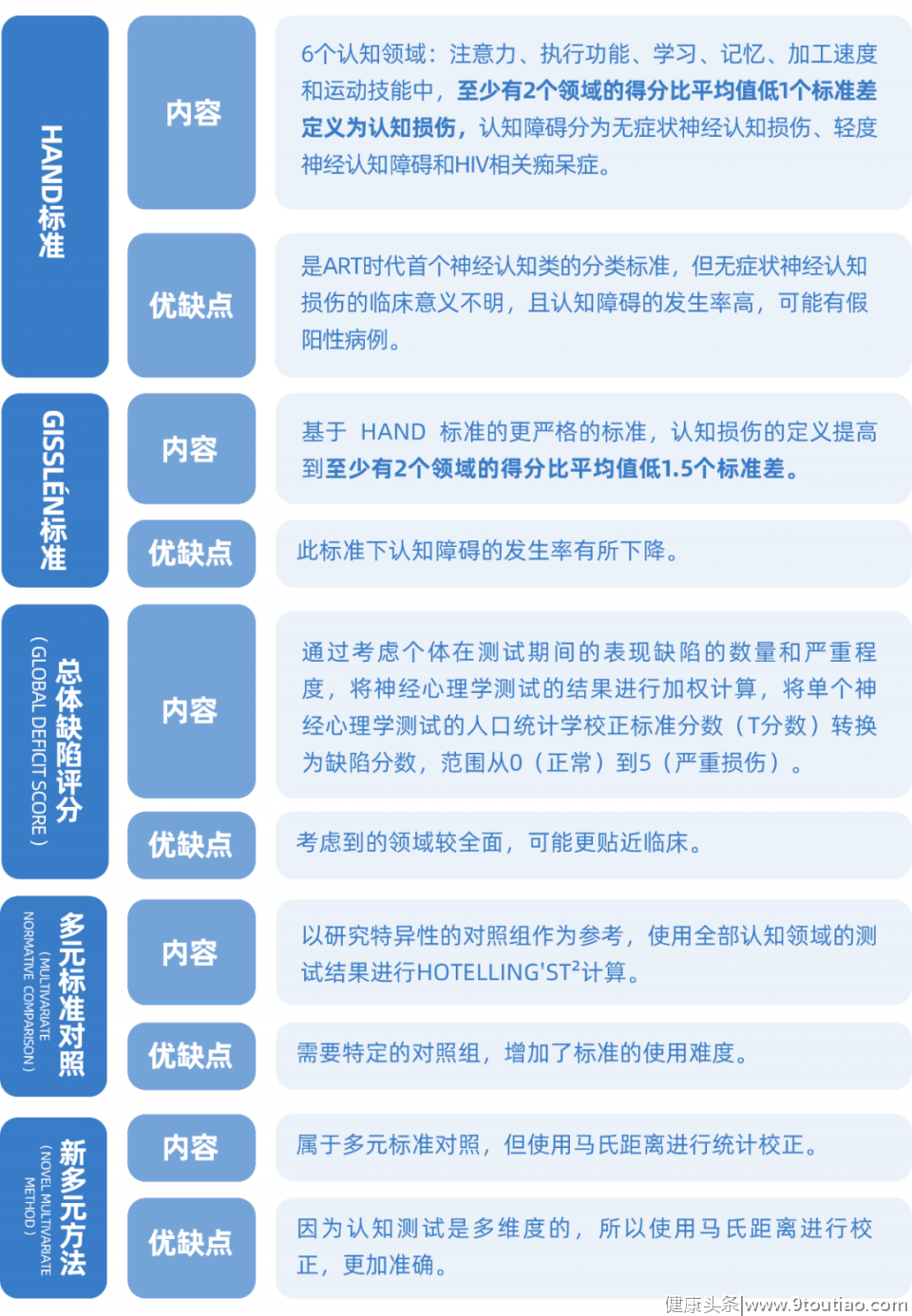
在这种背景下,显然,临床上对HIV相关认知障碍的诊断和筛查是比较困难的,既缺少“工具”,还有较多的干扰因素,像抑郁、焦虑、物质滥用和使用药物等多种疾病和生活方式都会对认知功能产生影响,难以判断患者的认知障碍是否与HIV相关。
02HIV相关认知障碍的潜在原因
对于HIV相关认知障碍的潜在原因有很多假设,包括HIV本身及其导致的炎症和并发症;HIV RNA逃逸;生活方式;老龄化;以及ART的毒性等。
在感染后,HIV可能会借助被感染的单核细胞和淋巴细胞穿过血脑屏障,进入大脑,一方面它们可能会直接侵袭大脑中的小胶质细胞等免疫细胞间接地通过糖蛋白gp120等蛋白引起持续性免疫反应,对神经元造成影响[4]。这些机制导致的神经元损伤可能无法通过ART得到逆转。虽然尽早开始ART可以将血浆中的HIV控制在无法检测的水平,但部分患者会出现比较罕见的脑脊液HIV RNA逃逸,即脑脊液中的HIV RNA水平处于可检测到的状态,或者高于血浆中的HIV RNA水平。
这可能与ART的耐药性、较低的CD4细胞计数和脑脊液中药物浓度不够有关,有研究发现,增效的蛋白酶抑制剂(PI)是脑脊液HIV RNA逃逸的重要危险因素[5]。不过需要注意的是,基于增效的PI的ART方案通常是感染了耐药病毒株的患者的换药备选方案,因此,究竟是药物还是耐药性导致的HIV RNA逃逸仍然需要研究来验证。除了HIV本身的影响外,HIV感染者中吸烟、酒精和药物滥用的比例较高,这些不良生活方式也可能通过神经中枢系统毒性影响认知功能。

图片来自pexel.com
整合酶抑制剂类药物也报告过一些神经精神方面的副作用,例如拉替拉韦(RAL)和多替拉韦(DTG)。尤其是DTG,在早期临床试验中,就有部分试验结果显示以DTG为基础的治疗方案神经精神相关不良事件的发生率略高于对照组,而之后的一些真实世界研究中更是出现了较高的由此类不良事件导致的停药率。
03HIV相关认知障碍的管理
虽然ART的毒性可能是HIV相关认知障碍原因之一,但是ART仍然是目前管理这类认知障碍的主要手段,因此,患者需要毒性更小、穿透血脑屏障能力更强的ART药物。
一项小型临床试验结果除了EVG/c/FTC/TAF,以FTC/TAF为基础的另一款药物比克替拉韦(BIC)/FTC/TAF可能也是一种潜在选择。虽然在两项III期临床试验[11,12]中,它的神经精神相关不良事件与以DTG为基础的疗法的发生率相似,但48周的患者报告结局研究[13]显示,接受BIC/FTC/TAF方案的患者疲劳、头晕、恶心和睡眠障碍等症状的发生率较DTG/ABC/3TC方案更低。图片来自pexel.com
HAND患者的治疗方案转换为CPE评分增加3分及以上,总评分达到9分及以上的药物组合后,第96周,总体缺陷评分(GDS)改善,HAND标准下的HIV相关痴呆症患者由2个减少到1个,轻度认知障碍患者由22个减少到8个。多变量分析显示,更换治疗方案后的GDS评分改善与方案总CPE评分≥9有关。
虽然有这些试验,但总体来说,通过干预措施来管理HIV相关认知障碍方面的高证据等级的研究较为缺乏,而其他一些辅助性治疗手段,包括钙离子通道抑制剂、抗氧化剂和肿瘤坏死因子-α抑制剂,以及乙酰胆碱酯酶抑制剂等等的试验均未取得好的效果。
因此,这类转换ART方案的策略是否真的能够在大规模的患者群体中改善认知障碍还是不确定的。除了这类策略外,研究人员也在探寻其他策略,例如,穿透血脑屏障能力更强的新药物或者改变给药方式,包括经鼻给药和纳米粒子递送药物等。
经鼻给药的优势在于简便,不需穿透血脑屏障,避免了肝首过效应和胃中的酶对药物的降解,而且由于鼻腔粘膜血管丰富,这种方式还可以提高药物的生物利用度,减少用药剂量。不过,经鼻给药的方式也存在一些挑战,例如高分子量药物的鼻腔粘膜渗透性低,药物在鼻腔中的降解和低剂量/体积给药的可行性。 纳米技术在药物递送中已经有很多研究,尤其是癌症药物,这种方式靶向性更强,也可以降低药物剂量和给药频率,减少药物脱靶的毒性。不过作为一种比较新的技术,纳米粒子在“卸载”药物后,留存在人体内的安全性一直存在争议,有研究认为它们可能会干扰正常的生理机制[17]。从这些讨论中可以看出,目前,在定义、理解和管理HIV感染者的认知功能障碍方面仍然存在不小的挑战。
我们可能需要形成共识的判断标准,了解不同风险因素对认知障碍的影响程度和是否可以通过干预手段来预防认知障碍,以及如何对患者进行综合管理,即,采取包括药物、心理健康、生活方式和社会支持在内的多维度手段,这些都需要更多的探索,才能进一步减少HIV相关认知障碍的发生、进展和对患者生活质量的不良影响。
相信以上讨论中提出的问题,大家在临床中也一定或多或少遇到过。HIV感染者的神经精神健康与HIV感染本身及ART都具有密不可分的关联,那么在长期的疾病管理中,应该如何诊断和处理呢?在3月25日的中国艾滋病网络研讨会中,我们将会就这些问题继续进行讨论,感兴趣的朋友请持续关注吉智医,不要错过这个难得的机会。
扫描二维码观看会议直播往期回顾中国艾滋病网络研讨会·聚集患者报告结局(PRO)
参考文献
[1] McArthur J C, Hoover D R, Bacellar H, et al. Dementia in AIDS patients: incidence and risk factors[J]. Neurology, 1993, 43(11): 2245-2245.
[2] Ferretti F, Mora-Peris B, Underwood J, et al. Cognitive impairment in a clinical setting[J]. JAIDS Journal of Acquired Immune Deficiency Syndromes, 2018, 77(1): e10-e13.
[3] Nightingale S, Winston A. Measuring and managing cognitive impairment in HIV[J]. Aids, 2017, 31: S165-S172.
[4] Valcour V, Sithinamsuwan P, Letendre S, et al. Pathogenesis of HIV in the central nervous system[J]. Current Hiv/aids Reports, 2011, 8(1): 54-61.
[5] Pérez-Valero I, Ellis R, Heaton R, et al. Cerebrospinal fluid viral escape in aviremic HIV-infected patients receiving antiretroviral therapy: prevalence, risk factors and neurocognitive effects[J]. Aids, 2019, 33(3): 475-481.
[6] Yang C X, Schon E, Obeidat M, et al. Accelerated Epigenetic Aging and Methylation Disruptions Occur in Human Immunodeficiency Virus Infection Prior to Antiretroviral Therapy[J]. The Journal of infectious diseases, 2020.
[7] Ciccarelli N, Fabbiani M, Di Giambenedetto S, et al. Efavirenz associated with cognitive disorders in otherwise asymptomatic HIV-infected patients[J]. Neurology, 2011, 76(16): 1403-1409.
[8] Hakkers C S, Arends J E, van den Berk G E, et al. Objective and subjective improvement of cognition after discontinuing efavirenz in asymptomatic patients: a randomized controlled trial[J]. JAIDS Journal of Acquired Immune Deficiency Syndromes, 2019, 80(1): e14-e22.
[9] Vera J H, Bracchi M, Alagaratnam J, et al. Improved central nervous system symptoms in people with HIV without objective neuropsychiatric complaints switching from efavirenz to rilpivirine containing cART[J]. Brain sciences, 2019, 9(8): 195.
[10] Perez Valero I, Cabello A, Ryan P, et al. Randomized Trial Evaluating the Neurotoxicity of Dolutegravir/Abacavir/Lamivudine and Its Reversibility After Switching to Elvitegravir/Cobicistat/Emtricitabine/Tenofovir Alafenamide: GESIDA 9016[C]//Open forum infectious diseases. US: Oxford University Press, 2020, 7(12): ofaa482.
[11] Gallant J, Lazzarin A, Mills A, et al. Bictegravir, emtricitabine, and tenofovir alafenamide versus dolutegravir, abacavir, and lamivudine for initial treatment of HIV-1 infection (GS-US-380-1489): a double-blind, multicentre, phase 3, randomised controlled non-inferiority trial[J]. The Lancet, 2017, 390(10107): 2063-2072.
[12] Sax P E, Pozniak A, Montes M L, et al. Coformulated bictegravir, emtricitabine, and tenofovir alafenamide versus dolutegravir with emtricitabine and tenofovir alafenamide, for initial treatment of HIV-1 infection (GS-US-380–1490): a randomised, double-blind, multicentre, phase 3, non-inferiority trial[J]. The Lancet, 2017, 390(10107): 2073-2082.
[13] Wohl D, Clarke A, Maggiolo F, et al. Patient-reported symptoms over 48 weeks among participants in randomized, double-blind, phase III non-inferiority trials of adults with HIV on co-formulated bictegravir, emtricitabine, and tenofovir alafenamide versus co-formulated abacavir, dolutegravir, and lamivudine[J]. The Patient-Patient-Centered Outcomes Research, 2018, 11(5): 561-573.
[14] Cysique L A, Vaida F, Letendre S, et al. Dynamics of cognitive change in impaired HIV-positive patients initiating antiretroviral therapy[J]. Neurology, 2009, 73(5): 342-348.
[15] Vassallo M, Durant J, Biscay V, et al. Can high central nervous system penetrating antiretroviral regimens protect against the onset of HIV-associated neurocognitive disorders?[J]. Aids, 2014, 28(4): 493-501.
[16] Force G, Ghout I, Ropers J, et al. Improvement of HIV-associated neurocognitive disorders after antiretroviral therapy intensification: the Neuro+ 3 study[J]. Journal of Antimicrobial Chemotherapy, 2021, 76(3): 743-752.
[17] Hossen S, Hossain M K, Basher M K, et al. Smart nanocarrier-based drug delivery systems for cancer therapy and toxicity studies: A review[J]. Journal of advanced research, 2019, 15: 1-18.

石川 教授
北大六院临床心理评估中心主任
中华医学会精神分裂症协作组副组长
国家卫健委疾控局驻武汉心理工作队队长
中国老年脑疾病分会常务委员
中华医学会精神医学分会第八届委员会委员
中国心身医学会心理评估委员会委员
中国医师协会精神医学分会精神康复工作委员会委员
北京医学会精神医学分会常委、秘书长
《中华精神科杂志》、《中国心理卫生杂志》和《中国生育健康杂志》编委, Journal of Affective Disorder, Schizophrenia Research审稿专家
主持和承担国家级、省部级科技攻关及国际合作课题13项,发表学术论文72篇, SCI收录49篇,主编主译著作3部,参编参译著作7部。

获取更多感染性疾病、肝炎及艾滋病等领域
最新文献、指南与前沿资讯
声明:本内容仅针对中国医疗卫生专业人士,旨在向且仅向医疗卫生专业人士提供科学信息,用于个人学习和参考之用。如果您不是医疗卫生专业人士,请勿参与或传播。