健忘=老年痴呆?老化与痴呆,两条截然之路

让我们一起认知健忘与老年痴呆的差别。
在社区进行痴呆筛查工作时,最常听老人说,“这两年记性越来越不行了,我是不是痴呆了?”也常有带着父母来测验的中年人,闲聊自己父母如何健忘的生活琐事,最后总以“他就是老年痴呆,没办法”作结。而我们谈及的老人,有的想要辩解却欲言又止,有的呵呵笑着聊表无奈,有的低头一言不发,眼睛也黯淡了下来。
从前我们对痴呆了解甚少。如今随着科技发展和知识普及,绝大部分老人(至少是城市老人)都或多或少知晓了痴呆,但也因此更加畏惧。很多人自觉健忘,便沉浸在恐惧中:我是不是痴呆了?我是不是要痴呆了?有时他们也会质疑:为什么我觉得我记忆力很差,你却还说我“认知正常”?
我们总强调痴呆的严重后果,却很少告诉老人们,其实正常健康的老化,也会伴随着记忆力等各类认知功能的衰退。这也许是因为不久之前,学界也还在争论:老化和痴呆(特别是老年痴呆),究竟是截然之路,还是殊途同归?
健忘绝非老年痴呆,记忆本会正常下降
痴呆(Dementia)是一类脑部疾病的统称,这类疾病通常会导致患者出现记忆退化、情绪问题、言语功能下降、行动能力降低和日常生活功能下降。痴呆包括很多类型,常见的比如阿尔茨海默病、血管性痴呆、路易体痴呆、额颞叶痴呆等等,不同类型的痴呆,致病机理和具体症状都不尽相同。我们常说的“老年痴呆症”或者“老年痴呆”,就是阿尔茨海默病(Alzheimer’s disease,AD),这是痴呆最常见的类型,占痴呆病例的70%-75%。
阿尔茨海默病是一种病情呈进行性的、随时间不断恶化的神经退行性疾病,通常发病十年左右,早期以明显的记忆下降为主,各类认知功能逐渐损伤,直到患者出现严重的精神症状和行为障碍,最终丧失日常生活能力。
作为一种进行性的神经退行性疾病,阿尔茨海默病的主要危险因素就是年龄。欧美国家一项调查发现,65岁以上老年人中阿尔茨海默病发病率为5%左右,在65岁之后,每过5年患病率增加一倍,85岁以上患病率达30%以上。正是由于阿尔茨海默病发病隐匿、发病率高、损伤记忆、无药可医等特点,导致人们谈“忘”色变。尤其那些切身感受到自己变得健忘了的老人们,便更觉惶恐,唯恐患病。
其实在临床工作中,神经科医生对阿尔茨海默病有较为统一的诊断标准。阿尔茨海默病患者除日常生活功能受损、健忘、难以记住新东西之外,言语功能、视空间功能、执行功能都有受损。除此之外,患者还需在临床影像上表现出特定的病理特征:脑内淀粉样蛋白斑块(老年斑)的沉积,颞叶和顶叶葡萄糖代谢的降低,内侧颞叶和内侧顶叶皮层的萎缩,磷酸化tau蛋白缠结物的增加和脑脊液中淀粉样蛋白含量增加等。这就是为什么神经科医生除了神经心理测验之外,往往还要求老人进行磁共振成像检查和正电子发射断层扫描检查,必要时还要通过腰穿检查抽取脑脊液,才能最终作出诊断。
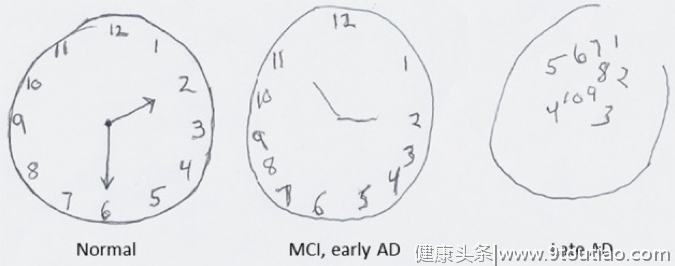
图1 正常老年人(左)、AD早期患者(中)、AD晚期患者(右)的画钟测验表现对比。
画钟测验(clock drawing test,CDT)是神经科常用的痴呆筛查测验,医生要求患者在纸上画一个钟表并标示出特定时间(比如2点30分),而阿尔茨海默病患者由于定向力下降,通常无法完成测验。

图2 健康人与阿尔茨海默病患者的脑萎缩、葡萄糖代谢、淀粉样蛋白斑块沉积、神经元纤维缠结、神经炎症和突触密度对比。
由此可见,健忘虽然是阿尔茨海默病的表现之一,但绝非是其唯一条件。大部分老人若只是感觉健忘、反应变慢、记忆力下降,很可能是正常老化所带来的认知功能正常衰退。毕竟在毕生发展中,除了一般经验(晶体智力)随龄积累之外,反应速度、执行功能、长时记忆等认知功能(流体智力)在25岁之后便开始下降,在55岁之后加速衰退,即便是健康老人,也难逃时间之掌 。
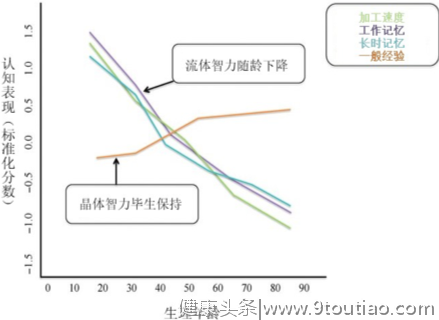
图3 认知功能随龄变化折线图。除了一般经验随龄增加之外,加工速度、工作记忆和长时记忆都在25岁之后逐渐下降,50岁后衰退至平均水平以下。
老化本身会导致各类认知功能的衰退,而老年痴呆的症状之一也是各类功能的退行。长久以来,老化和痴呆似近似远的关系也一直困扰着研究者们。
老年痴呆是加速老化?老化终将罹患痴呆?
1901年,德国精神病学家爱罗斯·阿尔茨海默(Alios Alzheimer)在法兰克福精神病院接诊了一位名叫奥古斯特·迪特(Frau Auguste Deter)的51岁女性,她几乎不能记住自己的生活细节,对于医生的问题经常给出语无伦次的答案。在她去世后,阿尔茨海默医生使用神经纤维银染法观察到她的脑部有大量淀粉样蛋白斑块(老年斑)病变和神经元纤维缠结。于是,这种早期症状为短期记忆丧失、难以记住最近发生的事,而后逐渐出现语言障碍、定向障碍、情绪不稳、无法自理等行为问题,并伴随大脑淀粉样蛋白斑块沉积和神经元纤维缠结的疾病就被命名为阿尔茨海默病。

图4 阿尔茨海默病患者脑内的淀粉样蛋白斑块(粉色)和神经元纤维缠结(黑色)。
阿尔茨海默病在早期是难以诊断的,患者起病早期的行为表现和正常老化者非常相似,都是注意力、记忆力、感知觉等认知功能的“退行”。有研究发现健康老年人在55岁之后脑内也会出现淀粉样蛋白斑块沉积和神经元纤维缠结,其中淀粉样蛋白斑块主要沉积于新皮层,神经元纤维缠结主要出现在内嗅皮层、边缘皮层和海马,这与阿尔茨海默病患者的病理表现十分相似。因此,学界曾有人提出,阿尔茨海默病是一种“加速老化”,换言之,只要人活得足够久,给认知功能和神经系统足够长的退行时间,最终都会患上阿尔茨海默病。
这样的说法无疑是将老年痴呆和老化画上了等号,也难怪老人们出现一点认知下降就惶恐不已:“衰老退行可是老年痴呆的开始啊!”这样的思维,最初是惶恐,而后很可能转化为无奈和接受,以及对临床检查的抵触:“反正都要痴呆,何必再做无谓的检查?”的确有很多社区老人拒绝接受神经心理测验和痴呆筛查——即便是免费的。
事实真的如此吗?老年痴呆就是加速老化?老化终将走向老年痴呆?答案当然是否定的。否则为什么会有那么多长寿而又保持良好认知功能的老人?近年来,不断有研究者对阿尔茨海默病是“加速老化”这一学说提出挑战,人们开始关注阿尔茨海默病与正常老化间的差异——即便有相似的神经病理表现,这二者也绝不是同一过程的不同阶段,而是两个截然不同的发展路径。
比如,虽然都会出现全脑灰质的萎缩,但患者主要萎缩的区域是海马、内嗅皮层、旁海马,并且萎缩模式的个体差异较大,而正常人主要萎缩的区域是额下回、脑岛、扣带回、楔前叶、眶额皮层,并且萎缩遵循一致模式;虽然都会出现海马区域神经元的丢失,但患者的海马CA1区神经元丢失数量大,而正常老化者该区域的神经元几乎没有丢失;虽然都会在出现淀粉样蛋白斑块的沉积,但患者的沉积在体量上逐年增加,在空间上逐渐扩散至全脑,并伴随着严重的认知功能损伤,而正常人的沉积量基本维持不变,并主要集中在内侧颞叶,等等等等。
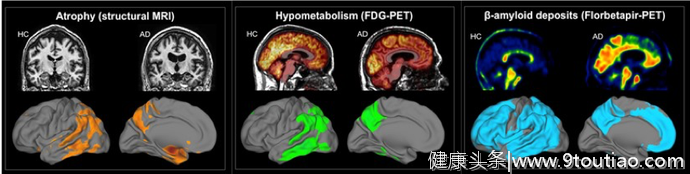
图5 健康老年人(HC)和阿尔茨海默病患者(AD)在大脑萎缩(左)、大脑葡萄糖代谢(中)、大脑淀粉样蛋白斑块沉积(右)三种病理上都存在程度和空间分布的差异。
老化是阿尔茨海默病的主要风险因素,随着年龄增大,阿尔茨海默病的患病风险也的确在增加。但老化绝不能等同于老年痴呆,也并不会导致老年痴呆,二者是不同过程,也没有因果关系。
反对痴呆污名化,倡导关注早筛查
国际阿尔茨海默病协会(Alzheimer’s Disease International, ADI)2019年发布的《世界阿尔茨海默病报告》中介绍了一项在全球155个国家针对7万余人进行的调查。结果显示,95%的受访者认为他们最终会患上老年痴呆,而1/4的受访者认为老年痴呆是无法被预防的。2/3的受访者认为老年痴呆不是病,人老了糊涂是正常的。令人震惊的是,约有62%的卫生保健人员和医疗工作人员竟然也认为老年痴呆只是正常老化的一部分。
每当提起老年痴呆,不少人会联想到痴傻、糊涂、疯癫等带有耻感的词汇。这种污名化会带来两类非常严重的后果:第一是对老人本身而言,他们将健忘、注意力无法集中等正常老化现象误认为是老年痴呆的症状,从而陷入焦虑和恐慌中,继而转为绝望和抵触——宁愿“自我诊断”,也不愿与人交流或进行检查。第二是对子女亲人及其他照料者而言,对于老年痴呆的偏见可能导致他们忽略老人真正的症状和诉求。很多健康老人在55岁以后由于身体机能衰退、退休、慢性疾病等诸多原因,可能会出现各类精神症状如抑郁、焦虑、睡眠障碍等,并持续一段时间,此时老人正需关心陪伴,但若照护者将这类症状诉求一股脑归类为“老年痴呆了”“老糊涂了”,则会严重影响老人的情绪和精神状态。
我国目前的60岁以上痴呆患者高达1000万-1100万人,占世界痴呆患者的25%,但其中60%-70%的患者并未前往就医。为什么人人都怕痴呆,但真正痴呆患者的知晓率又这么低?究其原因还是污名化问题的没有解决,人们对痴呆的错误认识导致大部分民众不仅痴呆视为洪水猛兽,还将其视为“必将到来”的洪水猛兽。早期筛查、科普教育、照护文化的改变需要时间,而一切改变的前提是观念的改变。我们首先要明确区别老年痴呆和正常的“老了”,这是两条截然之路。老年痴呆是一种病,虽然难以治疗,但若尽早筛查,也可通过各类手段改善病情,提升患者生活质量。而“老了”,是健康、积极地老去,是欣然接受身体机能的衰退和社会职能的改变,是一棵大树在扎根深处直上苍穹之后,开出的最美丽的花,结下的最丰硕的果。
参考文献:
1. Ebly EM, Parhad IM, Hogan DB, et al. Prevalence and types of dementia in the very old: results from the Canadian Study of Health and Aging. Neurology 1994; 44(9): 1593.
2. McKhann GM, Knopman DS, Chertkow H, et al. The diagnosis of dementia due to Alzheimer's disease: recommendations from the National Institute on Aging-Alzheimer's Association workgroups on diagnostic guidelines for Alzheimer's disease. Alzheimer’s & Dementia 2011; 7(3): 263-269.
3. Ballesteros S, Nilsson L-G, Lemaire P. Ageing, cognition, and neuroscience: An introduction. European Journal of Cognitive Psychology 2009; 21(2-3): 161-175.
4. Arriagada PV, Marzloff K, Hyman BT. Distribution of Alzheimer‐type pathologic changes in nondemented elderly individuals matches the pattern in Alzheimer's disease. Neurology 1992; 42(9): 1681.
5. Pichet Binette A, Gonneaud J, Vogel JW, et al. Morphometric network differences in ageing versus Alzheimer's disease dementia. Brain 2020; 143(2): 635-649.
6. West MJ, Coleman PD, Flood DG, et al. Differences in the pattern of hippocampal neuronal loss in normal ageing and Alzheimer's disease. The Lancet 1994; 344(8925): 769-772.
7. Chételat G, La Joie R, Villain N, et al. Amyloid imaging in cognitively normal individuals, at-risk populations and preclinical Alzheimer's disease. NeuroImage: Clinical 2013; 2: 356-65.
8. World Alzheimer report 2019: attitudes to dementia. Alzheimer’s Disease International. London, UK, 2019.
9. Huang Y, Wang Y, Wang H, et al. Prevalence of mental disorders in China: a cross-sectional epidemiological study. The Lancet Psychiatry 2019; 6(3): 211-224.
10. Jia L, Quan M, Fu Y, et al. Dementia in China: epidemiology, clinical management, and research advances. The Lancet Neurology 2020; 19(1): 81-92.
本文来源:脑人言
本文作者:cylo
责任编辑:陆离先生
版权申明
- End -