5年探索,中国女科学家捕获抑郁症元凶,成果将拯救数亿人
我们大家都知道,抑郁症在如今高负荷强压力的社会变得越来越普遍。根据我国部分地区精神疾病流行病学调查结果估算:我国15岁以上人口中,各类精神疾病患者人数超过1亿人,其中1600万人是重性精神障碍患者,其余大多数是抑郁症、自闭症等精神障碍或心理行为障碍患者。
从二十世纪四五十年代被提及,如何有效缓解抑郁症这是众多科学家都想要解决的问题,“单胺类假说”从20世纪提出来之后,经过不断发展,是目前科学家比较广泛接受的一种抑郁症发病机制理论,并据此建立了目前对抑郁症治疗的根基。此假说提出抑郁症是由于患者脑内中枢和外周5-羟色胺(5-HT)、去甲肾上腺素(NE)等单胺类神经递质下降或缺乏所致。
目前的抗抑郁药物大都基于这一点来进行研发,但这些药物起效的时间往往非常缓慢,需要几周甚至几个月,而且只对20%—30%左右的病人有效,并且,“单胺类假说”并没有从本质上找出导致抑郁症的元凶。
所以,揪出真正导致抑郁症的元凶就成了科学家一直所思考的问题。而这个问题在胡海岚教授这里取得了重大突破, 胡海岚教授长期从事情感与社会行为的神经机制研究,她先后在美国加州大学伯克利分校、美国冷泉港实验室、中国科学院上海生命科学研究院从事研究工作,自2015年5月起任职浙大, 双聘于浙江大学求是高等研究院和医学院神经科学研究中心。现在是浙江大学基础医学院教授,神经科学研究中心执行主任。

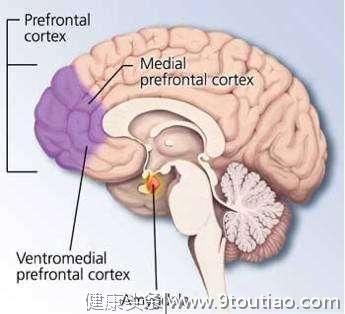
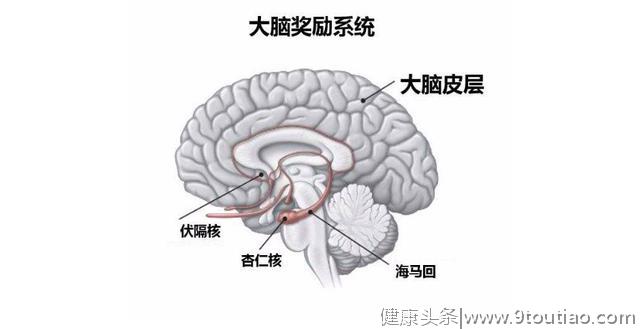
在此之前,胡海岚就已经从分子与神经环路机制出发,通过蛋白定量质谱分析,电生理以及行为学等多种科学手段,将研究重点聚焦在脑部一个名为“缰核”的部分。缰核是脊椎动物共有的大脑部位,分为内外两侧。其中,外侧缰核是前脑向中脑相关奖赏区传递信息的“核心枢纽”,是参与抑郁症形成的关键脑区。近年来,神经影像学以及抑郁动物模型的研究均表明,在抑郁状态下,缰核脑区表现出过度活跃。
研究中,胡海岚团队博士生李坤和周涛利用定量蛋白质分析,通过比较正常和抑郁大鼠的缰核,发现钙/钙调蛋白激酶II家族中的成员βCaMKII分子的表达水平在多种抑郁动物模型的外侧缰核中明显增多;而在天生抑郁的动物中,给予类似于抑郁病人的抗抑郁药物治疗后,动物的抑郁症状明显改善,此时βCaMKII在外侧缰核的含量也相应降低。
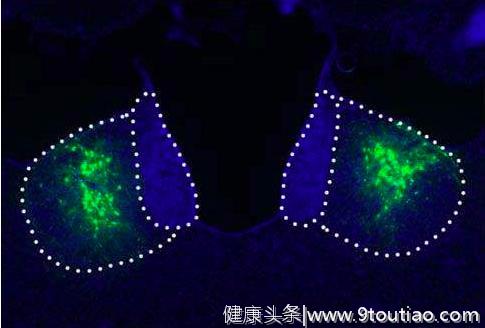
为了进一步明确βCaMKII的表达水平与抑郁症状的关系,胡海岚团队还通过基因操作在外侧缰核提高 βCaMKII的表达水平,发现经历这种基因操作的动物,都会产生典型的抑郁症状。一个有趣的实验就是,将正常小鼠与抑郁小鼠分别放到水中,看看两者的反应会有什么样的差别。
老鼠抑郁有啥表现呢?老鼠喜欢吃甜品的,正常的老鼠看见甜品,会很激动,而抑郁的老鼠就不会,把它们放到水里,它都不会选择挣扎一下。

那么在实验中,抑郁小鼠明显放弃了求生的本能。并且对好吃的糖水完全提不起兴趣。
随后,科研人员利用RNA干扰技术,在天生抑郁大鼠的外侧缰核脑中特异性地降低βCaMKII的表达水平时,各种先天的抑郁症状都得到明显的好转。而在外侧缰核进行的电生理记录显示过表达βCaMKII后,外侧缰核神经元的电活动也明显增强。
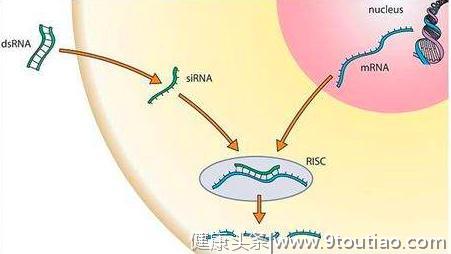
RNA干扰技术
这项研究提示了一种新的抑郁症分子机制,即外界压力或是情绪的刺激,导致外侧缰核神经元中βCaMKII的含量升高,进而使得神经突触放电增加,并使得缰核过度兴奋,从而增强了对其下游相关脑区诸如腹侧被盖区VTA与中缝背核DR的抑制,从而减少了多巴胺的分泌,最终导致了快感缺失与行为绝望的核心抑郁症状。
首次证实了抑郁症的发生和大脑内“βCaMKII”的蛋白激酶分子密切相关,它是调节神经活动的重要蛋白,当它出现在大脑中负责传递奖赏信息的核心区域并且表达水平过高时,就会抑制快乐因子“多巴胺”的分泌,并且充当失望使者将负面情绪传递给大脑,导致了快感缺失与行为绝望,这也是抑郁症的核心症状。。

她还发现,在诱导抑郁的压力刺激 下,外侧缰核中 βCaMKII 的表达上调并通过促进 GluR1 进入突触等变化导致缰核过度兴奋,从而增强了外侧缰核对下游脑区腹侧被盖区VTA与中缝背核DR的抑制,进而导致了快感缺失与行为绝望。
目前医学领域缺少脑部定向给药的技术,使得基因治疗在现阶段难以成为现实。所以胡海岚团队想进一步深层次地发现抑郁症的作用机制。
而胡海岚团队在上次研究成果的基础上进一步找到了快速抗抑郁分子的作用机制,推进了人类关于抑郁症发病机理的认知,并为研发新型抗抑郁药物提供了多个崭新的分子靶点。
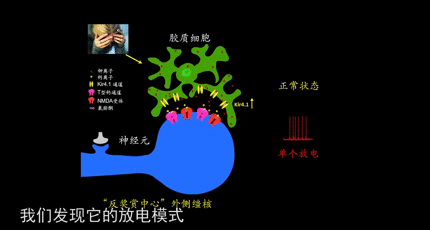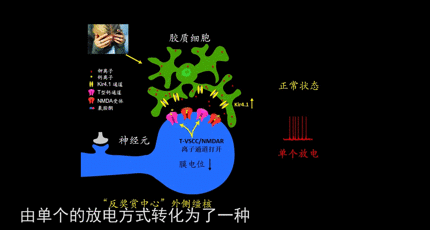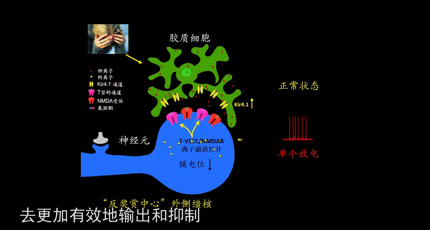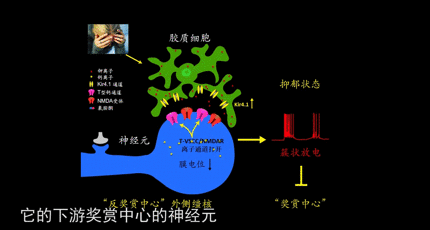
首先,我们要搞清楚一点,负面情绪是怎么操控人的?它们用到的主要方法是:刺激神经元进行簇状放电。
正常情况下,大脑神经元会通过单个放电,向下游传递信息。但是如果发电模式变成高频的簇状放电,抑郁症就会发生。
胡海岚研究团队利用光遗传技术,诱发外侧缰核的簇状放电。结果发现:原本不抑郁的老鼠,也瞬时地表现出多种典型的抑郁行为。
经过对老鼠的仔细研究,胡海岚发现老鼠外侧缰核的簇状放电,依赖于大脑中最主要的兴奋性递质谷氨酸受体NMDAR。
胡海岚通过将氯胺酮给药于抑郁大鼠的外侧缰核,能快速缓解大鼠的多种抑郁症状(包括它的“行为绝望”和“快感缺失”)。
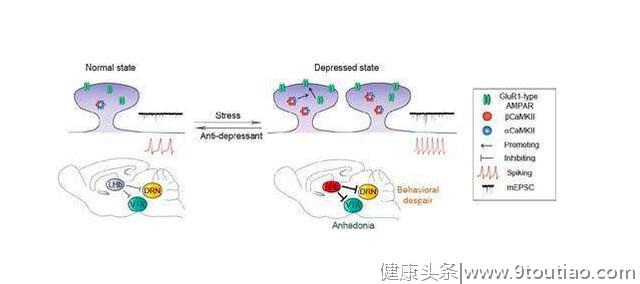
也就是说氯胺酮作为NMDAR的阻断剂,能完全阻断外侧缰核神经元的簇状放电,从而抑制住抑郁症。
氯胺酮是K粉的主体成分,K粉是指分离性麻醉剂。主体成分医学上称氯胺酮,全名为 2-邻-氯苯基-2-甲氨基环已酮,是苯环已哌啶(PCP)的衍生物。K粉原本是毒品,现在也被运用于药物之中。普通人是不能拥有的,否则会享受警察先生的24小时服务。
近年来,氯胺酮作为新型抗抑郁药物,由于其快速的抗抑郁作用(在几小时内改善情绪),以及能够在很多(>70%)“难治型抑郁症患者”中取得疗效,被誉为整个精神疾病领域近半个世纪最重要的发现。
但是氯胺酮作用于大脑中的什么部位?在哪些细胞上起作用?它为何能快速起到抗抑郁的效果?这些疑问,都困扰着科学家,而胡海岚教授则通过将将氯胺酮给药于抑郁大鼠的外侧缰核成功发现了发现了抑郁症在大脑中的作用机制。
大脑中外侧缰核的特殊放电方式——簇状放电是导致人们患抑郁症的元凶。

外侧缰核是大脑中海马体下方一个小小的核团,它是大脑的“反奖励中枢”,被认为介导了人的大部分负面情绪:恐惧、紧张、焦虑。它与中脑“奖励中心”的单胺核团”相互“拮抗”,左右着我们的情绪。
众所周知,神经元通过放电向下游发送信息。一旦人换了抑郁症,缰核神经元的放电方式发生了显著的变化,呈现出了更多的簇状放电行为,就像霰弹枪变成了机关枪,密集高效地射出子弹,发送的信息变得非常高效,这种放大的信号强化了外侧缰核对“奖励中心”的抑制,让人感受不到快乐,产生了抑郁。
胡海岚团队的研究成果可以说首次揭示抑郁症的形成和大脑中一个反奖赏中心—缰核的簇状放电方式密切相关;提出了全新的氯胺酮快速抗抑郁机制,即通过阻断簇状放电从而释放对奖赏中心的抑制;首次发现胶质细胞调节神经元放电方式的特殊结构—功能关系;针对阻断簇状放电的思路,为开发新型的快速抗抑郁药物提供了多个崭新的分子靶点。
但是氯胺酮作为一种毒品,在临床上作为抗抑郁药物使用有很大局限,科学家一直在寻找更安全有效的抗抑郁药物。
所以胡海岚团队在经过仔细研究之后发现了多个崭新的药物靶点。团队利用脑片电生理和数学建模的方法证明,位于外侧缰核的另一个离子通道:T型钙通道(T-VSCCs)对神经簇状放电也发挥着重要作用。“在全身或者外侧缰核内局部阻断T-VSCCs,同样产生了快速的抗抑郁效果。”胡海岚说,“这一工作告诉我们,T-VSCCs是一个崭新的抗抑郁分子靶点。”

胡海岚和学生们的约定:发一篇文章,开一瓶香槟!
胡海岚团队后来又揭示了另外一个快速抗抑郁分子靶点——存在于胶质细胞中的的钾离子通道Kir4。
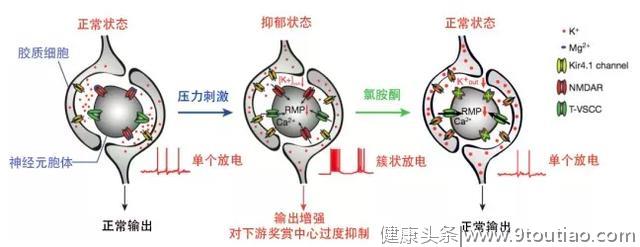
基于此,胡海岚教授团队得出了新的抑郁模型,在外界压力刺激下,大脑的“反奖赏中心”-外侧缰核-中胶质细胞Kir4.1离子通道表达上调,造成神经元胞外钾离子浓度的下降,促使神经元由单个放电转化为簇状放电模式,进而造成对下游奖赏中心(包括腹侧被盖区VTA与中缝背核DR)的过度抑制,进而导致了快感缺失与行为绝望等抑郁表型。而氯胺酮能够有效阻断外侧缰核的簇状放电从而起到快速抗抑郁的作用。
可以说,在这一系列的研究中,胡海岚团队陆续指出了谷氨酸受体NMDAR、T-VSCCs 、Kir4.1作为快速抗抑郁分子靶点的有效性。
胡海岚教授的两篇论文AstroglialKir4.1 in lateral habenula drives neuronal bursts in depression(星形胶质细胞中Kir4.1驱动外侧缰核神经元簇状放电介导抑郁症发生中)和Ketamine blocks bursting in the lateral habenula to rapidly relieve depression(氯胺酮阻断外侧缰核簇状放电实现快速抗抑郁)在著名期刊《自然》杂志上发表,


《自然》杂志评审人对这一系列重大突破给予了很高评价:“关于外侧缰核NMDA受体参与介导簇状放电和氯胺酮的抗抑郁作用的发现非常重要、创新,并且具有广泛的意义”。
《自然》和另一顶级期刊《科学》都为这两篇论文专门配发评论文章,充分彰显了它的含金量。

胡海岚团队
胡海岚也因此获得了第12届IBRO-Kemali国际奖,这是该奖自1998年设立以来,首次颁发给欧洲和北美洲以外的科学家。这个奖项两年才颁发一次,年龄不能超过 45 岁。得奖难度之高,可以和数学界的菲尔兹奖并列。
简单来说就是,胡海岚团队揭示了快速抗抑郁分子的作用机制,从全新角度阐释了抑郁症发病机理,并为研发新型抗抑郁药物提供了多个崭新的分子靶点。
胡海岚的这项成果将惠及中国上亿人,药厂会根据她的研究成果研制新的抗抑郁药。胡海岚说:“虽然药物研发的道路很漫长,但是我们已经看见了曙光,并且迈出了第一步”。
 ".jpg
".jpg