Cell丨 两条腿走路!癌症治疗的新起点
癌症的进展取决于癌细胞的生物学特性和宿主的免疫状态。癌症治疗中,或是直接靶向杀死肿瘤细胞,或是通过激发免疫反应间接杀死肿瘤,两者都取得了不同程度的成功。那么,是否存在一个将杀伤肿瘤细胞与激发免疫反应相结合的治疗方法呢?
丝氨酸蛋白酶是一类蛋白质裂解酶,在多种生理过程如凝血、细胞凋亡和炎症等过程中发挥重要作用。丝氨酸蛋白酶的失衡与多种疾病有关,严格地调节这些丝氨酸蛋白酶诱导的蛋白质水解是防止自身诱导损伤的关键,在细胞内有多种机制控制着它们的活性。首先,丝氨酸蛋白酶的产生有时是作为非活性的酶原形式存在,裂解后才会变成活性酶;其次,蛋白酶的活性受其定位的调节;最后,且非常重要的是,大自然已经进化出一组特定的丝氨酸蛋白酶抑制剂(Serpin)限制丝氨酸蛋白酶的活性。Serpin可以通过一种独特的自杀机制将靶蛋白酶捕获到一个不可逆的稳定复合物中,从而抑制靶蛋白酶的活性【1,2】。
免疫细胞可表达多种丝氨酸蛋白酶,其中有一类是存在于细胞毒性淋巴细胞(CL)中的颗粒酶。颗粒酶B(Granzyme B, GrB)是一种细胞凋亡蛋白酶样丝氨酸蛋白酶,其可通过激活caspase-3和caspase-8,被CL传递到靶细胞后触发细胞凋亡,杀伤病毒感染的细胞和肿瘤细胞(最近有多项研究表明颗粒酶A/B还能够诱导细胞焦亡,详见:Nature背靠背 | 张志斌/刘志博/邵峰等揭示细胞焦亡在肿瘤免疫方面的全新功能;邵峰组Science报道细胞毒性淋巴细胞诱导细胞焦亡的机制)。而丝氨酸蛋白酶抑制剂SerpinB9(Sb9,人类中为PI9,小鼠中为Spi6)是其天然的生理抑制剂。与大多数细胞外Serpin不同,Sb9定位于细胞核和细胞质中,其能阻止GrB介导的细胞死亡,并与攻击靶细胞的CL中包含GrB颗粒的细胞质表面相关。Sb9可以保护促炎CL免受自身GrB的自我伤害。在静息的CL中,Sb9高表达,而GrB蛋白低表达或不表达,从而确保了它们的存活。然而,在CL成熟和激活过程中,GrB表达被诱导,而Sb9的水平没有显著改变。GrB与Sb9的比例发生有利于GrB的改变,并可能增加细胞对GrB释放的敏感性【3,4】。肿瘤微环境(TME)中的免疫抑制肿瘤相关巨噬细胞(TAM)、骨髓源性抑制细胞(MDSC)和调节性T细胞(Treg)可以促进肿瘤的进展和转移,而Sb9被发现可以保护其他白细胞包括促炎细胞(树突细胞和中性粒细胞)或抗炎细胞(Treg和 MDSC)免受来源于CL或内源性产生的GrB的作用。此外,Sb9也被认为可以保护肿瘤细胞不受CL传递的GrB的伤害。除此之外,有人认为Sb9-GrB轴对肿瘤基质(基质细胞,包括癌相关成纤维细胞,构成了TME的主要细胞成分,在肿瘤的发展中发挥关键作用)也有着重要的影响。
尽管如此,目前对于Sb9-GrB轴对TME中的抗肿瘤细胞效应器(如CL)和免疫抑制成分的潜在影响仍未知,抑制Sb9是否通过直接杀伤或增加宿主免疫力而导致有益的肿瘤清除也仍有待确定。
近日,来自美国哈佛大学医学院的Reza Abdi团队在Cell上在线发表题为Direct Tumor Killing and Immunotherapy through Anti-SerpinB9 Therapy 的文章,揭示了SerpinB9-GrB轴对肿瘤发展的各方面影响,发现了SerpinB9的特异性小分子抑制剂,证实其即可以降低肿瘤生长,同时也可以增强肿瘤的免疫原性,从而描述了一种以直接杀死肿瘤细胞和触发保护性免疫为基础的控制癌症生长的新范式。

首先,研究人员在人类和小鼠的多种肿瘤(包括恶性黑色素瘤、乳腺癌和肺腺癌)组织和肿瘤细胞系中均检测到GrB和Sb9的表达。同时,研究人员还发现,在肿瘤细胞中几乎所有的GrB都与Sb9形成复合物而存在,而敲除了Sb9以后,虽然细胞的增殖不受影响,但是GrB的活性显著增加,裂解的caspase-3表达增加,GrB特异性凋亡增强。由此表明,Sb9是保护肿瘤细胞免受GrB诱导的细胞凋亡所必需的。同样地,将Sb9敲除(Sb9 KO)的肿瘤细胞注射入小鼠体内,与注射的正常肿瘤细胞相比,前者的肿瘤生长明显缓慢,表现出与体外实验一致的结果,而注射过表达Sb9的肿瘤细胞则出现相反的结果,由此证明Sb9的表达可以促进肿瘤在体内的生长和转移。
那么,Sb9是如何产生这样的促癌作用的呢?以黑色素瘤为例,研究人员研究了Sb9在Sb9 KO小鼠的肿瘤免疫应答中的作用。首先可以观察到,与正常小鼠相比,Sb9 KO小鼠注射肿瘤细胞,后者的肿瘤生长明显减慢,生存期延长,当肿瘤细胞和宿主小鼠的Sb9都缺乏(Sb9 KO/Sb9 KO小鼠)时,黑色素瘤的发展可被最大程度的限制,而这种限制与增殖无关,却与细胞凋亡有着直接关系。随后,研究人员研究了宿主Sb9缺失对植入黑色素瘤的TEM的影响。结果显示在Sb9 KO/Sb9 KO小鼠的TEM中,Treg细胞、免疫抑制细胞TAM和MDSC以及IL-10+CD4+细胞显著减少。作者表示,在Treg、TAM和MDSC中,Sb9的丢失使它们暴露于TME内GrB介导的杀伤,最终导致抗肿瘤免疫反应的恢复和肿瘤进展的抑制。同时,研究人员发现,CAF的数量也在Sb9 KO/Sb9 KO小鼠中显著减少,为了进一步评估Sb9在肿瘤基质中的表达对肿瘤生长的影响,研究人员将GFP标记细胞与从C57BL/6-WT(野生型)小鼠或Sb9 KO小鼠骨髓中分离的间充质干细胞(MSC)共培养,结果显示与前者共培养的细胞(MSC-WT)可以组成多个致密的团簇,而与后者共培养的细胞(MSC-Sb9 KO)分散,不能相邻,并且MSC-Sb9 KO细胞表达的纤连蛋白和胶原蛋白I(纤维化TME的标志物,是化疗药物穿透的主要障碍,影响疗效)明显减少(图1),由此表明,Sb9在基质细胞中的存在促进了它们的生长、ECM纤维的合成以及对癌细胞的增殖作用。
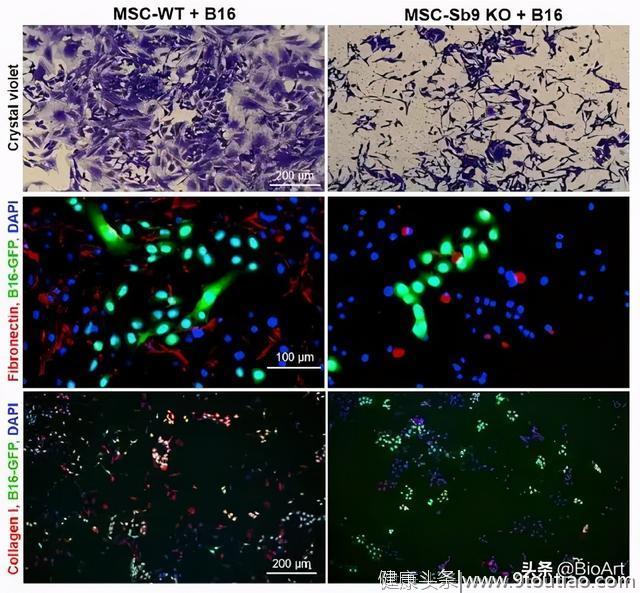
图1
最后,研究人员筛选出一种可以与Sb9良好结合的小分子抑制剂3034,体外实验表明其与Sb9的结合是pH依赖性的,可以有效抑制Sb9,增强细胞凋亡速率。体内实验证实,3034可以显著抑制小鼠黑色素瘤的发展,并减少免疫抑制细胞Treg、TAM和MDSC的数量,增加宿主免疫力。此外,在A375的NSG人源化小鼠模型中也得出同样的结果。由此表明化合物3034能抑制黑色素瘤细胞中的Sb9,使其对GRB介导的凋亡敏感。同时,3034也可以抑制MSC-WT细胞中纤连蛋白和胶原蛋白∣的表达,减少基质细胞和CAF的水平。同样地,研究人员也证实了3034对乳腺癌、肺癌和肾癌的作用,表明化合物3034对Sb9的抑制作用具有强大而广泛的抗肿瘤作用。
综上所述,本文发现了GrB的双重来源(包括宿主来源和肿瘤来源)是如何通过抑制癌细胞产生的Sb9和释放宿主抗肿瘤免疫而直接导致癌细胞死亡的,这一发现为开发治疗免疫沉默肿瘤的独特方式奠定了基础。同时本文筛选的Sb9小分子抑制剂可以在多个层面靶向抑制肿瘤——通过自身的GrB诱导肿瘤细胞死亡;下调TME中的免疫抑制细胞,消除血管生成和基质细胞,从而使TME不利于肿瘤的生长和转移——并且被证明可能比免疫检查点抑制剂更安全,从而开启了癌症治疗的新起点。

原文链接:
制版人:十一
参考文献
1. Kirstin M Heutinck, Ineke J M ten Berge et al. Serine proteases of the human immune system in health and disease. Mol Immunol. 2010; 47(11-12):1943-55.
2. Amin Jablaoui, Aicha Kriaa et al. Biotechnological Applications of Serine Proteases: A Patent Review.Recent Pat Biotechnol. 2018; 12(4):280-287.
3. D Kaiserman, P I Bird. Control of granzymes by serpins. Cell Death Differ. 2010 ;17(4):586-95.
4. Joseph A Trapani, Vivien R Sutton. Granzyme B: pro-apoptotic, antiviral and antitumor functions. Curr Opin Immunol. 2003; 15(5):533-43.