均有“广谱抗癌”潜力!罗氏3款新药在中国获批临床
▎药明康德内容团队报道
根据中国国家药监局药品审评中心(CDE)最新公示,罗氏公司(Roche)3款新药临床试验申请获得默示许可,分别是靶向P13K/AKT信号通路的抗癌药ipatasertib,PD-L1抑制剂阿替利珠单抗(Tecentriq,atezolizumab),以及“不限癌种”个体化药物entrectinib。 值得一提的是,这3款新药均具有“广谱抗癌”的潜力,即靶向驱动癌症的特定基因特征,而不是肿瘤起源的组织类型。
目前,中国尚未有“不限癌种”疗法获批。但越来越多的不限癌种疗法已经迈入或正在迈入临床阶段。这也意味着,中国患者有望在不久的将来迎来“广谱抗癌”疗法,进入广谱抗癌时代。

Ipatasertib:靶向P13K/AKT信号通路
Ipatasertib是一款靶向P13K/AKT信号通路的口服特异性抑制剂,能够与AKT的三种亚型相结合。PI3K/AKT信号通路是一条促进肿瘤发生、肿瘤耐药和代谢改变,且非常活跃的信号通路之一,被认为是肿瘤细胞对免疫检查点抑制剂产生抗性的机制之一。因此,抑制PI3K/AKT信号通路可以防止癌细胞生长和生存,也可能逆转肿瘤细胞对免疫疗法的抗性。
此次ipatasertib在中国获批临床,拟开发用于AKT1/2/3突变阳性实体瘤。研究表明,在乳腺癌、结直肠癌和血液癌症等几乎所有的人类癌症中,几乎都存在PI3K/AKT信号通路失调的现象。因此,AKT也被认为是一个广谱抗癌的新靶点。
截图来源: CDE官网
此前,ipatasertib已在治疗转移性去势抵抗性前列腺癌(mCRPC)患者的3期临床试验中,达到其中一个主要终点。在携带PTEN抑癌基因缺失的患者中,ipatasertib联合疗法可显著提高患者的放射学无进展生存期(rPFS)。
在针对三阴性乳腺癌(TNBC)方面,ipatasertib与阿替利珠单抗和化疗联用一线治疗TNBC的1b期临床试验结果显示,在不考虑患者PD-L1表达水平和PIK3CA/AKT1/PTEN基因变异的情况下,联合疗法达到73%的客观缓解率(ORR)。另一项名为LOTUS的2期临床试验显示,ipatasertib在治疗通过分子诊断筛选的TNBC患者时,将疾病进展和死亡风险降低56%。
阿替利珠单抗:PD-L1抑制剂
阿替利珠单抗是一款由罗氏旗下基因泰克(Genentech)公司开发的抗PD-L1单克隆抗体。它通过和肿瘤细胞表面以及肿瘤浸润免疫细胞表面的PD-L1蛋白结合,来识别和攻击肿瘤细胞。此前,该产品已在全球获批膀胱癌、尿路上皮癌、非小细胞肺癌和广泛期小细胞肺癌等多个适应症。值得注意的是,目前已有多个临床试验正在检验PD-L1抑制剂在“不限癌种”适应症方面的疗效。
此次阿替利珠单抗在中国获批临床,拟开发适应症有两项。一是阿替利珠单抗联合白蛋白结合型紫杉醇以及二甲双胍用于既往未经治疗的转移性三阴性乳腺癌患者;二是阿替利珠单抗加贝伐珠单抗联合顺铂和吉西他滨用于既往未接受过全身治疗的晚期胆道癌患者。

截图来源: CDE官网
在针对三阴乳腺癌方面,阿替利珠单抗已于2019年3月在美国获得批准,与白蛋白紫杉醇联合治疗无法切除的局部晚期或转移性三阴性乳腺癌成年患者。在一项名为IMpassion130的3期临床试验中,该款组合疗法将患者疾病恶化和死亡风险降低40%,中位PFS高达7.4个月(vs 4.8个月)。而二甲双胍治疗三阴乳腺癌的早期研究则曾登上Nature等杂志,在动物肿瘤模型中,二甲双胍与血红素、PD-1抗体、BCL-2抑制剂等联合使用均能对乳腺肿瘤细胞产生杀伤作用。这为阿替利珠单抗联合二甲双胍用于三阴乳腺癌提供了一定科学依据。
在针对晚期胆道癌方面,一项在2020年美国癌症研究协会(AACR)上公布的随机多中心2期研究结果显示,与单用阿替利珠单抗相比,阿替利珠单抗联合MEK抑制剂考比替尼治疗胆道癌达到了其主要终点并显著延长了无进展生存期。

值得一提的是,阿替利珠单抗已于今年2月在中国获批用于一线治疗广泛期的小细胞肺癌,其一线治疗晚期不可切除的肝细胞癌的新适应症也在今年10月再次获批。
Entrectinib:靶向ROS1和NTRK基因融合
Entrectinib是一款针对NTRK和ROS1基因融合而设计的特异性酪氨酸激酶抑制剂,它能够抑制TRK A/B/C和ROS1激酶活性。NTRK基因融合可能出现在起源于身体不同位置的肿瘤中,包括乳腺癌、胆管癌、结直肠癌、神经内分泌癌,非小细胞肺癌(NSCLC),胰腺癌等。研究显示,这款“不限癌种”的精准抗癌疗法在治疗NTRK融合阳性实体瘤患者中,达到57.4%的客观缓解率,而且达到54.5%的颅内客观缓解率。
此次entrectinib胶囊/片在CDE获得3项临床试验默示许可,拟开发适应症均为:用于治疗携带特异性致癌基因改变或潜在的预测性生物标志物的不可切除、局部晚期或转移性实体瘤患者。此前,该产品还在中国获批多项临床试验,适应症有:NTRK阳性实体瘤儿童患者,携带ROS1阳性的局部晚期或转移性非小细胞肺癌患者,NTRK1/2/3基因突变的局部晚期或转移性实体瘤患者。
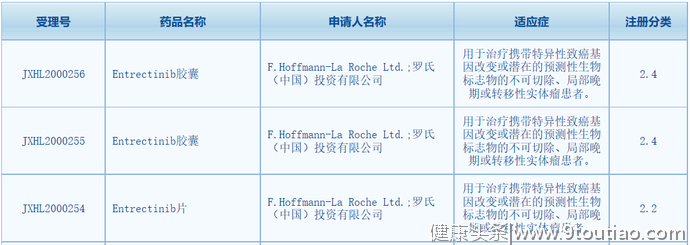
截图来源: CDE官网
值得一提的是,entrectinib的“不限癌种”适应症已于2019年8月获得美国FDA加速批准,用于治疗携带NTRK基因融合的成年和青少年癌症患者,成为美国FDA批准的第三款“不限癌种”抗癌疗法。同时,该产品还被批准用于携带ROS1基因突变的非小细胞肺癌患者。
祝贺罗氏3款新药在药物临床申报上获得一系列进展,希望这些全球性的重磅新药能够造福更多患者。
版权说明:本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「医药观澜」微信公众号留言联系我们。
注:本文旨在介绍医药健康研究进展,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
参考资料:
中国国家药监局药品审评中心. Retrieved Nov 26, 2020, from http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=21#
Roche’s IPATential150 study evaluating ipatasertib in combination with abiraterone and prednisone/prednisolone met one of its co-primary endpoints. Retrieved June 20, 2020, from https://www.roche.com/media/releases/med-cor-2020-06-19.htm
Roche's ipatasertib in combination with Tecentriq and chemotherapy shows promising anti-tumour activity in triple-negative breast cancer in early phase trial. Retrieved April 1, 2019, from https://www.globenewswire.com/news-release/2019/04/01/1790294/0/en/Roche-s-ipatasertib-in-combination-with-Tecentriq-and-chemotherapy-shows-promising-anti-tumour-activity-in-triple-negative-breast-cancer-in-early-phase-trial.html
Japan becomes the first country to approve Roche’s personalised medicine Rozlytrek. Retrieved June 18, 2019, from https://www.roche.com/media/releases/med-cor-2019-06-18.htm
FDA approves third oncology drug that targets a key genetic driver of cancer, rather than a specific type of tumor. Retrieved August 15, 2019, from https://www.prnewswire.com/news-releases/fda-approves-third-oncology-drug-that-targets-a-key-genetic-driver-of-cancer-rather-than-a-specific-type-of-tumor-300902681.html