到底是促癌还是抑癌?PD-L1还有不为人知的一面
肿瘤免疫治疗的兴起,为人类彻底攻克“万病之王”——癌症带来了新的曙光。其中,疫检查点阻断疗法已成为当今最热门的免疫疗法之一,该疗法显著改变了目前癌症治疗的格局,而PD-1/PD-L1免疫阻断疗法正是最典型的代表。
程序性细胞死亡受体(PD-1),是一种重要的免疫抑制分子,它可以下调免疫系统响应从而避免自身免疫病。肿瘤细胞表面的PD-L1与T细胞上的PD-1结合,促使肿瘤细胞获得免疫逃逸。因此,通过抑制剂来抑制二者之间的结合,能够使得T细胞正常杀伤并清除肿瘤细胞。
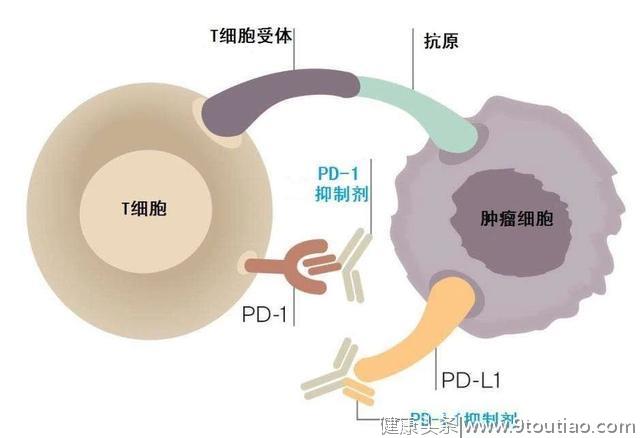
PD-1/PD-L1免疫阻断疗法
因此,长期以来,PD-L1一直被广泛描述为PD-1的膜结合配体。但出人意料的是,最新的一项研究却发现了PD-L1不为人所知的新作用,它能够结合DNA,从而控制与逃避免疫监视或肿瘤微环境炎症相关的不同途径。
该研究以 Acetylation-dependentregulation of PD-L1 nuclear translocation dictates the efficacy of anti-PD-1 immunotherapy 为题,发表在Nature Cell Biology 杂志,由哈佛医学院、中国西安交通大学第一附属医院以及日本东京医科齿科大学等研究机构联合完成。

免疫检查点阻断疗法已经极大地改善了多种人类癌症的临床预后,但不得不说的是,免疫系统是精密而复杂的,人类对它的认知还十分匮乏。更深入地了解免疫检查点通路的调控机制,将有助于我们解决在患者中观察到的低应答率和缺乏长期治疗效果等遗留问题。
在癌症背景下,PD-L1通常在肿瘤细胞上高表达,从而逃避免疫监控,但也有报道称,PD-L1高表达可使肿瘤细胞对PD-1/PD-L1抑制剂更敏感。此外,有研究发现,在人类结肠直肠癌和前列腺癌中,细胞核PD-L1的表达与不良预后相关。
这些研究事实表明,PD-L1的功能可能十分复杂多样,而非此前我们认为的、仅仅是PD-1的膜结合配体。
在此项研究中,研究团队发现了PD-L1新的功能作用和调控机制。具体来说,他们证明PD-L1在其C端(胞质侧)尾部上被p300酶乙酰化,而其他乙酰转移酶没有促进PD-L1的乙酰化,且当PD-L1 C端尾部缺失时乙酰化消失。
紧接着,通过对PD-L1 C端尾部的5个赖氨酸残基进行突变,研究人员确定K263是PD-L1 C端尾部上唯一被p300乙酰化的残基。Yang Gao等进一步研究了哪些酶可能介导PD-L1去乙酰化,他们发现组蛋白去乙酰化酶2 (HDAC2)的药理和遗传缺失增强了PD-L1的乙酰化。
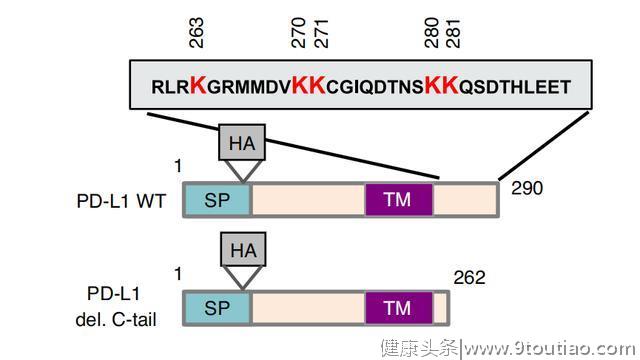
PD-L1 C端尾部结构域和氨基酸残基的示意图
除此之外,研究者还在人和小鼠癌细胞系的细胞核和细胞骨架中检测到PD-L1。他们发现,当PD-L1 C端尾部缺失和HDAC2处理时,PD-L1在细胞核的分布将减少,这表明PD-L1的去乙酰化可能阻止了其向细胞核的易位。
基于上述这些发现,研究团队将工作重点转移到探索PD-L1核易位的分子机制上。最初,质谱分析鉴定出多种PD-L1相互作用分子,包括内吞作用和核转运蛋白,以及亨廷顿相互作用蛋白1相关蛋白(HIP1R)。
研究人员注意到PD-L1乙酰化降低了HIP1R与PD-L1的相互作用,并且在HIP1R敲除细胞中,核PD-L1显著降低,这表明该蛋白可能在PD-L1向细胞核转移的过程中发挥重要作用。
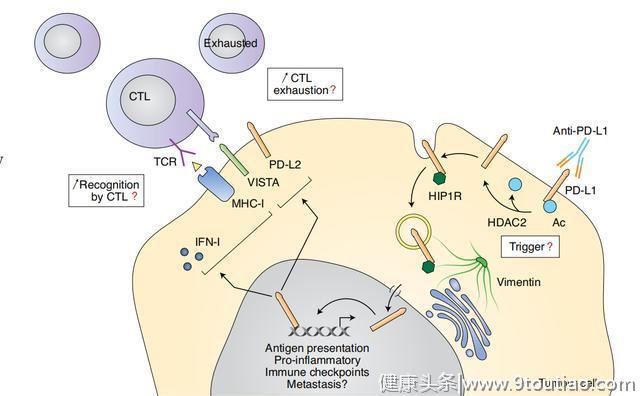
去乙酰化依赖的PD-L1核易位促进肿瘤免疫逃避
事实上,研究团队发现HIP1R可以被货物接头蛋白识别,从而诱导网格蛋白介导的内吞作用,PD-L1与中间丝蛋白Vimentin识别,可使其通过细胞骨架转运至细胞核,然后核转运蛋白(importins)介导其核易位。
RNA-seq和ChIP-seq分析表明,细胞核内的PD-L1可以与DNA结合,并作为基因转录的调节因子。
通过RNA-seq分析,研究人员发现在PD-L1敲除细胞中发现了PD-L1 ChIP-seq峰基因和差异表达基因之间存在较大的重叠。PD-L1敲除细胞中下调的基因具有PD-L1重合峰,并且发现多种转录因子具有全新的PD-L1特异性结合基序。
这一结果支持了PD-L1依赖的基因表达是通过PD-L1与DNA或与DNA结合的转录因子相互作用介导的。
通过遗传或药理学方法抑制PD-L1的乙酰化,可以防止其核易位,促进免疫基因的重编程。基于此,研究人员结合抗PD-1/PD-L1治疗和HDAC2抑制剂,以此抑制PD-L1核易位,并在小鼠肿瘤模型取得成功的治疗结果。
与此同时,本研究还报道了核PD-L1能够上调肿瘤细胞的PD-L2和VISTA等免疫检查点基因,从而促进肿瘤细胞对PD1/PD-L1阻断疗法的耐药性的产生。此外,核PD-L1似乎还能强烈诱导免疫应答相关基因,包括Ⅰ型和Ⅱ型干扰素信号通路、NF-kB信号通路和抗原呈递通路。
这些结果表明,核PD-L1可能增加肿瘤微环境的炎症反应,促进新抗原递呈,同时也促进抗肿瘤免疫逃逸。
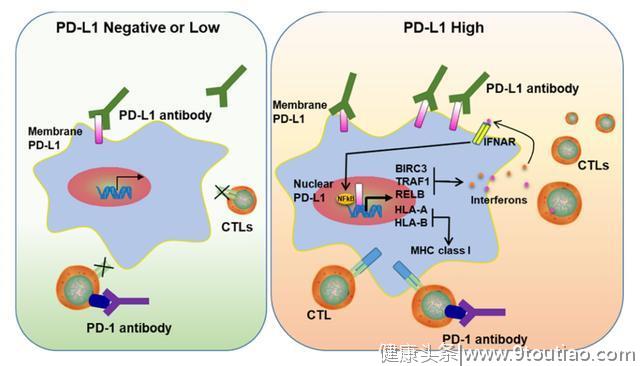
模式图显示核PD-L1如何通过影响免疫相关基因的表达来增强免疫治疗反应
简而言之,核PD-L1具有复杂的双重作用,既可以促进肿瘤发生,也能抑制肿瘤免疫逃逸。这种双重作用引发了核PD-L1控制其转录调节活性的机制问题。然而,事实上,究竟是什么决定了PD-L1刺激某种通路而不是另一种通路,还有待阐明。
综上所述,这项研究阐明了PD-L1核定位的乙酰化依赖调节,使人们对PD-L1途径有了更深入的了解。十分有趣的是,研究人员还揭示了核PD-L1对肿瘤的双重作用,其参与促炎通路和免疫检查点基因控制可能对免疫检查点阻断疗法和HDAC抑制剂的使用有重要的指导意义。

虽然还需要更多的研究来更好地理解调控核PD-L1活性的机制以及它与肿瘤侵袭性的关系,但不得不说的是,这项研究是解开这个谜题的一个重要部分。
参考资料: