癌症患者的春天!中国制造的抗癌新药泽布替尼,凭什么冲出世界?
据人民日报消息,2019年11月15日6时,美国食品药品监督管理局(FDA)宣布:中国企业百济神州自主研发的抗癌新药“泽布替尼”,以“突破性疗法”的身份,“优先审评”获准上市。
由此,泽布替尼成为第一个在美获批上市的中国本土自主研发抗癌新药,改写了中国抗癌药“只进不出”的尴尬历史。
这是全球癌症患者的福音,更是中国新药研发的里程碑。
进口抗癌药的国内现状
进口比重大
《2017中国肿瘤登记年报》数据显示,中国每年新发癌症病例429万。在这一背景下,中国抗癌药市场规模超过千亿元,而其中约一半依赖进口。
因《我不是药神》而红遍中国的高价进口药格列卫和易瑞沙、多吉美、曲妥珠单抗、贝伐珠单抗、瑞戈非尼、PD-1药物keytruda(俗称“k药”)、奥沙利铂、紫杉醇等许多常用的口服、放化疗药都是进口药。
而国产仿制药良莠不齐,本土研发能力弱,造成了中国抗癌药品市场仍需大量进口抗癌药的局面。
药价不菲
进口的抗癌药与国产的抗癌药相比确实有很大的进步,治疗效果更好,癌症患者的生存率显著提高,但是进口抗癌药的价格也比国产药和国产仿制药高10多倍。

比如格列卫,格列卫原研药在中国大陆的零售价格为全世界最高,需要23000-25000元。
有媒体做过调查统计,格列卫在美国的售价是13600左右,澳大利亚为12700,香港18000,日本16440,韩国只要9720元人民币左右,是全世界30多个销售国家中最低的。甚至在泰国、柬埔寨的格列卫都是纳入医保的。
在中国,谈癌色变,因病致穷的人数不胜数。
去年5月开始,国家实施了进口抗癌药零关税,减免了抗癌药5%的价格。去年7月,实行医院药品零加成等多项政策,然而进口药品缺仍然可以保持15%的药品加成。
所以,想要解决进口药降价问题,需要政府与药企进一步谈判,还需要将更多进口抗癌药加入医保。保证大部分病人都吃得起药。
审批慢
2018年以前,中国的食药监总局一向以审批耗时漫长“著称”,一般药品再中国上市需要3-5年,而美国仅需300天,欧洲需要一年。
2012-2016年全球新上市了55种抗肿瘤药物,只有美国、德国和英国三个国家的患者可以用到其中40种以上,大部分国家上市率不到一半。而在中国直到2017年也只能用到其中9种。
对于癌症病人来说,他们每一天都要和时间赛跑,每天都是数着太阳过日子的,实在等不起这漫长的审批时间。
2018年,中国加快了进口药品审批的流程,把新药审批时间控制在12个月,2018年批准的抗癌新药数量增加了157%。
本土新药泽布替尼
这款中国本土研发的抗癌新药泽布替尼不仅改写了中国抗癌药“只进不出”的尴尬历史,对广大的中国患者来说更是福音。
首先,作为国产药,不需要另外的17%的增值税,药品在价格方面会比以往的进口药便宜很多。
在国家将17类抗癌药纳入医保之后,这款国产新药也很有可能被纳入医保,惠及更多的患者。
最后,作为在中国本土研发的抗癌新药,2018年10月,中国国家药品监督管理局(NMPA)正式受理了泽布替尼针对复发难治性套细胞淋巴瘤(MCL)、复发难治性慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)两个适应证的新药上市申请,并纳入优先审评。
2019年1月,泽布替尼曾获FDA授予的“突破性疗法认定”,成为首个获得该认定的本土研发抗癌新药。
8月,FDA正式受理了泽布替尼的新药上市申请,并授予其优先审评资格。
11月15日,泽布替尼获得美国食品药品监督管理局(FDA)批准用于治疗既往接受过至少一项疗法的套细胞淋巴瘤(MCL)患者。
作为FDA和中国都获得优先评审的药物在一定程度上反映了新药的疗效。
从目前中国药品审批的时间来看,泽布替尼在中国上市的时间也不远了,可以挽救更多的患者。
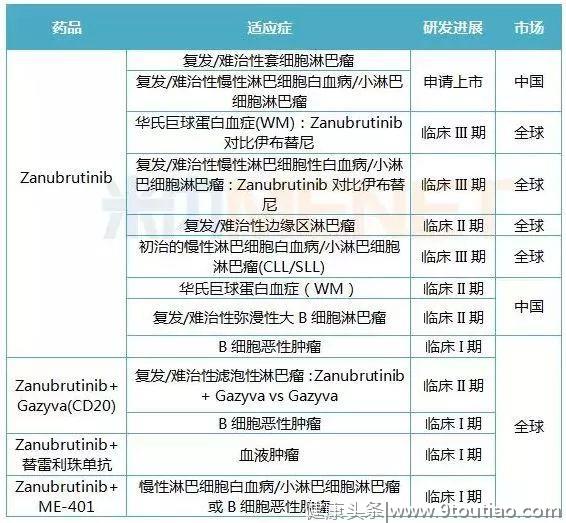
泽布替尼的临床作用
泽布替尼获得FDA批准是基于两项临床试验的有效性数据。
其中一项治疗复发/难治性MCL患者的多中心的2期临床试验中,患者在接受泽布替尼治疗后,总缓解率(ORR)达到84%,包括59%的完全缓解(CR),这项试验的中位持续缓解时间(DOR)为19.5个月,中位随访时间为18.4个月。

泽布替尼获得美国食品药品监督管理局(FDA)批准用于治疗既往接受过至少一项疗法的套细胞淋巴瘤(MCL)患者。
泽布替尼在中国申请治疗复发难治性套细胞淋巴瘤(MCL)、复发难治性慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)的两项适应证仍在审批中,有望延长复发难治性套细胞淋巴瘤患者的生存时间,为患者带来了新的希望。
中国北京大学肿瘤医院大内科主任、淋巴瘤科主任朱军教授表示:这一突破是我国本土生物医药行业和临床肿瘤研究的一个重要里程碑,标志着我们不仅能为中国患者研发新药,也能让更多国家的患者受益其中,为世界提供中国的方案,贡献中国的智慧。
医闻速递,美好的一天从阅读一篇有温度的文章开始,期待您的关注!
"