收藏丨最新癌症免疫治疗药物汇总,都能治疗哪些癌症
提起抗癌治疗最火爆的领域,除了靶向治疗以外,就是免疫治疗了,2018年,随着PD-1单抗的两种药物相继在中国上市,肿瘤免疫治疗(特指免疫检查点抑制剂)的大幕在中国就此拉开。
免疫治疗之所以火爆,除了其表现出的良好效果,还有其颠覆性的治疗理念,它第一次把外源性杀伤治疗的理念转向了人体自身的免疫杀伤系统,调动人体天然存在的免疫细胞去主动杀伤癌细胞,以此来达到抗肿瘤的目的,事实证明,免疫治疗抗瘤谱广,而且这种治疗一旦有效,作用相对持久,有望达到长期控制肿瘤的目的。
所以有人预测,2019年,肿瘤免疫治疗有望与手术、放疗、化疗和靶向治疗“并驾齐驱”,成为晚期肿瘤的主流治疗方案。
目前,全球有大量的免疫治疗药物在研,但是到目前为止,已经上市的药物共有9种,在国内上市的药物有4种,其中包括去年上市的两款进口药和刚刚上市的两款国产免疫治疗药物。

以下就目前免疫治疗药物的现状一一介绍。
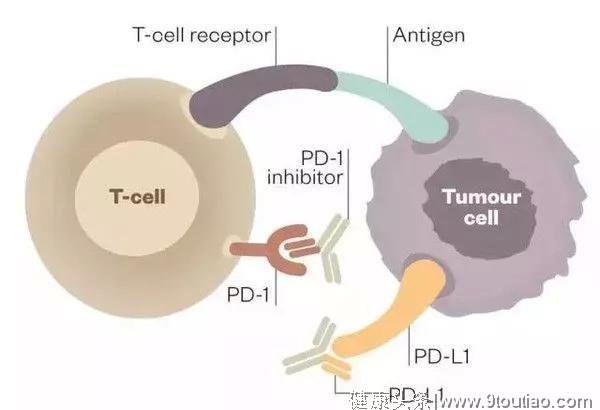
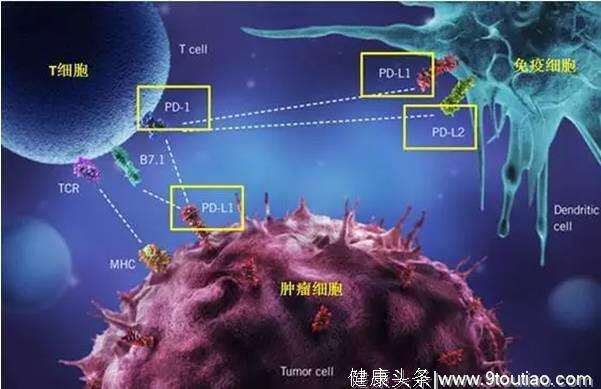
免疫治疗药物可以分为2类,分别是CTLA-4抑制剂和PD-1/L1抑制剂。
CTLA-4抑制剂
数据库显示,全球共有32款涉及CTLA-4靶点的在研药物,从药品类型来看,包括29款抗体类和3款CAR-T细胞疗法。从研发进展看,只有1款已上市,也就是目前临床在用的伊匹木单抗(ipilimumab),1款处于3期临床,其余大部分处于早期临床阶段。
目前,有10中国家企业已布局CTLA-4靶点药物,共11个品种,均处于临床早期或临床前阶段。从药品类型看,单抗、双抗、单域抗体和CAR-T细胞疗法均有涉及。
伊匹木单抗(ipilimumab):
作为世界上第一个免疫检查点抑制剂,也是唯一一个上市的CTLA-4抑制剂,伊匹木单抗对免疫治疗的研发可以说起到了一个引领的作用。它的作用机制是阻断T细胞上“刹车”蛋白CTLA-4的活性,恢复免疫系统对抗癌症的能力。伊匹木单抗最早于2011年被美国FDA批准上市,用于治疗转移性恶性黑色素瘤。
获得批准的适应症及时间:
2011年3月25日,批准用于晚期恶性黑色素瘤;
2015年10月1日,联合纳武单抗用于BRAF野生型不可切除或转移性恶性黑色素瘤。
2015年10月28日,单药用于不可切除或转移性黑色素瘤,降低术后黑色素瘤复发的风险。
2016年1月23日,联合纳武单抗用于BRAF野生型及BRAF突变阳性不可切除或转移性黑色素瘤。
2017年7月24日,单药用于儿科患者12岁及以上不可切除或转移性黑色素瘤。
2018年4月16日,一线治疗中高危晚期肾细胞癌。
2018年11月7日,联合纳武单抗治疗错配修复缺陷/微卫星不稳定-高(dMMR/MSI-H)的转移性结直肠癌化疗后进展的患者。
该药目前尚未在中国上市。
PD-1/L1抑制剂
2014年,纳武利尤单抗(nivolumab)作为全球第一个PD-1抑制剂获批上市,随后在数年内,包括PD-1/PD-L1抗体在内的多个免疫检查点抑制剂获批,治疗病种涵盖了转移性非小细胞肺癌、胃癌和肝癌等在内的多个癌种。到目前为止,美国FDA已经批准上市了6个PD-1/PD-L1抑制剂,我国自主生产并获批上市的有2个。
一、PD-1抑制剂
1、纳武利尤单抗(nivolumab,O药):
O药是首个获批进入中国市场的免疫抑制剂,O药的获批,结束了国内没有免疫药物可用的历史,与此同时,也拉开了国内肿瘤免疫治疗的新篇章。
获得批准的适应症及时间:
2014年12月22日,纳武单抗获批上市,用于治疗经复发转移性黑色素瘤。
2015年3月4日,获批用于转移性鳞状非小细胞肺癌
2015年10月1日,与伊匹木单抗联合用于BRAF野生型转移性黑色素瘤的治疗。
2015年10月9日,经治疗后,转移性非鳞状非小细胞肺癌。
2015年11月23日,用于抗血管生成药物治疗后进展的晚期肾细胞癌。
2015年11月23日,获批用于BRAF野生型转移性黑色素瘤的一线治疗。
2016年1月23日,获批转移性黑色素瘤的治疗(不限BRAF突变状态)。
2016年1月23日,与伊匹木单抗联合用于转移性黑色素瘤的治疗(不限BRAF突变状态)。
2016年5月17日,获批用于晚期经典霍奇金淋巴瘤。
2016年11月10日,获批头颈部鳞状细胞癌(二线)。
2017年2月2日,经治后转移性尿路上皮癌(一种膀胱癌)。
2017年8月1日,单药用于既往接受化疗(氟尿嘧啶、奥沙利铂、伊立替康)后疾病进展的高微卫星不稳定性(MSI-H)或 错配修复缺陷(dMMR)的转移性结直肠癌儿童(12岁及以上)和成人患者。
2017年9月22日,获批用于经索拉菲尼治疗进展的肝细胞癌。
2017年12月20日,获批用于累及淋巴结或转移性黑色素瘤完全切除后的辅助治疗。
2018年4月16日,与伊匹木单抗联合用于中高危晚期肾细胞癌的治疗(一线)。
2018年7月10日,与伊匹木单抗联合用于既往接受化疗(氟尿嘧啶、奥沙利铂、伊立替康)后疾病进展的高微卫星不稳定性(MSI-H)或 错配修复缺陷(dMMR)的转移性结直肠癌儿童(12岁及以上)和成人患者。
2018年8月16日,获批用于既往接受过铂类化疗和至少一种其它疗法后疾病进展的转移性小细胞肺癌(SCLC)患者。
该药已经于2018年6月15日在我国上市。
2、帕博利珠单抗 (Pembrolizumab,K药):
K药是目前用于治疗晚期瘤种最广泛的免疫治疗药物,已在80多个国家获批使用,覆盖了9个瘤种的超过12个的适应症,包括黑色素瘤、非小细胞肺癌、头颈癌、霍奇金淋巴瘤、膀胱癌、宫颈癌、胃癌、B细胞淋巴瘤等。
获得批准的适应症及时间:
2014年9月4日,获批用于不可切除的或转移性晚期黑色素瘤。
2015年10月2日,获批晚期(转移性)非小细胞肺癌
2015年12月18,获批晚期黑色素瘤的一线治疗。
2016年8月8日,用于复发性或转移性头颈部鳞状细胞癌。
2016年10月24日,用于一线治疗PD-1高表达(≥50%)、无EGFR或ALK突变的晚期非小细胞肺癌。
2017年3月15日,用于难治性经典型非霍奇金淋巴瘤。
2017年5月10日,用于转移性非鳞状非小细胞肺癌的一线治疗,且不受PD-L1表达量的限制。
2017年5月18日,用于局部晚期或转移性尿路上皮癌的一线治疗。
2017年5月23日,用于MSI-H/dMMR突变实体瘤。
2017年9月22日,用于复发性局部晚期或转移性胃癌/胃食管结合部腺癌,且肿瘤表达PD-L1。
2018年6月12日,获批用于正在化疗或化疗后的晚期宫颈癌。
2018年6月13日,获批用于难治性原发性纵隔型弥漫大B细胞淋巴瘤。
该药已经于2018年7月25日在我国上市。
3、cemiplimab-rwlc(Libtayo)
获批适应症及时间:
2018年9月29日获批用于转移性皮肤鳞状细胞癌或不能接受治愈性手术或放疗的局部晚期皮肤鳞癌患者。
这也是美国第一个也是唯一一个特别批准用于治疗晚期的皮肤鳞癌的治疗免疫制剂。
该药尚未在我国上市。
4、特瑞普利单抗(拓益)
特瑞普利单抗注射液是我国企业独立研发、具有完全自主知识产权的生物制品创新药品,2018年12月17日获中国药品监督管理局批准上市,也是国内首个上市的国产PD-1单抗。适用于既往标准治疗失败后的局部进展或转移性黑色素瘤。
目前,该药在国内多家临床中心开展鼻咽癌、胃癌、肺癌、乳腺癌、尿路上皮癌等 10 余个适应症的 I~III 期临床试验。
5、信迪力单抗(达伯舒)
信迪利单抗注射液是我国企业自主研发并拥有完全自主知识产权的1类创新药, 2018年12月24日获得国家药品监督管理局批准,用于治疗经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤。
该药除已获批的霍奇金淋巴瘤适应证以外,目前,其他20余项临床试验在进行中,包括一线治疗非鳞非小细胞肺癌、一线治疗肺鳞癌、二线治疗肺鳞癌、EGFR TKI治疗失败的EGFR突变阳性的非小细胞肺癌、一线治疗胃癌、一线治疗肝癌、一线治疗食管癌、二线治疗食管癌等。

二、PD-L1抑制剂
1、阿特珠单抗(Atezolizumab,T药)
T药是全球首个获批上市的PD-L1抑制剂,也是免疫治疗史上第一个获批用于乳腺癌的免疫药物。
获得批准的适应症及时间:
2016年5月18日,获批用于局部晚期或转移性尿路上皮癌。
2016年8月18日,获批用于铂类药物治疗后进展以及接受EGFR或靶向药物治疗后疾病进展的转移性非小细胞肺癌。
2017年4月17日,获批用于初始治疗不适合顺铂化疗的局部晚期或转移性尿路上皮癌。
2019年3月8日,获批联合白蛋白紫杉醇用于一线治疗无法切除的局部晚期或转移性PD-L1阳性的三阴型乳腺癌。
该药目前尚未在中国上市。
2、德瓦鲁单抗(durvalumab,Imfinzi,I药)
获批适应症及时间:
2017年5月1日获美国FDA批准,治疗晚期或转移性尿路上皮癌患者。
该药目前尚未在中国上市。
3、阿维单抗(Bavencio,avelumab,B药)
获批适应症及时间:
2017年3月23日获批上市,用于转移性Merkel细胞癌,12岁及以上的成人的治疗。
2017年5月9日 获批用于治疗晚期或转移性尿道上皮癌。
该药目前尚未在中国上市。

以上为全球获批上市的所有免疫治疗药物(免疫检查点抑制剂)以及已经获得批准治疗的病种。
免疫治疗虽然火爆,也取得了令人瞩目的成绩,但免疫治疗还存在着很多未知的领域,随着研究和探索的不断深入,以及对医学界对各类恶性肿瘤治疗的经验积累,相信会有越来越多的肿瘤患者能从免疫治疗中获益,这种治疗方法,也将会挽救更多患者的生命。
(图片来源于网络)