重磅!原发性肝癌诊疗规范(2017 年版)要点
2017 年 6 月 26 日,国家卫生计生委办公厅发布了《原发性肝癌诊疗规范(2017年版)》,该规范由中华医学会针对《原发性肝癌诊疗规范(2011年版)》修订而成。本文整理要点如下(点击文末「阅读原文」,可查看指南全文)。
原发性肝癌是目前我国第 4 位的常见恶性肿瘤及第 3 位的肿瘤致死病因,主要包括肝细胞癌(HCC)、肝内胆管癌(ICC)和 HCC-ICC 混合型三种不同病理类型,其中肝细胞癌占到 85%~90% 以上,因此该规范中的「肝癌」指肝细胞癌。
1
高危人群的筛查
肝癌的高危人群主要包括:具有乙型肝炎病毒(HBV)和/或丙型肝炎病毒(HCV)感染、长期酗酒、非酒精脂肪性肝炎、食用被黄曲霉毒素污染食物、各种原因引起的肝硬化、以及有肝癌家族史等的人群,尤其是年龄 40 岁以上的男性风险更大。
血清甲胎蛋白(AFP)和肝脏超声检查是早期筛查的主要手段,建议高危人群每隔 6 个月进行至少一次检查。
2
肝癌的临床诊断标准及路线图
乙型或丙型肝炎以及肝硬化是肝癌的高危因素,对于肝脏占位性病变的诊断和鉴别诊断有重要的价值。近年来,非酒精性脂肪性肝炎(NASH)与肝癌的关系越来越引起重视。
AFP 在缺乏敏感的影像学方法情况下曾用于肝癌的临床诊断,如果 AFP ≥ 400 μg/L,在排除妊娠、慢性或活动性肝病以及生殖腺胚胎源性肿瘤情况下,则高度提示肝癌。
结合肝癌发生的高危因素、影像学特征以及血清学分子标记物,依据路线图的步骤对肝癌做出临床诊断(见图 1)。
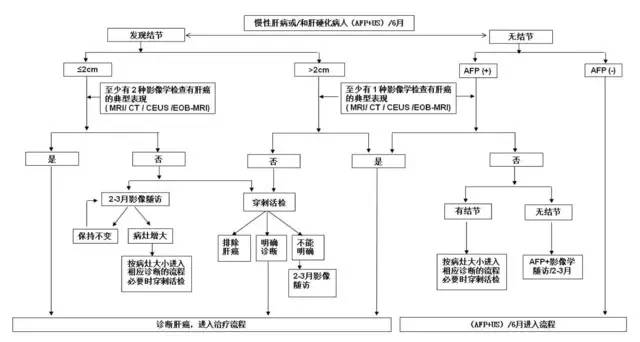
图 1 肝癌诊断路线图(点击可查看大图)
1. 有乙型肝炎或丙型肝炎,或者有任何原因引起肝硬化者,至少每隔 6 个月进行一次超声及 AFP 检测,发现肝内直径 ≤ 2 cm 结节,动态增强 MRI、动态增强 CT、超声造影及普美显动态增强 MRI 四项检查中至少有两项显示有动脉期病灶明显强化、门脉或延迟期强化下降的「快进快出」的肝癌典型特征,则可做出肝癌的临床诊断;对于发现肝内直径>2 cm 的结节,则上述四种影像学检查中只要有一项有典型的肝癌特征,即可临床诊断为肝癌。
2. 有乙型肝炎或丙型肝炎,或者有任何原因引起肝硬化者,随访发现肝内直径 ≤ 2 cm 结节,若上述四种影像学检查中无或只有一项检查有典型的肝癌特征,可进行肝穿刺活检或每 2~3 个月密切的影像学随访以确立诊断;对于发现肝内直径>2 cm 的结节,上述四种影像学检查无典型的肝癌特征,则需进行肝穿刺活检以确立诊断。
3. 有乙型肝炎或丙型肝炎,或者有任何原因引起肝硬化者,如 AFP 升高,特别是持续增高,应该进行上述四种影像学检查以确立肝癌的诊断,如未发现肝内结节,在排除妊娠、活动性肝病、生殖胚胎源性肿瘤以上消化道癌的前提下,应该密切随访 AFP 水平以及每隔 2~3 个月一次的影像学复查。
3
肝癌的分期
依据中国的具体国情及实践积累,推荐下述肝癌的分期方案,包括:Ia 期、Ib 期、IIa 期、IIb 期、IIIa 期、IIIb 期、IV 期,具体分期方案见图 2。

图 2 肝癌临床分期及治疗路线图(点击可查看大图)
4
肝癌的治疗
肝癌诊疗须重视多学科诊疗团队的模式。
1
肝切除术
肝癌的外科治疗是肝癌病人获得长期生存最重要的手段,主要包括肝切除术和肝移植术。
肝癌切除的适应证:
① 肝脏储备功能良好的 Ia 期、Ib 期和 IIa 期肝癌是手术切除的首选适应证,尽管有以往研究显示对于直径 ≤ 3 cm 肝癌,切除和射频消融疗效无差异(证据等级 1),但最近的研究显示外科切除的远期疗效更好(证据等级 1)。
② 在部分 IIb 期和 IIIa 期肝癌病人中,手术切除有可能获得比其他治疗方式更好的效果(证据等级 1),但需更为谨慎的术前评估。对于多发性肝癌,相关研究显示,在满足手术安全性的条件下,肿瘤数目 ≤ 3 枚的多发性肝癌病人可能从手术获益(证据等级 1);若肿瘤数目>3 枚,即使已手术切除,在多数情况下其疗效也并不优于 TACE 等非手术治疗。
③ 对于其它 IIb 期和 IIIa 期肝癌,如有以下情况也可考虑手术切除,如肿瘤数目>3 枚,但肿瘤局限在同一段或同侧半肝者,或可同时行术中射频消融处理切除范围外的病灶;合并门静脉主干或分支癌栓者,若肿瘤局限于半肝,且预期术中癌栓可完整切除或取净,可考虑手术切除肿瘤并经门静脉取栓,术后再结合 TACE、门静脉化疗或其他全身治疗措施;如合并胆管癌栓且伴有梗阻性黄疸,肝内病灶亦可切除的病人;伴有肝门部淋巴结转移者,切除肿瘤的同时行淋巴结清扫或术后外放射治疗;周围脏器受侵犯,但可一并切除者。
肝癌根治性切除标准:
术中判断标准:①肝静脉、门静脉、胆管以及下腔静脉未见肉眼癌栓;②无邻近脏器侵犯,无肝门淋巴结或远处转移;③肝脏切缘距肿瘤边界>1 cm;如切缘< 1 cm,但切除肝断面组织学检查无肿瘤细胞残留,即切缘阴性。
术后判断标准:①术后 2 个月行超声、CT、MRI(必须有其中两项)检查未发现肿瘤病灶;②如术前 AFP 升高,则要求术后 2 个月 AFP 定量测定,其水平在正常范围(极个别病人 AFP 降至正常的时间超过 2 个月)。
2
肝移植术
肝移植是肝癌根治性治疗手段之一,尤其适用于有失代偿肝硬化背景、不适合切除的小肝癌病人。合适的适应证是提高肝癌肝移植疗效,保证宝贵的供肝资源得到公平合理应用的关键。
关于肝移植适应证,国际上主要采用米兰(Milan)标准,美国加州大学旧金山分校(UCSF)标准等。国内尚无统一标准,已有多家单位和学者陆续提出了不同的标准,包括杭州标准 71、上海复旦标准 72、华西标准 73 和三亚共识 74 等。各家标准对于无大血管侵犯、淋巴结转移及肝外转移的要求都比较一致,但是对于肿瘤的大小和数目的要求不尽相同。经专家组充分讨论,现阶段本规范推荐采用 UCSF 标准。
3
局部消融治疗
尽管外科手术是肝癌的首选治疗方法,但因肝癌病人大多合并有肝硬化,或者在确诊时大部分病人已达中晚期,能获得手术切除机会的病人约 20%~30%。近年来广泛应用的局部消融治疗,具有创伤小、疗效确切的特点,使一些不耐受手术切除的肝癌病人亦可获得根治的机会。
局部消融治疗适用于:
单个肿瘤直径 ≤ 5 cm;或肿瘤结节不超过 3 个、最大肿瘤直径 ≤ 3 cm;无血管、胆管和邻近器官侵犯以及远处转移(证据等级 1),肝功能分级为 Child-Pugh A 或 B 级的肝癌病人,可获得根治性的治疗效果。对于不能手术切除的直径 3~7 cm 的单发肿瘤或多发肿瘤,可联合 TACE(证据等级 1)。
常见消融手段包括:
射频消融(RFA):是肝癌微创治疗的最具代表性消融方式,其优点是操作方便,住院时间短,疗效确切,花费相对较低,特别适用于高龄病人。对于直径 ≤ 3 cm 肝癌病人,RFA 的无瘤生存率略逊于手术切除(证据等级 1)。
微波消融(MWA):是我国常用的热消融方法,在局部疗效、并发症发生率以及远期生存方面与 RFA 相比都无显著差异。其特点是消融效率高,避免 RFA 所存在的「热沉效应」。MWA 和 RFA,这两种消融方式的选择可根据肿瘤的大小、位置,选择更适宜的消融方式(证据等级 3)。
无水乙醇注射治疗(PEI):适用于直径 ≤ 3 cm 以内肝癌的治疗,局部复发率高于 RFA,但 PEI 对直径 ≤ 2 cm 的肝癌消融效果确切,远期疗效类似于 RFA。
对于直径 ≤ 5 cm 的肝癌治疗选择:
数项临床前瞻性随机对照和系统回顾性分析显示,手术切除宜首选(证据等级 1)。通常认为,如果病人能够耐受肝切除术,以及肝癌位置表浅或位于肝脏边缘,应首选手术切除。对于 2~3 个癌灶位于不同区域、或者位居肝脏深部或中央型 ≤ 5 cm 的肝癌,局部消融可以达到手术切除疗效,获得微创下根治性消融。
肝癌消融治疗后应重视的评估和随访:
评估局部疗效的规范方法是在消融后 1 个月左右,复查肝脏动态增强 CT 或 MRI,或者超声造影,以评价消融效果。消融效果可分为:①完全消融(CR)②不完全消融(ICR)。对治疗后有肿瘤残留者,可以进行再次消融治疗;若 2 次消融后仍有肿瘤残留,视为消融治疗失败,应放弃消融疗法,改用其他疗法。
完全消融后应定期随访复查,通常情况下每隔 2~3 月复查肿瘤标志物、彩超、MRI 或 CT,以便及时发现可能的局部复发病灶和肝内新发病灶,利用经皮消融微创安全和简便易于反复施行的优点,有效地控制肿瘤进展。
4
TACE 治疗
TACE 治疗目前被公认为肝癌非手术治疗的最常用方法之一(证据等级 1)。
基本原则:
① 要求在数字减影血管造影机下进行;② 必须严格掌握临床适应证;③ 必须强调超选择插管至肿瘤的供养血管内治疗;④ 必须强调保护病人的肝功能;⑤ 必须强调治疗的规范化和个体化;⑥ 如经过 4~5 次 TACE 治疗后,肿瘤仍继续进展,应考虑换用或联合其它治疗方法,如外科手术、局部消融和系统治疗以及放疗等。
适应证:
① IIb 期、IIIa 期和 IIIb 期的部分病人,肝功能分级 Child-PughA 或 B 级,ECOG 评分 0~2;② 可以手术切除,但由于其他原因(如高龄、严重肝硬化等)不能或不愿接受手术的 Ib 期和 IIa 期病人;③ 多发结节型肝癌;④ 门静脉主干未完全阻塞,或虽完全阻塞但肝动脉与门静脉间代偿性侧支血管形成;⑤ 肝肿瘤破裂出血或肝动脉-门脉静分流造成门静脉高压出血;⑥ 控制局部疼痛、出血以及栓堵动静脉瘘;⑦ 肝癌切除术后,DSA 造影可以早期发现残癌或复发灶,并给予介入治疗。
禁忌证:
① 肝功能严重障碍(Child-Pugh C 级),包括黄疸、肝性脑病、难治性腹水或肝肾综合征;② 凝血功能严重减退,且无法纠正;③ 门静脉主干完全被癌栓栓塞,且侧支血管形成少;④ 合并活动性肝炎或严重感染且不能同时治疗者;⑤ 肿瘤远处广泛转移,估计生存期<3 个月者;⑥ 恶液质或多器官功能衰竭者;⑦ 肿瘤占全肝比例 ≥ 70% 癌灶(如果肝功能基本正常,可考虑采用少量碘油乳剂分次栓塞);⑧ 外周血白细胞和血小板显著减少,白细胞<3.0×109/L(非绝对禁忌,如脾功能亢进者,与化疗性白细胞减少有所不同),血小板<50×109/L;⑨ 肾功能障碍:肌酐>2 mg/dL 或者肌酐清除率<30 ml/min。
TACE 术后常见不良反应:
栓塞后综合症,是 TACE 治疗的最常见不良反应,主要表现为发热、疼痛、恶心和呕吐等。发热、疼痛的发生原因是肝动脉被栓塞后引起局部组织缺血、坏死,而恶心、呕吐主要与化疗药物有关。此外,还有穿刺部位出血、白细胞下降、一过性肝功能异常、肾功能损害以及排尿困难等其他常见不良反应。介入治疗术后的不良反应会持续 5~7 天,经对症治疗后大多数病人可以完全恢复。
疗效评价:
根据实体瘤 mRECIST 评价标准以及 EASL 评价标准评估肝癌疗效,长期疗效指标为病人总生存时间(OS);短期疗效:评价指标为肿瘤的影像学应答和手术至疾病进展时间(TTP)。
5
放疗
放疗分为外放疗和内放疗。
外放疗
适应证:
对伴有门静脉/下腔静脉癌栓或肝外转移的 IIIa 期、IIIb 期肝癌病人,多属于姑息性放疗,有一部分病人肿瘤缩小或降期,可获得手术切除机会(证据等级 3)。肝外转移包括淋巴结转移、肺转移、骨转移、肾上腺转移、脑转移、腹膜和胸腔内膜转移等,也可用于等待肝癌肝移植前的治疗。对肝外转移的病人,外放疗可减轻疼痛、梗阻或出血等症状,使肿瘤发展减缓,从而延长生存期(证据等级 3)。中央型肝癌切缘距肿瘤 ≤ 1 cm 的窄切缘术后可以辅助放疗(证据等级 3)。
照射靶区:
大体肿瘤体积(GTV)在增强 CT 中定义,必要时也需要参考 MRI 影像。肝癌出现淋巴引流区转移较少见,因此,临床靶体积(CTV)不包括淋巴引流区。对于已经出现淋巴结转移的病人,必须包括其下一站的淋巴引流区,作为 CTV。其余情况(如局限于肝内、癌栓、肾上腺、肺转移等)的 CTV 为影像学可见的病灶外扩 2 到 4 mm100。肿瘤移动度可以通过透视评估,但 4D 模拟 CT 技术更为准确。在常规放疗技术情况下,计划靶体积(PTV)一般在 CTV 基础上外放 5~15 mm。
照射剂量和正常组织耐受剂量:
立体定向放疗时,肝功能为 Child-Pugh A 级,正常肝体积超过 700 ml,<15 Gy×3 次,正常肝>800 ml,<18 Gy×3 次是安全剂量;一般推荐放疗剂量 ≥ 30~60 Gy/3~6 次。对姑息性放疗的肝癌病人,肿瘤的放疗剂量基本上取决于全肝和/或周围胃肠道的耐受量,大部分的报道以 40~70 Gy 常规分割剂量。
正常组织耐受剂量:肝功能为 Child-Pugh A 者,常规分割放疗时,全肝的耐受量为 28~30 Gy,或非常规低分割放疗(每次分割剂量 4~8 Gy)全肝的耐受量为 23 Gy。肝功能为 Child-Pugh B 者,肝脏对射线的耐受量明显下降。由于亚洲 HCC 病人常伴有肝硬化和脾功能亢进,导致胃肠道瘀血和凝血功能差,胃肠道的放射耐受剂量低于 RTOG 推荐的剂量。
放疗技术:
建议应用三维适形放疗 (CRT))、调强放疗(IMRT)、图像引导放疗(IGRT)或立体定向放疗(SBRT)。图像引导下的调强放射治疗技术优于三维适形放疗,螺旋断层放疗设备作为图像引导下的调强放疗,适合多发病灶的肝癌病人。肝癌的立体定向放射治疗必须满足以下条件:有四维 CT 的影像设备引导或肿瘤追踪系统,非常精确的病人体位固定,放射治疗前的个体化图像校正,放射治疗设备能聚焦到肿瘤以及肿瘤之外的射线梯度下降快。目前缺乏较高级别的临床资料支持质子放疗在肝癌病人的生存率优于光子。
内放疗
放射性粒子植入是局部治疗肝癌的一种有效方法,包括 90Y 微球疗法 107、131I 单克隆抗体、放射性碘化油、125I 粒子植入等,放射性粒子可持续产生低能 X 射线、γ射线或β射线,在肿瘤组织内或在受肿瘤侵犯的管腔(门静脉、下腔静脉或胆道)内植入放射性粒子后,通过持续低剂量辐射,最大程度杀伤肿瘤细胞。粒子植入技术包括组织间植入、门静脉植入、下腔静脉植入和胆道内植入,分别治疗肝内病灶、门静脉癌栓、下腔静脉癌栓和胆管内癌或癌栓。
6
全身治疗
对于没有禁忌证的晚期肝癌病人,全身治疗可以减轻肿瘤负荷,改善肿瘤相关症状,提高生活质量,延长生存时间。
1. 抗肿瘤治疗
分子靶向药物:
迄今为止,索拉非尼仍然是唯一获得批准治疗晚期肝癌的分子靶向药物。两项大型国际多中心 III 期临床试验均充分证明了索拉非尼对于不同国家地区、不同肝病背景的晚期肝癌都具有一定的生存获益(证据等级 1)。
常规推荐用法为 400 mg,po.,bid,应用时需注意对肝功能的影响。最常见的不良反应为腹泻、体重下降、手足综合征、皮疹、心肌缺血以及高血压等(证据等级 1),一般发生在治疗开始后的 2~6 周内,可用于肝功能 Child A、B 级的病人(证据等级 1)。而相对于肝功能 Child B 级,ChildA 级的病人生存获益更明显。
系统化疗:
传统的细胞毒性药物,包括阿霉素、表阿霉素、氟尿嘧啶、顺铂和丝裂霉素等,在肝癌中的单药或传统联合用药有效率均不高,且毒副作用大,可重复性差。一个主要原因为化疗药物不但会激活乙肝病毒复制,还会损害病人的肝功能,加重肝炎肝硬化,导致化疗无法带来生存效益。
根据 EACH 研究后期随访的数据,含奥沙利铂的 FOLFOX4 方案在整体反应率、疾病控制率、无进展生存期、总生存期方面,均优于传统化疗药物阿霉素,且耐受性和安全性较好(证据等级 2)。因此,奥沙利铂在我国被批准用于治疗不适合手术切除或局部治疗的局部晚期和转移性肝癌。
化疗适应证主要为:
①合并有肝外转移的晚期病人;②虽为局部病变,但不适合手术治疗和 TACE 者,如肝脏弥漫性病变或肝血管变异;③合并门静脉主干或下腔静脉瘤栓者;④多次 TACE 后肝血管阻塞和/或 TACE 治疗后复发的病人。
化疗禁忌证为:
①ECOG PS 评分>2,Child-Pugh 评分>7 分;②白细胞计数<3.0 X 109/L 或中性粒细胞计数<l.5×109/L,血小板计数<60×109/L,血红蛋白<90 g/L;③肝、肾功能明显异常,氨基转移酶(AST 或 ALT)>5 倍正常值和/或胆红素显著升高>2 倍正常值,血清白蛋白<28 g/L,肌酐(Cr)≥ 正常值上限,肌酐清除率(CCr)<50 ml/min;④具有感染发热、出血倾向、中-大量腹腔积液和肝性脑病。
2. 全身治疗的疗效评估
对于化疗病人,仍然采用 Recist 1.1 标准,可同时参考血清学肿瘤标记(AFP)以及肿瘤坏死程度的变化,一般在治疗期间每 6~8 周进行影像学评估,同时通过动态观察病人的症状、体征、治疗相关不良反应进行综合评估。鉴于索拉非尼、TACE 治疗很少能改变肿瘤大小,故建议采用以肿瘤血管生成和密度改变为基础的疗效评估标准(mRecist 标准)。对于免疫治疗的评价,可参照 irRC 标准。
3. 抗病毒治疗及其他保肝治疗
合并有乙肝病毒感染且复制活跃的肝癌病人,口服核苷(酸)类似物抗病毒治疗非常重要。宜选择强效低耐药的药物如恩替卡韦、替比夫定或替诺福韦脂等。
TACE 治疗可能引起乙型肝炎病毒复制活跃,目前推荐在治疗前即开始应用抗病毒药物。抗病毒治疗还可以降低术后复发率(证据等级 1)。因此,抗病毒治疗应贯穿肝癌治疗的全过程。
肝癌病人在自然病程中或者治疗过程中可能会伴随肝功能异常,因此应及时适当的应用保肝药物,如异甘草酸镁注射液(甘草酸二铵肠溶胶囊)、复方甘草酸苷、还原型谷胱甘肽、多磷脂酰胆碱等;抗炎治疗药物如广谱水解酶抑制剂乌司他丁等;利胆类药物如腺苷蛋氨酸、熊去氧胆酸等。这些药物可以保护肝功能、提高治疗安全性、降低并发症、改善生活质量。
本文整理自《原发性肝癌诊疗规范(2017年版)》
编辑:汪小鱼 | 题图来源:Shutterstock