治疗常见膀胱癌,新药获 FDA 突破性疗法资格
Seattle Genetics 和安斯泰来(Astellas Pharma)今天宣布,美国 FDA 为抗体药物偶联物(ADC)enfortumab vedotin 颁发了突破性疗法认定,用于治疗局部晚期或转移性尿路上皮癌患者。
尿道上皮癌最常见于膀胱(90%)。 根据美国癌症协会的统计,2017 年美国约有 79000 人将被诊断为膀胱癌,将近 17000 人将死于这种疾病。确诊为转移性疾病的患者预后很差,5 年生存率为 5%。
Enfortumab vedotin 使用 Seattle Genetics 的专有连接技术,将微管破坏剂 MMAE 和抗 Nectin- 4 单克隆抗体连接。Enfortumab vedotin 可靶向在多种实体瘤上表达的细胞粘附分子 Nectin-4。
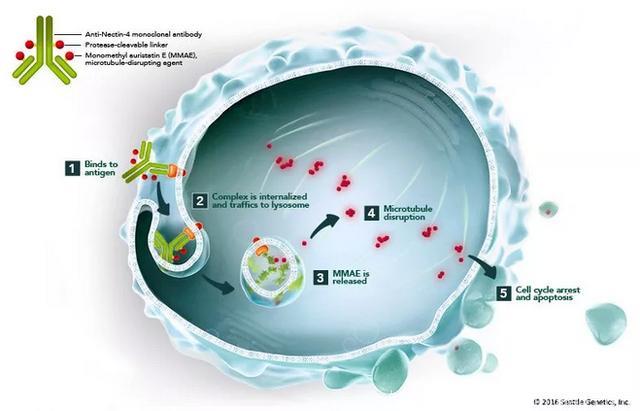
这款新药的潜在作用机理(图片来源:Seattle Genetics 官方网站)
此次突破性疗法认定基于 1 期临床研究的中期结果,该研究将 enuteumab vedotin 作为接受过检查点抑制剂(CPI)治疗的转移性尿路上皮癌患者的单一疗法,主要终点是耐受性,次要终点是根据实体肿瘤疗效评价标准 1.1 版(RECIST v1.1),每 8 周一次评估抗肿瘤活性。Enfortumab vedotin 表现出良好的耐受性,在经过先前治疗,包括接受 CPI 失败的患者中表现出了令人鼓舞的抗肿瘤活性。所有可评估患者(n = 60)的总体缓解率(ORR)分别为 40%(95%CI:27.6-53.5),接受过 CPI 患者的缓解率(n = 24)为 46%(95%CI:25.6-67.2) ,转移至肝脏的患者为 44%(95%CI:19.8-70.1)(n = 16)。在剂量≥1mg/kg 时,完全缓解的患者有 3 例。平均治疗时间为 26 周(范围:5.1-64.6),中位缓解持续时间为 18 周(95%CI:8.4-40.1),中位无进展生存期为 17 周(95%CI:15.1-23.3)。此外,Enfortumab vedotin 还在一项 2 期关键性临床试验 EV-201(NCT03219333)中,作为单独疗法,以及与 CPI 疗法结合的早期临床试验 EV-103(NCT03288545)中进行研究。
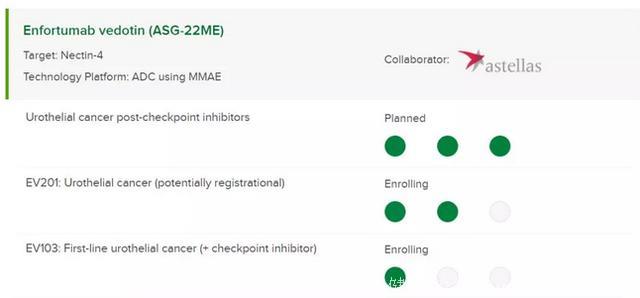
Enfortumab vedotin 是 Seattle Genetics 的领先疗法(图片来源:Seattle Genetics 官方网站)
“FDA 突破性疗法认定强调了 enfortumab vedotin 作为局部晚期或转移性尿路上皮癌患者有意义治疗的潜力。此外,它还支持了我们 ADC 的快速开发计划,包括对该患者人群进行的关键研究,” Seattle Genetics 临床开发高级副总裁 Robert Lechleider 博士说:“Seattle Genetics 公司是一家新兴的多产品肿瘤学公司,目标是改善癌症患者的治疗结果。Enfortumab vedotin 处于我们后期临床管道的最前沿,我们正在与合作伙伴和 FDA 密切合作,尽快为患者提供这种潜在的新疗法。”
“Enfortumab vedotin 的突破性疗法认定是我们向患者带来额外治疗选择的又一进步,”安斯泰来高级副总裁,肿瘤开发全球疗法主管 Steven Benner 先生说:“随着 enfortumab vedotin 2 期试验和 CPI 组合疗法试验的积极开展,安斯泰来期待扩大 enfeumab vedotin 和其他肿瘤管道的开发,针对包括最难治疗的癌症。”
我们期待这款 ADC 疗法的临床试验可以顺利进行,早日为广大癌症患者带来新疗法。
参考资料:
[1] Seattle Genetics and Astellas Receive FDA Breakthrough Therapy Designation for Enfortumab Vedotin in Locally Advanced or Metastatic Urothelial Cancer
[2] FDA hands a ‘breakthrough’ designation to Seattle Genetics’ pivotal-stage cancer drug enfortumab
[3] A phase I study of enfortumab vedotin (ASG-22CE; ASG-22ME): Updated analysis of patients with metastatic urothelial cancer.